高通量测序研究不同程度间歇性低氧致大鼠肠道微生物菌群改变 *
李 雯,赵 丹,万自芳,张湘燕△
(1.贵州医科大学,贵阳 550004;2.贵州省人民医院呼吸与危重症医学科/贵州省人民医院肺脏免疫性疾病重点实验室,贵阳 550002)
慢性间歇性低氧(chronic intermittent hypoxia,CIH)是阻塞性睡眠呼吸暂停低通气综合征(obstructive sleep apnea-hypopnea syndrome,OSAHS)特有的特殊低氧模式[1]。OSAHS是临床常见的综合征,目前普遍认为其是一种全身性疾病,可致多器官损害,是高血压的致病因素,也是中风、缺血性心肌病、心力衰竭、心律失常、糖尿病等疾病的独立危险因素[2]。肠道微生物作为人或动物的“共生体”,辅助宿主进行营养吸收和能量代谢[3]。正常生理状态下肠黏膜处于高灌注状态,对缺血、缺氧十分敏感,机体整体或肠道缺血、缺氧的状态会直接损伤肠黏膜,进一步影响肠道微生物的定殖[4]。CIH所致睡眠剥夺可引起多种应激反应,目前认为肠道菌群移位所致的菌血症和毒素血症是应激反应恶性发展的主要原因,睡眠剥夺可影响大鼠肠道菌群,促进有害的产气荚膜梭菌增殖[5]。本研究采用高通量测序研究不同程度CIH条件下大鼠肠道微生物菌群的改变。
1 材料与方法
1.1 建模及分组
选取健康清洁级雄性Sprague Dawley大鼠30只分为CIH组[A组(O28% 4周)、B组(O28% 8周)]和对照组,每组10只。CIH组大鼠循环给予氮气和氧气充入培养舱,每次循环2 min,维持氧浓度在8% 30 s,恢复氧浓度21% 60 s,每天造模8 h;A组造模4周,B组造模8周。对照组放置于常氧环境饲养8周。留取大鼠粪便样品,用75%乙醇消毒大鼠肛周皮肤,刺激其排便,使用灭菌镊子从大鼠肛门部取出粪便保存于无菌EP管,随后迅速投入液氮,-80 ℃保存至备用。B组大鼠饲养过程中死亡2只,对总体实验测序无影响。
1.2 测序方法
根据E.Z.N.A.®soil试剂盒对大鼠肠道样品进行DNA抽提,DNA浓度和纯度利用NanoDrop2000进行检测,1%琼脂糖凝胶电泳检测DNA提取质量;338F(5′-ACTCCTACGGGAGGCAGCAG-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)引物对V3、V4可变区进行PCR扩增,扩增程序:95 ℃ 预变性3 min,27个循环(95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s),最后72 ℃延伸10 min,PCR仪采用ABI GeneAmp®9700型。扩增体系:20 μL,4.0 μL 5×FastPfu缓冲液,2.0 μL 2.5 mmol/L dNTPs,0.8 μL引物(5 μmol/L),0.4 μL FastPfu聚合酶,补ddH2O至20 μL;10 ng DNA模板。Illumina MiSeq测序,2%琼脂糖凝胶回收PCR产物,AxyPrep DNA Gel Extraction Kit(美国Axygen Biosciences公司)进行纯化,Tris-HCl洗脱,2%琼脂糖电泳检测。QuantiFluorTM-ST (美国Promega公司)进行定量检测。根据Illumina MiSeq平台标准操作规程将纯化后的扩增片段构建PE300的文库。构建文库步骤:(1)连接“Y”字形接头;(2)使用磁珠筛选去除接头自连片段;(3)利用PCR扩增进行文库模板的富集;(4)氢氧化钠变性,产生单链DNA片段。采用美国Illumina Miseq PE300平台进行测序。
1.3 生物信息分析
(1)生物信息分析的流程分析使用QIIME2推荐的DADA2方法,其插件对所有样品的全部原始序列(input)进行质量控制(filtered),去噪(纠正测序错误的序列,denoised),拼接(merged),并且去嵌合体(non-chimeric),形成OTU。OTU被称为扩增特征序列(ASV),以韦恩图表示两组特有或共有的OTU个数。将总OTU与数据库比对,对物种在不同分类水平上进行注释,以profiling 柱状图表示两组物种的相对丰度。(2)LEfSe方法是非参数检验和线性判别分析的结合,适合菌群丰度差异检验;LEfSe寻找每一个分组的特征微生物(LDA大于阈值的微生物,阈值为2,每一横向柱形体代表一个物种,柱形体的长度对应LDA值,LDA值越高则差异越大。柱形的颜色对应该物种是哪个分组的特征微生物,特征微生物表示在对应分组中的丰度相对较高),也就是相对于其他分组,在这个组中丰度较高的微生物组成。(3)α多样性分析是基于OTU分析结果,可反映菌群丰度和多样性,包括chaol、observed-outs、shannon、simpson、ace和faith-pd等指数来评估某个样本的物种多样性,指数越高,表明样本的多样性越复杂。其中shannon用于估算样本微生物多样性,它的计算考虑到样品中的分类总数和每个分类所占的比例,在得到整体的Alpha多样性指数之后用非参数Kruskal Wallis检验方法比较其在各个样品分组之间是否有显著性差异。(4)β多样性分析是对不同样品间的微生物群落构成进行比较。对每个样品的OTU信息构建了未加权的Unifrac距离矩阵(unweightedUnifrac distance matrix)。基于这一矩阵进行主成分分析,点与点之间的距离表示样本菌群差异程度,两点之间的距离越近,表明两个样本之间的微生物群落结构相似度越高,差异越小。在得到整体的Beta多样性指数之后,接下来结合分组信息运用非参数多元方差分析(PERMANOVA)比较在各个样品分组之间的微生物组成结构是否有显著性差异。
1.4 统计学处理
2 结 果
2.1 OTU和丰度分析
在数据按照barcode拆分之后每个样品的实际序列为1 540 848条序列,平均每个样品为55 030条。对照组大鼠OTU为890条,A、B组分别为1 289、1 126条,见图1。根据物种注释结果,各样本物种在门、属水平分类中组成柱状图,可见各样本丰度较高的物种及其比例(图2、3)。门水平:CIH组大鼠共有的优势菌门且丰度从高到低依次为厚壁菌门(Firmicutes)70%、拟杆菌门(Bacteroidetes)22%、螺旋体门(Spirochaetes)3%、放线菌门(Actinobacteria)3%、变形菌门(Proteobacteria)1.2%、TM7 1.2%,对照组大鼠共有的优势菌门且丰度从高到低依次为厚壁菌门(Firmicutes)73%、拟杆菌门(Bacteroidetes)25%、螺旋体门(Spirochaetes)0.1%、放线菌门(Actinobacteria)0.5%、变形菌门(Proteobacteria)0.6%、TM7 0.2%。属水平:CIH组大鼠共有的优势菌群丰度从高到低依次为乳酸菌(Lactobacillus)25%、Unspecified_S24_7 10%、未指明的梭菌目(Unspecified_Clostridiales)10%、未指明的毛螺菌科(Unspecified_Lachnospiraceae)6%、瘤胃球菌属(Ruminococcus)5%、未指明的瘤胃球菌科(Unspecified_Ruminococcaceae)4%、未指明的消化链球菌科(Unspecified_Peptostreptococcaceae)4%、普雷沃菌属(Prevotella)4%、普氏菌-1(Prevotella_1)3%、颤螺旋体菌属(Oscillospira)3%、未指明的梭菌科(Unspecified_Clostridiaceae)3%、密螺旋体属(Treponema)3%、拟杆菌属(Bacteroides)2%、苏黎世杆菌属(Turicibacter)2%、粪球菌属(Coprococcus)1%、未指明的F16(Unspecified_F16)1%、蜚蠊目(Blautia)1%、Dorea 1%,对照组大鼠共有的优势菌群丰度从高到低依次为乳酸菌(Lactobacillus)46%、Unspecified_S24_7 12%、普雷沃菌属(Prevotella)8%、未指明的梭菌目(Unspecified_Clostridiales)6%、未指明的毛螺菌科(Unspecified_Lachnospiraceae)4%、瘤胃球菌属(Ruminococcus)3%、未指明的瘤胃球菌科(Unspecified_Ruminococcaceae)3%、未指明的消化链球菌科(Unspecified_Peptostreptococcaceae)3%、普氏菌-1(Prevotella_1)3%、颤螺旋体菌属(Oscillospira)2%、未指明的梭菌科(Unspecified_Clostridiaceae)2%、未指明的拟杆菌属(Unspecified_Bacteroidales)1%。
2.2 OTU差异性分析
门水平LEfSe差异分析:在CIH组起主要作用的微生物群为螺旋体门(Spirochaetes)、放线菌门(Actinobacteria)、变形菌门(Proteobacteria),见图4。CIH组大鼠肠道菌群丰度较高的有梭菌目、瘤胃球菌科、螺旋体纲、螺旋体门、螺旋体目、密螺旋体属、毛螺菌科等;对照组大鼠肠道菌群丰度较高的有乳酸杆菌科、乳杆菌属、乳杆菌目、杆菌纲、普雷沃氏菌属等,两组属水平肠道菌群有显著差异,见图5。随着低氧时间延长,肠道菌群多样性越大,见图6~8。

图1 各组大鼠OTU韦恩图

A1~A10:A组;B1~B8:B组;C1~C10:对照组。

A1~A10:A组;B1~B8:B组;C1~C10:对照组。
2.3 α多样性分析
对照组大鼠shannon指数与simpson指数与A组、B组比较差异有统计学意义(P<0.05),且随着低氧时间延长,差异越大。A组和B组大鼠shannon指数差异无统计学意义(P>0.05),图9~11,表1、2。

图4 门水平LEfSe分析LDA柱形图
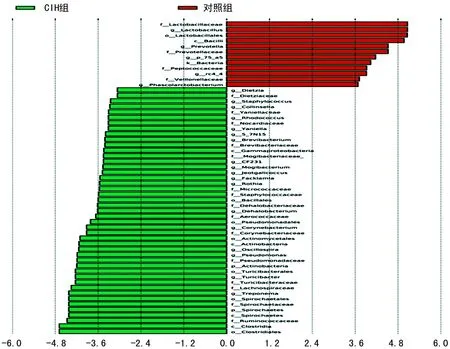
图5 CHI组和对照组属水平LEfSe分析LDA柱形图

图6 A组和对照组属水平LEfSe分析LDA柱形图

图7 B组和对照组属水平 LEfSe分析LDA柱形图
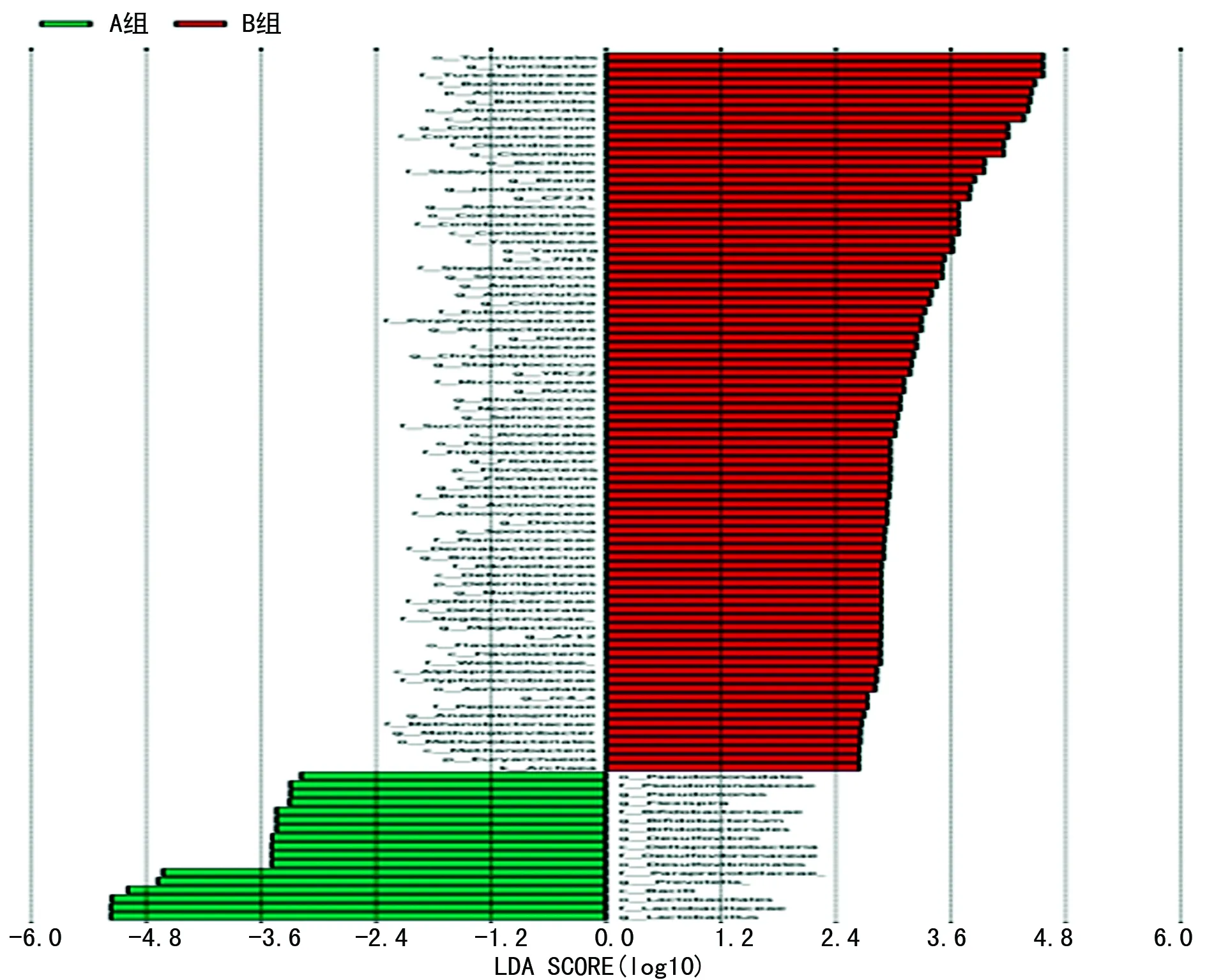
图8 A组和B组属水平 LEfSe分析LDA柱形图
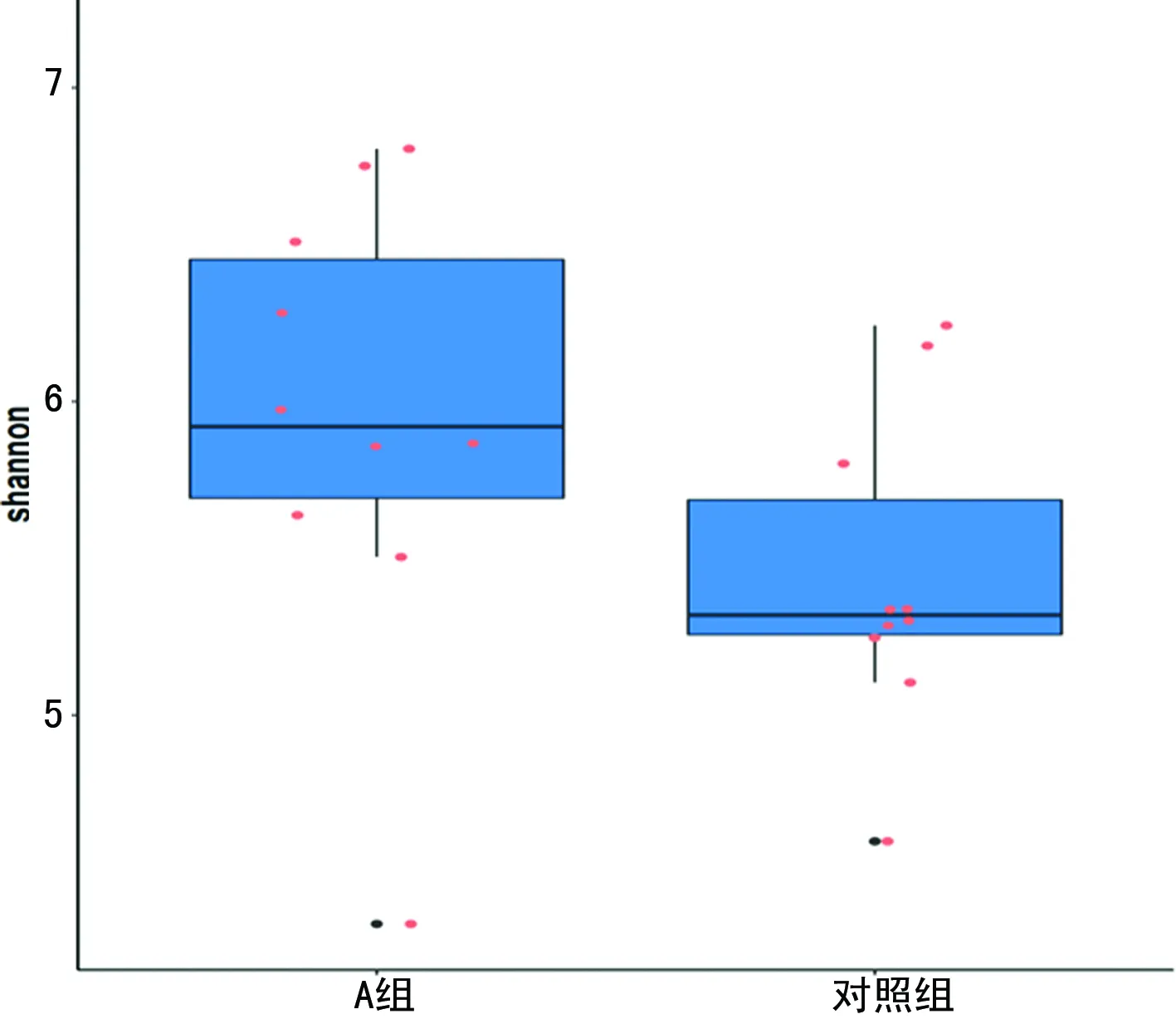
图9 A组和对照组shannon指数的箱型图

图10 A组和B组shannon指数的箱型图
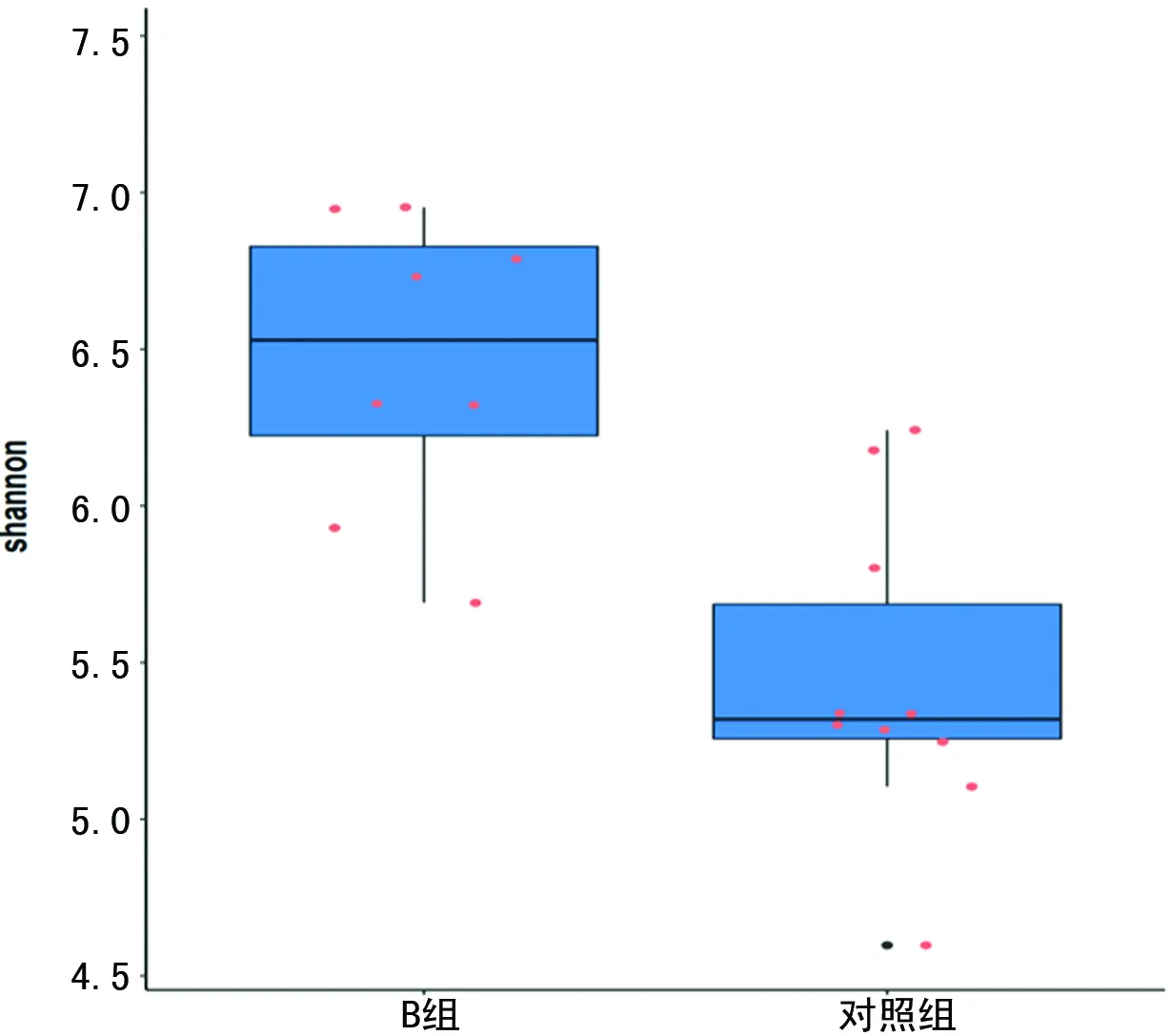
图11 B组和对照组shannon指数的箱型图

表1 各组大鼠肠道微生物群落α多样性分析

表2 两组大鼠各指数比较
2.4 β多样性分析
对照组与CIH组主成分分析显示,前两个主成分分别解释了总变量的32.8%和9.4%,见图12。在X轴的方向上两组大鼠肠道菌群相距较远,低氧造成菌群差异较大。各个样品分组之间微生物菌群有显著差异,见图13。

图12 两组肠道菌群的主成分分析
A:CIH组对对照组箱型图;B:对照组对CIH组箱型图。
3 讨 论
人体消化道中存在丰富的绒毛、微绒毛,微生物可以通过分泌黏液因子在其中定殖。人体肠道中有约100万亿个细菌,生理状况下,各系统、器官的相互协调、肠道特有的屏障功能保护,细菌和各类有毒物质不会对机体产生伤害。如果这些屏障遭到破坏,微生态平衡被打破,细菌和各种毒素可穿过肠壁,侵入机体各个系统及器官,如淋巴结、血液、肝、脾等,即肠道菌群移位。人或动物的肠黏膜处于高灌注状态,因此对缺血、缺氧十分敏感。机体整体或肠道缺血、缺氧的状态会直接损伤肠道黏膜系统,导致肠道微生物菌群发生改变、菌群移位[6-8]。CIH是OSAHS的一种低氧模式,机体反复发生低氧、复氧过程中,可能引起类似缺血-再灌注的病理生理改变,产生大量的活性氧(reactive oxygen species,ROS),进一步激活炎性反应,引起全身性效应。笔者通过肠道菌群高通量测序发现对照组大鼠肠道菌群结构与CIH组有显著差异。属水平CIH组大鼠肠道菌群丰度较高的有梭菌目、瘤胃球菌科、螺旋体纲、螺旋体门、螺旋体目、密螺旋体属、毛螺菌科等,对照组大鼠肠道菌群丰度较高的有乳酸杆菌科、乳杆菌属、乳杆菌目、杆菌纲、普雷沃氏菌属、普雷沃氏菌科等。从以上可看出,低氧条件下大鼠肠道菌群发生改变,有害细菌增殖,益生菌减少。CIH所致肠道菌群改变类似于现代“肺-肠”轴理论的变化,它是肺部与肠道的双向连接,故肺部发生疾病时,肠道微生物也会产生影响。就如同中医有“肺病治肠、肠病治肺、肺肠同治”的观念。肠道是人体微生物菌群最丰富的地方,虽然下呼吸道细菌少之又少但其菌群组成上与肠道相似。共同黏膜反应观点指出机体在一个黏膜部位接收抗原递呈细胞刺激后,细胞可以迁移至其他黏膜部位,肠道菌群的微生态可以从局部影响全身的免疫反应,从而影响肺黏膜[9]。微生物群与固有免疫系统的模式识别受体相互作用,调节炎性反应和固有免疫反应。其次肠道菌群代谢产生如乙酸盐、丙酸盐和丁酸盐等短链脂肪酸,其可以通过激活核因子-κB信号通路影响免疫细胞迁移、激活、增殖和凋亡,从而发挥抗炎作用,诱导产生调节性T细胞,调节免疫功能,预防过敏性气道炎症的发生[10-11]。益生菌可以通过对免疫细胞发挥直接作用,促进健康的代谢物的释放,进一步影响微生物群。THORBURN 等[12]实验研究通过高纤维或乙酸盐喂养小鼠,增加了肺组织中调节T细胞数量和功能,抑制过敏性气道疾病。有实验研究建立脓毒血症老鼠模型,在实验性脓毒症结束后,通过细菌16S核糖体RNA编码基因的测序发现肺群落以存活的肠道相关细菌为主,表明肺微生物群的肠-肺易位和改变可能是脓毒症和急性呼吸窘迫综合征(ARDS)发病的共同机制[13]。有关文献报道将大鼠建立睡眠剥夺模型,分为模型组及对照组,结果显示模型组肠道内产气荚膜梭菌数量增加,而其他菌群数量如大肠杆菌、双歧杆菌、乳酸杆菌则呈现不同程度下降[14]。
有研究推断毛螺菌在无菌受者中,毛螺菌株的定植,导致空腹血糖升高、肝脏和肠系膜脂肪组织重量增加、血浆胰岛素水平降低等,从而推测毛螺菌促进细菌脂多糖移位从消化道进入血液[15]。有研究发现睡眠碎片化小鼠引起食物摄入增加和可逆的肠道微生物群变化,其特征是毛螺菌和瘤肾球菌的细菌成员优先生长,乳酸杆菌科减少,这些导致全身和内脏白色脂肪组织炎症,进一步导致肠道上皮屏障破坏[16]。有关研究发现益生菌如乳酸杆菌能产生β-葡聚糖,使小肠黏膜上皮细胞表面的黏液更加黏稠,并且更能耐受外界各种有害物质及致病菌对肠道黏膜的损伤[17]。本实验中通过OUT丰度分析发现,属水平CIH组大鼠乳酸菌(25%)远低于对照组(46%)。
Treg缺失介导的自身免疫性疾病模型小鼠的肠道菌群进行基因检测,结果发现小鼠模型肠道菌群发生了严重的紊乱,根据肠道菌群和代谢组谱的变化,选择罗伊氏乳酸杆菌和代谢产物肌苷处理Treg缺失小鼠,罗伊氏乳酸杆菌和肌苷通过激活腺苷受体A2AR抑制了Treg缺失引起的自身免疫性疾病[18]。随着人们生活质量的提高,OSAHS确诊率的提高,目前越来越多的研究证实OSAHS并不是孤立的疾病,其与机体代谢、免疫、心血管系统疾病、肠道菌群紊乱密切相关。因此,更深入认识“肺-肠”轴之间的相关性,将会是了解OSAHS整个过程中肠道菌群的变化规律的切入点,深入研究肠道菌群改变对机体的影响,通过调节肠道菌群紊乱进一步纠正慢性CIH症状,有望成为治疗OSAHS及各种相关疾病的靶点。

