瞬时受体电位通道在心脏纤维化中作用的研究进展
于芃,彭文艺,曹丰,李霜*
(1西部战区总医院心血管内科,成都 610083; 2空军军医大学西京医院心血管内科,西安 710032;3解放军总医院国家老年疾病临床医学研究中心, 北京 100853; 4解放军总医院第二临床医学中心心血管内科,北京 100853)
心血管疾病(cardiovascular diseases,CVDs)是威胁人类健康的主要原因[1]。心脏纤维化是多种心血管疾病后期会出现的一种病理变化,通常表现为心脏成纤维细胞(cardiac fibroblasts,CFs)异常增殖及分化,细胞外基质沉积以及胶原蛋白比例失衡[2]。近年来,越来越多的研究表明心脏纤维化是心功能恶化及心脏衰竭的重要原因之一。因此,防治心脏纤维化对于改善心血管患者的预后具有重要意义。虽然目前已经有很多药物用于临床以减少心脏纤维化的发生发展,但其疗效并不令人满意,故探讨心脏纤维化的发生发展机制,寻找治疗新靶点是指导其防治的关键。
1 心脏纤维化的机制
正常心脏间质呈网状结构,以CFs分泌的I型胶原蛋白为主的细胞外基质蛋白(extracellular matrix,ECM)最为丰富,其特点是具有较强的抗牵拉能力,在维持房室壁强度中发挥重要作用[3]。正常生理状态下,CFs合成与分解胶原蛋白处于动态平衡状态,心脏组织损伤后,CFs增殖并分化为心脏肌成纤维细胞(cardiac myofibroblasts, CMFs),发生“修复性”纤维化以保护心脏组织[4]。当组织愈合后,此种促纤维化程序会被关闭。若病理刺激持续存在,CFs将持续地增殖并分化为CMFs,后者不仅可以分泌大量胶原蛋白等导致细胞外基质过度沉积,还可以分泌各种促纤维化的因子,最终导致心脏僵硬度增加,顺应性降低,并发展为心力衰竭[5]。研究表明,心肌梗死后和长期心力衰竭导致的心脏间质纤维化主要是由CFs增殖以及向CMFs转化的形成[6, 7]。
CMFs较CFs而言,其分泌胶原蛋白的能力更强,是心脏纤维化过程的主要参与细胞。而且,CMFs主要表达α-平滑肌肌动蛋白(alpha-smooth muscle actin, α-SMA)和收缩相关蛋白,具有胶原蛋白收缩能力,胶原蛋白收缩亦可影响CFs增殖和分化。CMFs也可分泌多种促进纤维化的体液因子,如转化生长因子-β1(transforming growth factor-β1,TGF-β1)和结缔组织生长因子(connective tissue growth factor, CTGF)。研究表明CMFs的收缩和ECM分泌可与其他促纤维化因子一起,维持并加重CFs活化和纤维化反应[8, 9]。
在各种心肌损伤过程中,CFs异常地增殖与转化,可导致不可逆的心室重塑和心脏功能障碍[10]。因此,改善心脏纤维化对于改善心脏疾病预后十分重要。目前,抗纤维化治疗大多数治疗效果远不如预期。因此,有必要寻找新的分子及通路来抑制CFs增殖和向CMFs的持续活化[11]。近年来研究表明,CFs细胞膜上的瞬时受体电位(transient receptor potential, TRP)通道及其介导的Ca2+内流可能在心脏纤维化疾病的发生发展中发挥重要的作用[12]。
2 TRP通道的结构和功能简介
TRP由Cosens首次在果蝇的视觉系统中发现。在哺乳动物中,TRP家族由28个成员组成,分为7个亚家族:TRPA(TRPA1),TRPC(TRPC1-TRPC7),TRPM(TRPM1-TRPM8),TRPML(TRPML1-TRPML3),TRPN, TRPP(TRPP1-TRPP3)和TRPV(TRPV1-TRPV6)[13]。
TRP蛋白为四聚体结构,每个亚基由6个跨膜段(S1-S6)组成。来自每个亚基的S5-S6跨膜区段与来自另一个亚基的S1-S4跨膜区段(电压传感器束)形成的结构域可以相互作用。在胞质中,氨基末端和羧基末端可以参与通道门控制和亚基的组装,并通过各种结合位点与其他蛋白质和分子相互作用[14]。
TRP通道主要对Ca2+和其他阳离子具有渗透性,但TRPM4和TRPM5除外,它们只对Na+具有渗透性(表1)。TRP通道受多种刺激的调节,如机械拉伸、氧化应激、磷脂及其代谢物、渗透压变化、细胞内离子(Ca2+和Mg2+)以及神经激素因子等。TRP激活机制复杂,包括膜电压依赖的激活机制、G 蛋白偶联受体(G protein coupled receptor,GPCR) 相关的磷酸化激活机制、磷脂酰肌醇(phosphatidyl-inositol,PIP2) 活化机制以及配体活化机制[15]。
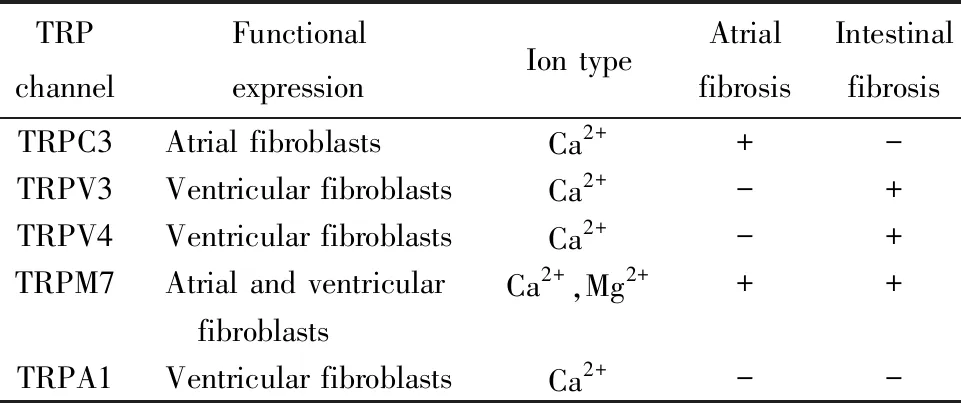
表1 生理与纤维化状态时TRP通道在心脏成纤维细胞膜上的表达情况
3 心脏纤维化中TRP通道发挥的作用
3.1 TRPC通道
TRPC3主要介导Ca2+内流[16]。研究表明TRPC3介导的局部Ca2+内流可以诱导心脏重塑。Numaga-Tomita 等[17]发现TRPC3在压力超负荷时上调,可与烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate,NADPH)氧化酶2(NOX2)结合生成一种稳定的膜结合ROS生成酶,诱导心肌细胞以及CFs内ROS信号的扩增,从而促进CFs的增殖、分化,加速心脏纤维化进程。Harada等[18]研究表明在房颤大鼠的心房成纤维细胞膜上TRPC3的表达上调,这可以导致钙离子依赖性的细胞外信号调节激酶1/2(extracellular signal-regulated kinase 1/2,Erk1/2)的激活, 从而促进成纤维细胞的增殖和分化。然而,当CFs分化为CMFs后,CMFs膜上TRPC3 表达反而下调,这种负反馈调节可能是为了防止 ECM 的过度沉积。
3.2 TRPV通道
TRPV3及TRPV4在病理性心脏纤维化中同样发挥重要作用。在大鼠模型心脏压力超负荷实验中,Liu等[19]发现TRPV3表达上调与心肌间质纤维化增加、收缩功能下降有关。这些变化通过TRPV3激动剂carvacrol进一步增强,并通过非特异性的TRPV阻断剂钌红逆转。体外实验表明,CFs的TRPV3上调,可以激活TGF-β1信号通路,增强细胞周期蛋白E和细胞周期蛋白依赖激酶D的活性以加速G1/S细胞周期的进展,从而调节CFs的增殖。因此TRPV3可能是CFs增殖和分化的积极调节因子。
ECM过量沉积可对CFs施加机械负荷,促使CFs向CMFs分化,进一步增强纤维化[9]。进一步研究表明TRPV4通道可将ECM的僵硬与CMF的激活和分化联系在一起[20]。除此之外,Adapala等[21]发现TGF-β1处理CFs后,TRPV4的表达明显增强,其机制可能是经TGF-β/MAPK通路激活TRPV4基因转录。而机械应激和TGF-β1介导的信号转导都促进CMFs表达α-SMA,提示机械应激和TGF-β1介导的信号转导也许是经过TRPV4协同促进CFs的转分化[21]。
3.3 TRPM 通道
TRPM7可传导Ca2+和Mg2+,并在一定程度上传导几种必需的微量金属离子[22]。房颤患者CFs膜上TRPM6的上调与心房组织间质纤维化程度增加促纤维细胞因子/生长激素(TGF-β1、CTGF、collagen Ⅰ、collagen Ⅲ)表达增强密切相关[23]。其机制可能是TRPM6表达的增加会破坏心房Mg2+稳态,激活TRPM7,共同促进纤维化进程[23]。
在心脏组织中,心室和心房成纤维细胞均表达TRPM7通道[24]。Yu等[25]发现TRPM7的上调对于血管紧张素Ⅱ诱导心室成纤维细胞增殖和分化是必不可少的。用过氧化氢模拟氧化应激培养原代CFs发现,其诱导CMFs活化以及分泌collagen Ⅰ、CTGF等作用是依赖于TRPM7介导的细胞外Ca2+内流;同时,这种氧化应激反应介导纤维化信号的产生,伴随着Erk1/2的激活,共同促进心脏纤维化[26]。
3.4 TRPA1 通道
TRPA1在心肌细胞和非心肌细胞(内皮细胞、CFs、巨噬细胞和血管平滑肌细胞等)中均有表达[27]。正常生理条件下,TRPA1通道虽然介导Ca2+内流,但似乎不参与心脏收缩活动[28]。近年来有研究提示TRPA1与心血管疾病的发生密切相关[29]。最新研究表明,在糖尿病心肌病患者心脏内甲基乙二醛的升高除导致糖基化终末产物增加外,还可上调TRPA1通道,引起CFs内Ca2+浓度的持续增加,并导致CFs的增殖与分化,使用选择性TRPA1拮抗剂HC030031或沉默TRPA1基因可改善心脏纤维化程度,但具体机制有待进一步探索[30]。此外,TRPA1选择性抑制剂可通过调节M2型巨噬细胞分化,抑制心肌肥大和心脏纤维化[31]。TRPA1不参与正常心脏收缩功能,但可通过调节Ca2+浓度直接或促进炎症细胞浸润间接地促进CFs增殖、分化,提示特异性拮抗TRPA1是值得探索的有效方法之一。
4 心脏纤维化治疗展望
心脏纤维化发生发展是由多种生化介质和信号通路组成的复杂交错网络所调控,包括细胞因子/生长激素及其受体、蛋白水解酶、激酶、磷酸酶、转录因子和离子通道等。尽管如此,大量研究表明,心脏纤维化的核心变化在于CFs的增殖和分化为CMFs。因此,抑制CFs的异常增殖和CMFs的持续活化是潜在的有效治疗心脏纤维化靶点。研究发现在各种心脏疾病发生心脏纤维化时,心脏细胞中多种TRP蛋白受TGF-β、血管生成素Ⅱ( angiogeninⅡ,Ang Ⅱ)及CTGF等因子,或者ECM张力的影响而表达上调,Ca2+和(或)Mg2+内流,通过激活各种Ca2+和(或)Mg2+依赖的信号途径,如RhoA、蛋白激酶C、Erk1/2以及TGF-β信号通路等,调节这一过程(图 1)。除此之外,TRP通道也可以通过促进炎症细胞的浸润、激活整合素等来促进纤维化。对于人体来说,上述多数信号通路不仅参与心脏纤维化的形成,也参与维持正常心脏功能。因此,临床上难以将上述信号途径中的重要组成部分作为防止心脏纤维化的靶点。然而,可调控细胞内外Ca2+浓度的TRP通道为控制纤维化进展提供了新的方向。

图1 TRP通道在心脏成纤维细胞分化中的作用机制Figure 1 Mechanism of TRP channels in differentiation of cardiac fibroblastsTRP: transient receptor potential; TGF: transforming growth factor; CDK: cyclin-dependent kinases; Erk 1/2: extracellular signal-regulated kinase; Rho/Rock: Ras-homolog gene family, member A/Rho-associated kinase.

