60Co-γ辐射苜蓿种子的变异植株叶片愈伤组织诱导及其诱变效应分析
李 波,刘 畅,李 红,杨 曌
(1.齐齐哈尔大学生命科学与农林学院,抗性基因工程与寒地生物多样性保护黑龙江省重点实验室,黑龙江 齐齐哈尔 161006;2.黑龙江省农业科学院畜牧兽医分院,黑龙江 齐齐哈尔 161005)
紫花苜蓿(Medicagosativa)是多年生豆科牧草,因其适应力强、产草量高、适口性好等特点,具有“牧草之王”的美誉,在很多国家被广泛种植[1-2]。人为利用物理、化学等因素,诱发植物体产生遗传性变异,在短时间内获得有利用价值的突变体,并对突变体进行选择鉴定,直接或间接培育成生产上有利用价值的突变体,是培育植物新品种的育种手段之一[3]。辐射育种是目前常用的新品种育种手段,常采用60Co-γ射线进行辐射,其后代变异率高、变异性状稳定,能够在较短时间内获得突变体[4]。辐射诱变育种在国外应用得比较早,其后国内学者也相继开展一些植物辐射诱变育种的研究,如马铃薯(Solanumtuberosum)愈伤组织在40 Gy的剂量下能够获得2%高盐的愈伤组织突变体[5];沟叶结缕草(Zoysiamatrella)愈伤组织经10 Gy的60Co-γ辐射处理对愈伤组织的再分化过程有明显的促进作用,能够在1%的NaCl再生培养基中获得生长旺盛的再生植株[6];60Co-γ射线辐射辣椒(Capsicumannuum)的愈伤组织,发现20 Gy的剂量下可获得丰富的突变体[7];对红掌(Anthuriumandraeanum)愈伤组织进行60Co-γ辐射处理后,再生植株突变株的半致死剂量为30 Gy,且再生植株M1代和M2代的性状一致,能够稳定遗传[8]。各种植物愈伤组织对辐射的敏感性不同,一般选择低辐射剂量处理,可提高愈伤组织或其分化植株对盐碱等逆境的抗性。
γ射线辐射在牧草研究中应用较多,国内的牧草诱变育种中,已针对紫花苜蓿[9]、扁蓿豆(Melissitusruthenica)[10]、黑麦草(Loliumperenne)[11]、草地早熟禾(Poapratensis)[12]、狼尾草(Pennisetumalopecuroides)[13]、高羊茅(Festucaelata)[14]的种子萌发、幼苗生长、生理生化特性、差异基因表达等方面的变化进行了研究和分析。苜蓿辐射育种的研究应用也比较广泛,对辐射后苜蓿植株的Na+、K+、Ca2+和Mg2+含量、植株的生长发育、幼苗的显微结构、生理生化变化和抗性筛选等研究较多,而辐射诱变的愈伤组织可增加创新育种的选择性。本研究对60Co-γ射线辐射苜蓿种子的后代植株进行变异植株筛选,对标记的变异植株叶片进行愈伤组织诱导,分析其愈伤组织的诱导率和愈伤组织生理生化特征的变化,筛选出60Co-γ射线辐射的有利突变体,可为利用苜蓿愈伤组织进行抗逆性育种研究提供理论和实践依据。
1 材料与方法
1.1 60Co-γ射线辐射苜蓿种子和幼苗培养
‘龙牧806’苜蓿种子由黑龙江省农业科学院畜牧兽医分院提供,种子的60Co-γ射线辐射处理在中国农业科学院原子能利用研究所进行,辐射剂量分别为600、800 Gy和900 Gy,剂量率为15 Gy·min-1。将当年辐射的苜蓿种子(M1)进行种植和收获,获得第二代辐射苜蓿种子(M2),以未经辐射处理的‘龙牧806’苜蓿种子为对照(CK)。
将辐射‘龙牧806’苜蓿种子M1和M2(600、800 Gy和900 Gy)和CK苜蓿种子用35℃温水浸泡2 h,播种于育苗盆中(营养土∶珍珠岩=2∶1),每盆播30粒种子,每个剂量10盆,置于室温下培养75 d后待用。
1.2 60Co-γ射线辐射龙牧806种子变异植株筛选
对60Co-γ射线辐射龙牧806的 M1和M2苜蓿种子进行幼苗培养,将培养75 d后的苜蓿植株进行株高、叶面积测量,株高(cm)用直尺测量,叶面积采用描形称重法进行测量。以未辐射的植株为对照(CK),筛选的矮化植株用A表示,高植株用G(G1,G2,G3和G4)表示,畸变株用J表示。叶面积测定所用硫酸纸为100 cm2(质量0.2831 g),计算叶面积系数(a),a(纸重面积系数)=(10×10)/0.2831=353.2321,并以每株10个叶片进行叶面积测定,取平均值。
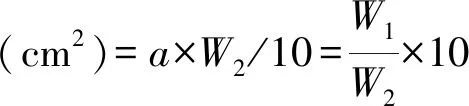
式中,W1为所画纸叶的质量,W2为标准 10 cm2的纸片质量[15]。
1.3 变异植株叶片愈伤组织的诱导
对照苜蓿植株叶片在MS+2,4-D 1.0 mg·L-1+6-BA 0.75 mg·L-1的愈伤组织诱导培养基中进行培养,愈伤组织诱导率为100%,可诱导产生质地疏松的黄绿色愈伤组织。以此愈伤组织诱导培养基对辐射变异植株的叶片进行愈伤组织诱导,培养20 d后统计愈伤组织诱导率和褐化率。
愈伤组织诱导率(褐化率)(%)=诱导(褐化)愈伤组织块数(块)/接种外植体块数(块)×100%
1.4 愈伤组织生理指标的测定
参考邹琦[16]的方法对培养15~18 d的愈伤组织进行9项指标测定。可溶性蛋白(Soluble protein,SP)含量采用考马斯亮蓝法,可溶性糖(Soluble sugar,SS)含量采用蒽酮比色法,脯氨酸(Proline,Pro)含量采用酸性茚三酮法,丙二醛(Malondialdehyde,MDA)含量采用硫代巴比妥酸法,相对电导率(Relative conductivity,RC)测定采用电导法,过氧化物酶(Peroxidase,POD)活性采用愈创木酚法,超氧化物歧化酶(Superoxide dismutase,SOD)活性采用氮蓝四唑光化还原法,过氧化氢酶(Catalase,CAT)活性采用紫外吸收法。各指标测定值均重复3次。
1.5 数据处理与分析
采用Excel 2010对数据进行统计处理,利用SPSS 21.0对测定生理生化指标进行单因素方差分析(ANOVA)。
隶属函数值计算公式为:
R(Xi)=(Xi-Xmin)/(Xmax-Xmin)
反隶属函数值计算公式为:
R(Xi)=1-(Xi-Xmin)/(Xmax-Xmin)
式中,Xi为指标的测定值,Xmax、Xmin为所有试验材料某项指标的最大值和最小值,隶属值进行累加后求出平均隶属值,公式为:
X=∑U(Xi)/n
式中,X为平均隶属函数值,隶属函数值越大表明其向有利方向突变的可能性越大。
2 结果与分析
2.1 60Co-γ射线辐射龙牧806紫花苜蓿种子的变异植株筛选
辐射后植株的性状变异早期主要表现在叶型、叶色和株高等,经过不同剂量辐射后幼苗株高和叶面积变化不同(表1和图 1),A株的株高比CK株矮了29.4 cm,G(G1,G2,G3,G4)株为偏高株,株高分别比 CK 增高了 39.6、29.8、26.6 cm和45.3 cm,J株的株高比CK株矮了17.9 cm。由于A株既矮叶片又小,导致其叶面积无法测量;G2和G3株的叶面积分别比CK增加了12.15%和 28.18%,G1、G4和J株叶面积均比CK株降低了22.10%、24.86%和27.07%;辐射变异植株的株高和叶面积与CK比较均差异显著(p<0.05)。在对3种辐射剂量的‘龙牧806’苜蓿M1和M2代种子的幼苗培养中,除G2株为M1代辐射(600 Gy)种子筛选的变异株外,A、G1、G3、G4和J株均为M2代种子筛选获得的变异株,说明不同辐射剂量对苜蓿植株的性状变异产生不同的影响,且在M2代可获得较多的变异类型。
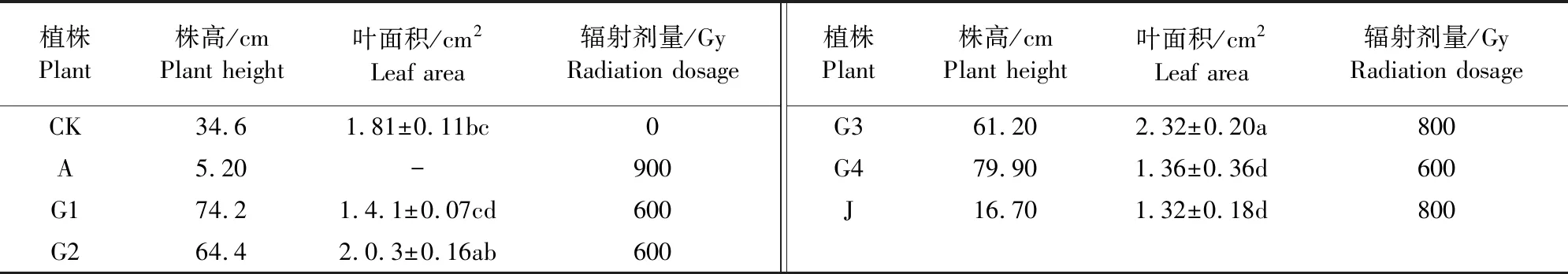
表1 60Co-γ辐射苜蓿变异植株的生长特征
2.2 变异植株叶片愈伤组织的诱导和继代培养
60Co-γ辐射变异植株叶片愈伤组织褐化率和诱导率见表 2。所有供试植株愈伤组织诱导率变化范围为90%~100%,其中J植株诱导率最低,为79.35%。在诱变的后代植株中, A株愈伤组织褐化率为5.41%,略高于CK株愈伤组织,其余辐射植株愈伤组织的褐化率均低于CK株,介于0.00%~2.00%。除J株愈伤组织诱导率外,其余辐射植株叶片诱导的愈伤组织诱导率差异不明显,说明所选择的3种辐射剂量均可使苜蓿叶片被诱导产生愈伤组织,利用辐射诱变与离体培养结合能增加诱变群体的选择性,提高后代的被筛选性。
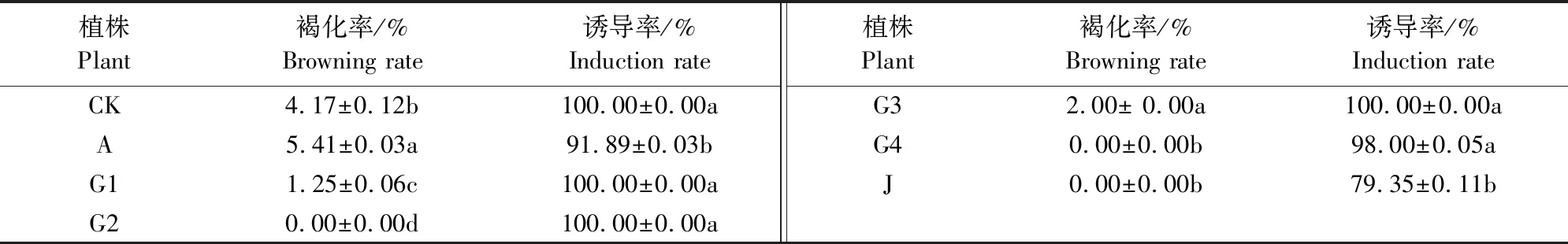
表2 苜蓿变异植株叶片愈伤组织的诱导率和褐化率
CK和各辐射株叶片愈伤组织初代培养与继代培养的生长情况见图1和图2(诱导培养基相同)。愈伤组织初代培养20 d后(图1),不同辐射组的愈伤组织颜色与CK愈伤组织均有差异,CK愈伤组织颜色浅黄绿色,A、G1、G2、G3、G4株愈伤组织分别呈绿色、绿色、浅黄色、浅绿色、黄色,G4株的愈伤组织出现部分褐化现象,J株愈伤组织呈浅黄色,且增值速度极慢。愈伤组织继代2次后(图2),变异植株愈伤组织颜色与诱导初期产生一定差异,CK株愈伤组织呈黄绿色,A、G1、G2、G3、G4株愈伤组织分别呈绿色、浅黄绿色、黄绿色、绿色、绿色,G2株愈伤组织褐化严重,G4株部分愈伤组织褐化,J株愈伤组织呈褐色,且生长速度缓慢。
2.3 变异植株叶片愈伤组织渗透调节物质的变化
变异植株叶片愈伤组织的3种渗透调节物质含量变化见图3,不同辐射剂量变异植株叶片愈伤组织的SP、SS和Pro含量变化趋势不同。变异植株叶片中的 J株愈伤组织SP含量最高,为 6.92 mg·g-1;G2株愈伤组织SP含量最低,为1.98 mg·g-1,A、G1、G2、G3、G4和J愈伤组织SP含量分别比CK组增加了245.18%、72.03%、29.08%、247.08%、187.82%和351.18%,除G2株愈伤组织SP含量外,其他后代植株愈伤组织的SP含量与CK组比较均差异显著(p<0.05)。在各组愈伤组织中,J株愈伤组织SS含量最高为1.48%,G4株愈伤组织SS含量最低为0.12%,G2、G3、J株愈伤组织SS含量分别比对照组增加了9.61%、7.69%和390.47%,除A、G2和G3株愈伤组织外,其余株系愈伤组织SS含量与CK比较均差异显著(p<0.05)。变异植株叶片愈伤组织中,G3株愈伤组织Pro含量最高,为58.72 μg·g-1;G2株愈伤组织Pro含量最低,为16.72 μg·g-1;A、G1、G2、G3、G4和J株愈伤组织Pro含量均低于CK组,且愈伤组织Pro含量与CK组比较均差异显著(p<0.05)。
2.4 变异植株叶片愈伤组织膜透性的变化
变异植株叶片愈伤组织的2种膜透性相关指标变化见图4,不同处理变异植株叶片的愈伤组织MDA含量和RC变化趋势不同。在各处理愈伤组织中,G4株愈伤组织MDA含量最高,为0.57 μmol·L-1;G3株愈伤组织MDA含量最低,为0.44 μmol·L-1;G3和J株愈伤组织MDA含量分别比CK组降低了14.37%和9.21%;G3、G4和J株愈伤组织MDA 含量与CK组比较均差异显著(p<0.05)。变异植株叶片的愈伤组织中,J株愈伤组织RC最高,为109.62%;G3株愈伤组织RC最低,为44.44%;A、G1、G2、G3和G4组愈伤组织RC分别比CK组降低了7.45%,7.07%、24.65%、46.25%和2.81%;除A、G1和G4外,其余变异植株叶片愈伤组织的RC与CK组比较均差异显著(p<0.05)。从辐射对苜蓿愈伤组织的MDA含量和RC变化可知,G3愈伤组织可耐受一定的辐射剂量。
2.5 变异植株叶片愈伤组织抗氧化酶活性的变化
变异植株叶片愈伤组织的3种抗氧化酶活性变化见图5,不同辐射剂量变异植株叶片的愈伤组织POD、SOD和CAT活性变化趋势不同。在各处理愈伤组织中,G2株愈伤组织POD活性最高,为98.40 μmol·min-1·g-1;J株愈伤组织POD活性最低,为7.15 μmol·min-1·g-1;A、G1、G2和G3株愈伤组织的POD活性分别比CK组增加了44.65%、42.45%、57.92%和26.39%;除G3株愈伤组织的POD活性外,其他株系愈伤组织的POD 活性与CK比较均差异显著(p<0.05)。变异植株叶片中的 G3株愈伤组织SOD活性最高,为123.45 μmol·min-1·g-1;G4株愈伤组织SOD活性最低,为103.05 μmol·min-1·g-1;A、G1、G2、G3、G4和J株愈伤组织SOD活性均低于CK组,变异植株叶片的愈伤组织的SOD活性与CK组比较均差异显著(p<0.05)。A株愈伤组织CAT活性最高,为911.67 μmol·min-1·g-1; G2株愈伤组织CAT活性最低,为526.67 μmol·min-1·g-1;A株愈伤组织CAT活性比CK组增加了4.19%,G2和J株愈伤组织的 CAT 活性与CK组比较差异显著(p<0.05)。从3种抗氧化酶活性的变化可知,不同辐射剂量对苜蓿愈伤组织的抗氧化酶系统有不同的效应。
2.6 变异植株叶片愈伤组织各测定指标的主成分分析
变异植株诱导的愈伤组织生理生化相关指标的主成分分析特征值和贡献率见表3,各指标主成分分析矩阵见表4,在所测定的8项生理生化指标的特征值和贡献率中,前4个主成分累积贡献率为94.683%,特征值总和为7.574。对变异植株诱导愈伤组织的8项指标进行计算,各生理生化指标综合性状贡献大小的特征向量见表5。
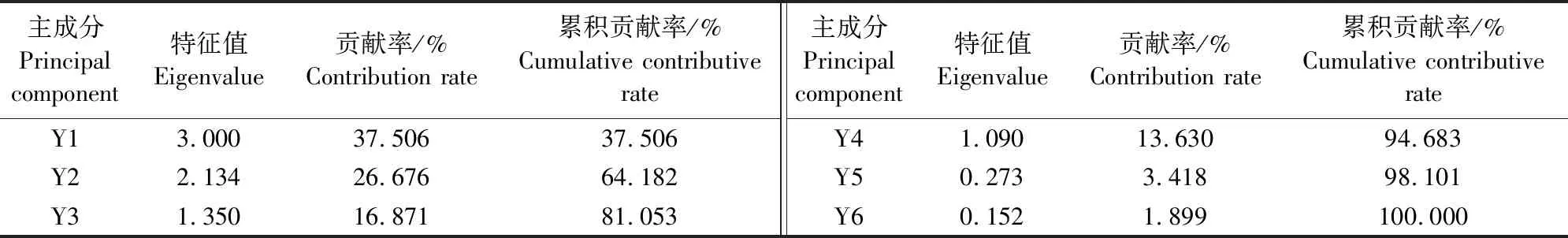
表3 苜蓿愈伤组织生理生化相关指标主成分分析的特征值和方差贡献率
根据主成分分析的特征值和相关矩阵值算出特征向量值(表5),主成分Y1中SS的荷载值最大,其次是RC和SP,主成分Y2中Pro荷载值最大,其次是CAT和SOD,主成分Y3中CAT的荷载值最大,其次是MDA,主成分Y4中RC的荷载值最大,其次是SOD。依据特征向量大于0.300的标准,第一主成分主要是反映了SS这个生理指标的变化,第二主成分主要反映了Pro这个生理指标的变化,第三主成分主要反映了CAT和MAD这2个生理生化指标的变化,第四主成分主要反映了RC、MDA和SOD这3个生理生化指标的变化。综合分析60Co-γ辐射影响苜蓿愈伤组织生理生化特性的主要指标为SS、Pro、CAT、MDA,RC和SOD。
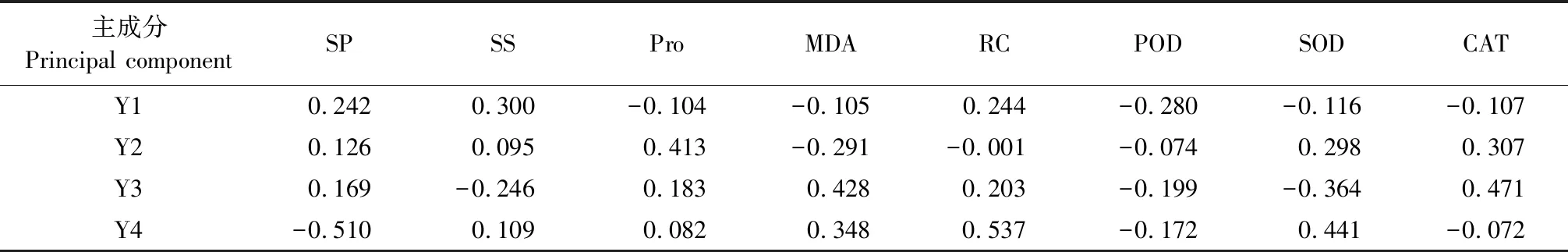
表5 苜蓿愈伤组织各指标相关矩阵的特征向量
2.7 变异植株叶片愈伤组织各指标的综合评价
60Co-γ辐射苜蓿种子后,变异植株叶片所诱导愈伤组织的生理生化特性表现不一致,单个指标不能全面地反映60Co-γ辐射对幼苗叶片愈伤组织的影响,根据主成分分析可知60Co-γ射线辐射主要影响苜蓿愈伤组织的SS、Pro、CAT、MAD、RC和SOD。采用隶属函数法进行综合分析,6项指标的隶属函数值见表6。愈伤组织平均隶属函数值排序为G3>CK>J>A>G1>G2>G4,G4株愈伤组织的隶属函数值最小,G3株愈伤组织的隶属函数值最大,且高于CK,说明G3株愈伤组织为60Co-γ辐射的有利突变体。
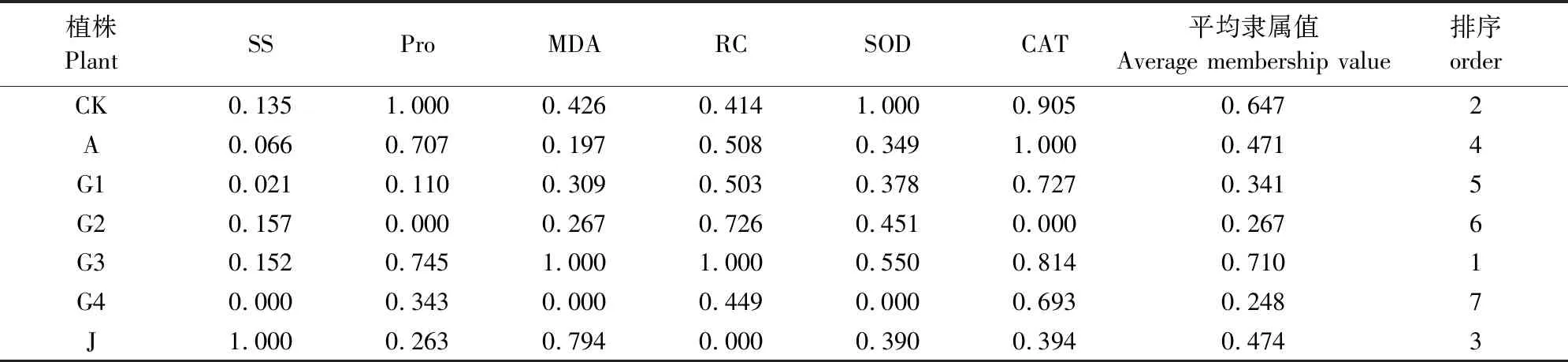
表6 苜蓿愈伤组织6项生理生化指标隶属值
3 讨 论
3.1 60Co-γ辐射种子处理对苜蓿植株形态变异的影响
利用辐射诱变育种选择突变株,常以植株形态学上的变化差异作为依据。60Co-γ辐射可以改变植株的叶片形态和生长性状,但不同辐射剂量对植株叶片形态和生长的影响也不同,一般低剂量辐射对植株的株高、出苗率、鲜质量、干质量有促进作用,但低剂量的辐射诱变率比较低,因此合适辐射剂量有助于突变的发生[17]。不同品种苜蓿对60Co-γ射线辐射敏感度不同,刘淑霞等[18]研究60Co-γ辐射对4个紫花苜蓿品种(WL319、斯贝德、巨能耐盐、龙牧806)生长及生理特性的影响发现,在相同辐射剂量下,‘巨能耐盐’品种对低剂量辐射更敏感,‘龙牧806’苜蓿在800 Gy剂量下株高与对照植株间无明显差异;张伟丽等[19]研究表明60Co-γ(325、487、974Gy)辐射能够抑制M1代柱花草(Stylosanthesguianensias)的生长,熊志波等[20]研究表明60Co-γ辐射使M2代高羊茅的株高降低。但本研究中利用60Co-γ辐射‘龙牧806’M1代(800 Gy和900 Gy)苜蓿种子未能筛选到变异植株,而在M1代(600 Gy)和M2代(600、800 Gy和900 Gy)均有变异植株,且表现出在株高、叶形等方面的不同变异性状,M2与M1代比较其所标记的变异植株更多,推测辐射效应在M2代更稳定。
3.2 60Co-γ辐射种子处理对苜蓿愈伤组织诱导的影响
辐射诱变处理在牧草中的应用越来越广泛,植物组织培养与辐射诱变相结合可在较短的时间内获得大量突变体,加速创造牧草新的种质资源。不同植物材料的不同部位对辐射敏感度不同,处于生长最旺盛阶段的分生组织最为敏感[21],而利用愈伤组织直接进行辐射处理会抑制愈伤组织的生长和再分化,如孟祥茹[22]研究发现随着辐射剂量的增加,延长人参愈伤组织恢复培养的时间,导致水分严重丢失,减缓增值速率;邢莉莉[23]在研究60Co-γ对切花菊试管苗的诱变效应时发现,γ射线对试管苗茎段和叶片愈伤组织的诱导和分化有明显的抑制作用,且随着辐射剂量的增加抑制作用更强。
干燥种子是牧草辐射诱变育种的理想材料,具有代谢水平低、操作简单、能耐较高辐射剂量等特点[24],在本研究中利用60Co-γ射线直接处理苜蓿干种子,变异植株叶片诱导的愈伤组织与对照之间的愈伤组织颜色、生长状态有一定差异,其诱导率和褐化率与对照间差异不大。李振芳[25]对除虫菊种子辐射效应及其组织培养的研究发现,叶柄愈伤组织的诱导好于叶片,叶片直接诱导芽的效果不理想,出芽时间长、出芽率极低、褐化较严重,与本研究结果有一定的印证作用,但也有不同之处,可能与材料的不同有关。
3.3 60Co-γ辐射种子处理对苜蓿愈伤组织生理生化特性的影响
植物体内渗透调节物质含量的增加可以降低辐射引起的伤害[26]。本研究表明,辐射诱变种子发育成突变植株的叶片愈伤组织中,3种渗透调节物质含量发生了不同的变化,辐射可促进苜蓿愈伤组织SP的积累,但Pro含量均明显低于CK,SS含量变化既有高于CK,又有低于CK,因此辐射影响了苜蓿愈伤组织对3种渗透调节物质的代谢及累积。60Co-γ辐射导致物质的离子化,对细胞的损伤引起氧化胁迫,伴随活性氧类物质(ROS)过量产生,造成细胞的氧化损伤,一些抗氧化酶类可以清除活性氧[27],其中MDA是ROS启动膜脂过氧化的产物之一,可衡量植物受到逆境伤害的程度大小;RC是细胞结构稳定性的指标,RC值越大植物细胞膜受损越严重[28]。本研究中G3和J植株愈伤组织 MDA含量较CK降低,A、G1、G2、G3和G4植株愈伤组织RC较CK降低,表明辐射诱导的愈伤组织在面对损伤引起胁迫时启动了自身的防御机制,抵抗对植物细胞膜造成的损伤。POD、SOD和CAT的生成被激活,通过有效抑制植物体内活性氧的积累来缓解辐射造成的损伤[29]。本研究中植株A、G1、G2和G3叶片愈伤组织的POD活性较CK显著增加,而愈伤组织SOD和CAT活性与CK比较则无显著差异。
本研究通过60Co-γ射线诱变获得了在育种实践中具有特殊应用价值的材料,如高株型和矮株型苜蓿突变株愈伤组织等,被诱导愈伤组织内渗透调节物质含量及相关酶活性增加,可作为筛选具有抗逆性的突变体材料。关于辐射苜蓿愈伤组织高频率分化体系建立以及突变体耐逆性目前尚在继续研究中。
4 结 论
对60Co-γ辐射‘龙牧806’紫花苜蓿的M1和M2代种子进行变异植株筛选,筛选出矮化、偏高和畸变不同变异类型植株,将对照和变异植株的叶片进行愈伤组织诱导,除 J株叶片愈伤组织诱导率为79.35%外,CK和其他5类变异植株的叶片愈伤组织诱导率均达90%以上。辐射对苜蓿愈伤组织生理生化代谢产生不同的影响,主成分分析显示愈伤组织逆境生理生化指标受辐射影响的主要有SS、Pro、CAT、MAD、RC和SOD。将该6项生理生化指标隶属函数进行分析,其隶属值排序依次为G3>CK>J>A>G1>G2>G4,G3愈伤组织可用于紫花苜蓿抗逆性突变体的筛选。

