香蕉种苗耗水规律及适宜节水灌溉制度研究
周陈平,姚娇娇,杨 护,邝瑞彬,杨 敏,罗小燕,黄炳雄,魏岳荣
(广东省农业科学院 果树研究所/农业部南亚热带果树生物学与 遗传资源利用重点实验室/广东省热带亚热带果树研究重点实验室,广州 510640)
0 引 言
【研究意义】香蕉是世界鲜果贸易量最大的水果。据FAO统计,2018年世界香蕉种植面积约为565.4万hm2,产量1.14亿t。2018年,我国香蕉种植面积352.61千hm2,总产量1 122.17万t,进口量154.78万t,出口量2.02万t。香蕉产业已成为我国热区农业支柱型产业和农民增收的主要来源之一。随着产业技术的发展,香蕉种植的种苗已从原来的吸芽苗过渡到组培苗,通常采用每2年更新1次种苗的种植模式,因此每年至少需要3.5亿株以上种苗。在目前香蕉枯萎病未得到有效控制的前提下,如何低成本、高效率、高质量地标准化培育香蕉种苗对我国香蕉产业的健康发展至关重要。【研究进展】自20世纪90年代研究者首次提出利用吸芽茎尖进行扩繁的组织培养技术以来,超过90%香蕉种苗来源于试管苗,这极大地缩短了优质种苗的繁育和推广时间,促进了香蕉的大规模生产[1-4]。在此基础上研究者对传统的快繁技术进行优化改良,并开展了一系列香蕉种苗培育配套技术体系的研究,提高了优质种苗的出圃率,保证了香蕉种苗产业的持久健康生命力。在无土育苗研究方面,丰锋等[4]采用正交试验设计和单因素随机区组方法筛选‘巴西蕉’的无土育苗基质,认为珍珠岩为较优的无土移栽基质;还有研究者认为椰糠的理化性质更适合香蕉幼苗生长,有利于健康强壮无菌种苗的培育,可作为首选的无土栽培基质而广泛应用[5]。在大棚育苗方面,郭堂勋等[6]提出了一套大棚育苗管理方法和病虫害防治技术。黄中雄等[7]研究了针对香蕉大棚育苗的农业气象适用技术,得到了香蕉苗对假植棚内小气候的要求与相关调控技术,促进香蕉假植苗的高质量供应。
【切入点】在水肥管理方面,香蕉种苗的水肥需求规律的研究是生产上进行精准化水肥调控和标准化生产的基础,目前关于香蕉育苗期水分需求规律及基于水分需求规律之上的节水灌溉制度的研究较少。但谢少泽等[8]、刘海军等[9]、洗昌清等[10]开展了关于香蕉种苗定植后整个生育期的耗水量及节水灌溉制度的研究,为本文研究的开展提供了重要技术参考。【拟解决的关键问题】本研究根据香蕉种苗的基本生长规律,将育苗期划分为生长前期、中期和后期,开展各个时期耗水规律的研究,并把耗水规律与节水灌溉制度相结合,为育苗期的节水灌溉制度提供理论依据。
1 材料与方法
1.1 试验概况
试验于2019年10—12月在广东省农业科学院果树研究所香蕉育苗大棚内( 23°9′6.35′′ N ,113°22′24.56′ E)进行。育苗用温室大棚表面覆盖75%遮阳率的遮阳网,光照强度控制在10 000~20 000 LUX,温度控制在26~32 ℃,空气相对湿度控制在60%~70%。
1.2 试验材料
以‘巴西蕉’为试验品种,选取在生根培养基中培养4周、根系生长良好、长势均匀一致的一级组培苗为材料,该材料由广东省农业科学院果树研究所提供。在将一级组培苗装入营养杯后培育为二级杯苗的过程中,根据种苗生长的基本规律,将其划分为生长前期、中期和后期。
育苗基质为全椰糠,装杯前先用流水对基质进行充分浸泡和淋洗,直至基质的EC值小于0.5 mS/cm,去除椰糠可能含有的盐分和有害物质,避免原始基质对种苗造成的盐胁迫。
1.3 试验设计
各处理基质的相对含水率(土壤含水率占田间持水率的比例)从高到低设定为:90%±5%、80%±5%、70%±5%、60%±5%、50%±5%、40%±5%(T90、T80、T70、T60、T50、T40处理),以100%相对含水率处理为对照(CK)。采用生产实践中的普通施肥水平,在缓苗期后施加缓释复合肥(氮、磷、钾质量比为16∶6∶13),每株施加1 g。
考虑到在数据采集过程中的破坏性取样以及植株整齐度等因素,为保证有足够大的植物样本,每个处理设置200株试验苗,重复5次。用称质量补水法进行补水,实现不同处理相对含水率的标定,标定周期为3 d(即每个处理设定的相对含水率为标定上限,每3天加水补充至设定的相对含水率);每天测定不同处理的日耗水量。
1.4 试验方法
采用烘干法对椰糠基质的田间持水率进行测定。采用称质量补水法进行标定:不同处理的标定总质量为m(营养杯+基质+苗),控水开始后于每1天同一时刻对不同处理进行称质量,记为m1,不同处理试验苗的日鲜质量增量为m2,故苗木的日耗水量为mW(mW=m-m1+m2),每次标定需加水补充至标定总质量与鲜质量增量的总和。月耗水量为当月每次称质量所获得的日耗水量的总和。
幼苗生长和生理指标测定:包括植株的株高、茎粗、叶片数、叶面积及SPAD值。用钢卷尺测量株高,精度0.1 cm;用游标卡尺测量茎粗,精度0.1 mm;使用叶绿素仪测定SPAD值,每次测定同一植株的不同叶位的SPAD值;叶片数的测定:记录试验苗完全展开的功能叶的数量;叶面积的测定:选取最新的一片完全展开的功能叶,用剪纸称质量法进行测量。以上指标的测定周期为10 d(于2019年10月1日开始)。
幼苗根系生长指标的测定:使用根系扫描仪采集根系的图像,然后用WinRHIZO根系分析软件对根系的拓扑结构进行分析,最后导出根系的总长度、体积、表面积、直径、根尖数等数据信息。
干物质量的测定:采用标准株法,从每个处理水平选择整齐度高的5株进行破坏性取样测定,分别将每株幼苗的地上部和地下部分离,然后置于信封中于80 ℃烘箱中烘干,至恒定质量后用电子天平称量,精度0.001 g。以上生长指标的测定均设置6个测量时间点,周期为10 d(于2019年10月1日开始)。
1.5 数据处理
利用Excel软件进行数据整理和图表制作;用IBM SPSS Statistics 20进行数据分析;用R语言进行主成分分析(PCA)及相关图表制作。
2 结果与分析
2.1 不同水分处理对单株种苗耗水量的影响
图1(a)为不同处理单株日耗水量的差异比较。各处理在整个苗期内单株日耗水量均呈上升趋势,在生长后期趋于平稳。在0~10 d,日耗水量以CK 最高,为24.7 g/(株·d ),显著高于T40、T50、T60 和T70处理(P<0.05);在10~50 d,CK 的平均日耗水量均值为48.2 g/(株·d ),显著高于其他处理;在50~60 d,CK 和T90 处理的日耗水量较高,分别为52.0 和38.3 g/(株·d ),显著高于其他处理。以上分析表明,相对含水率越高,单株日耗水量越大。
由图1(b)可知,不同相对含水率处理下的‘巴西蕉’种苗在整个苗期的总耗水量存在差异,其中,CK 和T90 处理显著高于其他处理(P<0.05),以CK耗水量最大,为2 554.0 g/株,T90 处理耗水量次之,为2 148.0 g/株,最小的是T40 处理,为408.0 g/株,T50、T60、T70 处理和T80 处理的总耗水量介于756.0~1 545.3 g,比CK 低39.49%~70.40%。
2.2 不同水分处理对种苗地上部生长的影响
表1 为不同处理种苗地上部生长指标。由表1 可知,随着幼苗装杯移植后时间的延后,不同控水条件下的地上部生长指标差异越来越大。
在生长前期(0~20 d),T70、T80、T90 处理和CK 的株高显著高于T40 处理,以T80 处理最高,较CK 提高了1.78%;CK 的茎粗最大,T40 处理和T50处理显著低于CK;不同处理的鲜质量以T90 处理最高,显著高于T40 处理,比CK 高17.03%。

图1 不同处理下‘巴西蕉’单株日耗水量和总耗水量 Fig.1 Daily water consumption and total water consumption of Mimosa nana Lour.under different water treatments
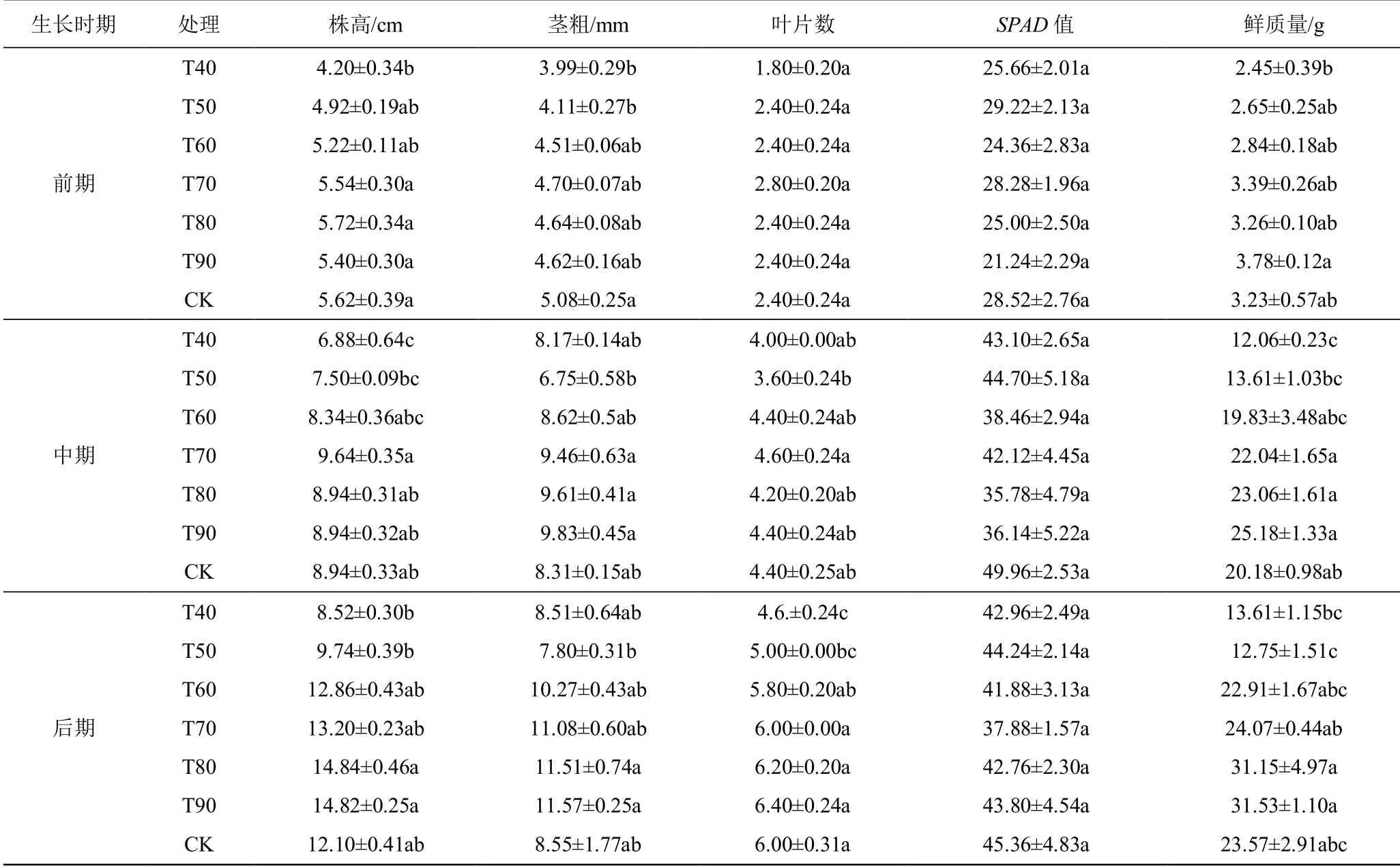
表1 不同水分处理下‘巴西蕉’地上部生长指标 Table 1 The above-ground growth of Mimosa nana Lour. under different water treatments
在生长中期(20~40 d),T70、T80、T90 处理和CK 的株高显著高于T40 处理,以T70 处理最高,比CK 高7.83%;T70、T80 处理和T90 处理的茎粗值显著高于T50处理,以T90处理最粗,比CK粗18.29%;T70 处理的叶片数最多,显著多于T50 处理,比CK多4.55%;T70、T80、T90 处理和CK 的鲜质量显著高于T40 处理,以T90 处理最高,比CK 高24.78%。
在生长后期(40~60 d),T80 处理和T90 处理的株高显著高于T40 处理和T50 处理,以T80 处理最高,比CK 高22.65%;T80 处理和T90 处理的茎粗与T50 处理有显著差异,以T90 处理最粗,比CK 粗35.32%;T70、T80、T90 处理和CK 的叶片数显著多于T40 处理和T50 处理,以T90 处理最多,比CK多6.67%;T80 处理和T90 处理的鲜质量显著高于T40处理和T50 处理,以T90 处理的鲜质量最高,比CK高33.77%。
通过地上部生长数据的差异分析表明:在整个育苗期,不同处理的地上部生长存在差异,相对含水率较高的处理要优于相对含水率较低的处理,当田间含水率在低于70%时,对种苗的地上部生长不利。具体表现为,在生长的前期和中期,相对含水率高于70%时,地上部长势较优,而在后期,控制相对含水率高于80%时,地上部长势较优。
2.3 不同水分处理对种苗根系生长的影响
表2 为不同水分处理种苗根系生长参数。从表2可以看出,随着幼苗移植后时间的延后,相对含水率高的处理的根系生长较相对含水率低的处理活跃,T80处理和T90 处理的根系生长活力最强。在生长前期,T80 处理的根系总长度和表面积较CK 分别提高了19.98%和19.79%;在生长中期,T80 处理的根系表面积、直径和体积较CK 分别提高了12.38%、20.90%和32.06%;在生长后期,T90 处理的根系总长度、表面积、体积和条数较CK 分别提高了43.69%、42.78%、39.10%和71.76%。相对含水率过高或过低在一定程度上会影响种苗根系的生长发育,本研究中根系长势最优的为T80 处理和T90 处理,且优于CK。因此,在整个育苗期,控制相对含水率在80%~90%之间,将更有利于根系的生长。
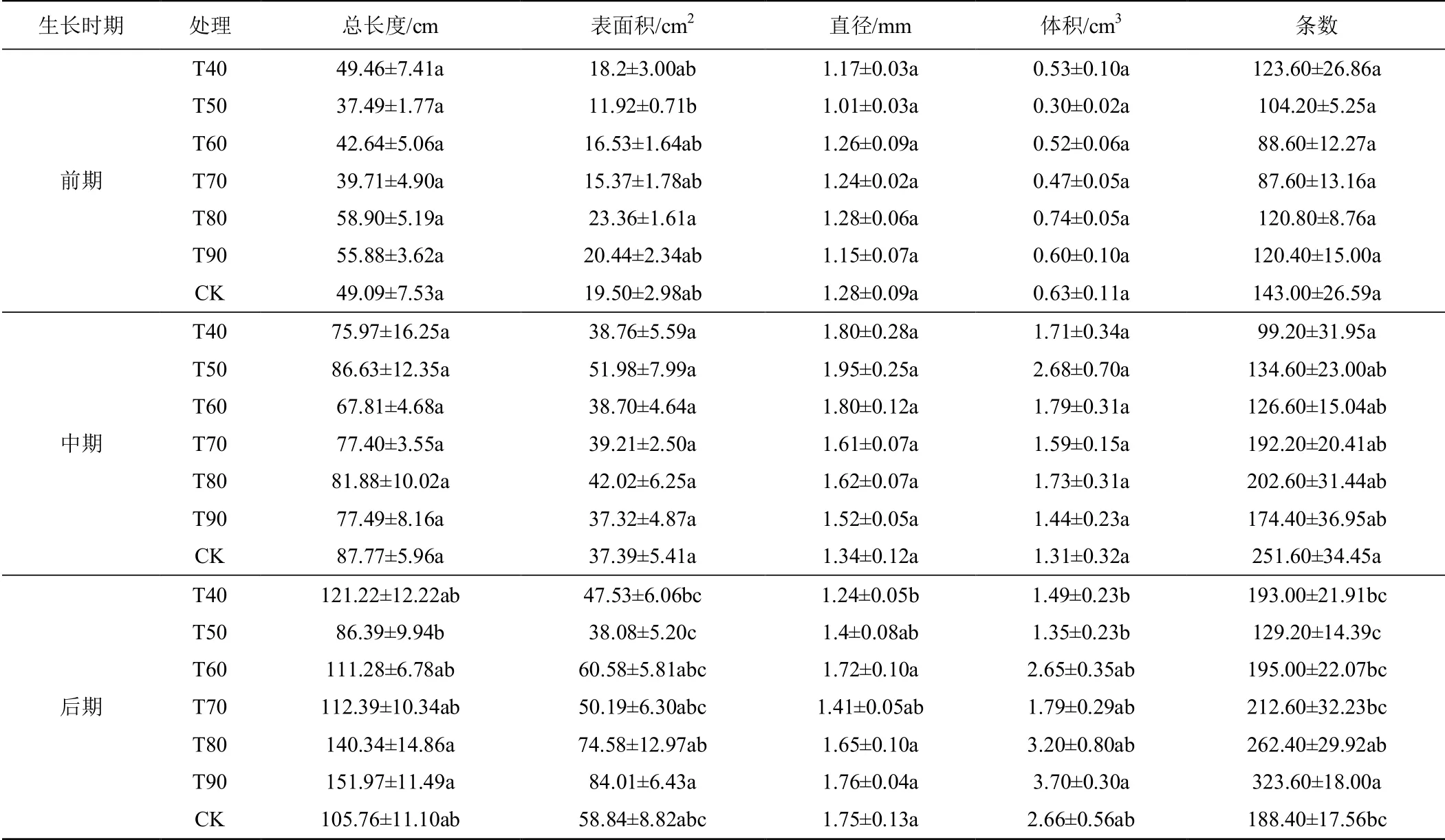
表2 不同水分处理‘巴西蕉’根系参数 Table 2 The root growth parameter of Mimosa nana Lour. under different water treatments
2.4 不同控水条件下‘巴西蕉’试验苗生长状况评价
采用主成分分析法(PCA)对不同处理的地上部生长状况(株高、茎粗、叶片数、叶面积和鲜质量)进行综合评价(表3)。在生长前期,T70处理得分最高,CK排第4,其叶片数和鲜质量分别较CK提高了16.67%和4.95%;在生长中期和后期,T80处理的得分最高,CK分别排第4和第3。相对含水率过低或过高都对种苗的生长有一定的抑制作用,本研究表明,将生长前期的相对含水率控制在70%,中后期为80%,不但有利于田间水分的高效利用,而且对种苗的地上部生理生长有促进作用。

表3 不同处理在不同时期综合得分及排名 Table 3 Scores and ranks of different treatments
2.5 地上部与地下部异速生长模型
本研究根据地上-地下生物量的数据进行Y=a·Xb异速生长模型的建立,其中,a和b代表模型参数;Y代表地下部生物量;X代表地上部生物量。
对本试验中的不同处理的地上部与地下部生物量数据进行非线性回归建模,标定了模型中的参数,最终得到了‘巴西蕉’的地上部与地下部异速生长模型:Y=0.138 6·(x/r)0.7,Y为‘巴西蕉’试验苗单株平均地下部干质量,x为平均单株地上部干质量,r为盆栽基质的相对含水率。通过F检验得出F>F0.01,P<0.01,故地上部和地下部生物量存在显著的异速生长关系。
为了对模型进行评估,对异速生长模型的预测值和实测值(0~60 d)进行了比较,结果见图2,图中红色实线为y=x对角线函数,R2为0.807 6,表明模型拟合的结果较好,此模型具有良好的预测能力。

图2 模型评价 Fig.2 The evaluation of model
3 讨 论
3.1 不同控水条件下香蕉苗期的耗水规律
水分参与植物重要的生理生化代谢过程,是植物体内原生质的基本组分和细胞内各种反应的介质,细胞保持固有的形态也需要水分[11]。而土壤水分直接影响植物体根系对水分的吸收,进而影响植物的地上部生长。在一定程度上适当降低土壤的含水率,会刺激根系生长,促进优质苗的培育[12]。植物在不同的生长发育阶段对水分的消耗量存在差异,探索并掌握植物体在不同时期对水分的需求规律是制定科学合理的水分管理方案的基础。本研究表明,在‘巴西蕉’育苗期间,不同控水条件下的单株日耗水量均呈上升趋势,在生长后期趋于平稳。在整个育苗期,日耗水量以CK 最高,T90 处理次之,总耗水量随着相对含水率的增加而增加,这与之前研究得出的随土壤中水分的增加,植株耗水量越大[13-14]的结论相似。
3.2 基于香蕉苗期耗水规律的节水灌溉制度
节水灌溉主要是根据植物的需水规律和供水条件,在高效利用水资源的同时,满足植物优质高产的栽培目标,促进农业的可持续发展[15-16]。不同品种根据其自身的耗水规律制定不同的灌溉制度,黄连木和花榈木在相对含水率为80%的条件下可以达到节水灌溉的目的,80%为最适宜生长的相对含水率[17-18],栓皮栎则为60%[19]。本研究中T90 处理和CK 的试验苗出现了水分供过于求的现象,T40、T50 处理和T60处理则表现为不同程度的干旱胁迫,结合试验苗生长生理指标的评价,得到如下控水方案:在生长前期,70%相对含水率最适宜‘巴西蕉’幼苗生长,中期和后期则为80%相对含水率最适宜。
3.3 地上部与地下部异速生长关系探讨
根系是植物重要的器官,地下部的生长发育和地上部密切相关,植物地上部与地下部的相互作用关系越来越多地受到研究者的重视[20-23]。本研究利用异速生长模型通过地上部的形态学参数预测地下部的生长。根据曾凡江等[24]、汪金松等[25]和牛存洋等[26]分别对疏叶骆驼刺、臭冷杉和科尔沁沙地小叶锦鸡的地上-地下的经验模型,建立了‘巴西蕉’种苗的地上部-地下部幂函数异速生长模型。该模型能够在指定的时间范围内描述地上部和地下部异速生长关系。‘巴西蕉’的地上部生物量的同比增量高于地下部,随着试验苗的生长发育,根冠比会有下降趋势,说明香蕉适宜生长在水资源供应较充足的基质环境中。
4 结 论
1)在不同控水条件下,香蕉育苗期种苗的日耗水量在整个苗期均呈上升趋势,日耗水量在育苗期的不同阶段均以CK 最高;总耗水量表现为:CK>T90处理>T80 处理>T70 处理=T60 处理>T50 处理>T40处理。
2)建立种苗的地上部-地下部幂函数异速生长模型,精度较高,可通过地上部的生物量变化较为准确地预测地下部分生物量。
4)在生长前期,建议控制基质的相对含水率在70%,生长中期和后期控制在80%。

