生物基聚酰胺56纤维的热降解动力学及其热解产物
杨婷婷, 高远博, 郑 毅, 王学利, 何 勇,
(1. 东华大学 材料科学与工程学院, 上海 201620; 2. 东华大学 纤维材料改性国家重点实验室, 上海 201620;3. 上海凯赛生物技术股份有限公司, 上海 201203; 4. 东华大学 纺织科技创新中心, 上海 201620)
近年来,从可再生资源出发制备生物基1,5-戊二胺的产业化技术已日渐成熟,并由生物基1,5-戊二胺和石油基1,6-己二酸聚合制备了新型生物基奇偶聚酰胺——聚酰胺56(PA56)。PA56具有和聚酰胺66(PA66)相当的热性能、力学性能及加工性能,可通过注塑、吹膜、熔融纺丝等方式加工成形,有望应用于工程塑料、薄膜及纤维领域,具有非常广阔的应用前景[1-3]。另外,生物基PA56纤维还具有吸湿性能优异、手感良好及可染性能极佳等特性,有望在纺织行业替代传统的石油基聚酰胺6(PA6)及PA66。
热稳定性是材料的重要基本性能,研究材料的热稳定性对其制备、加工及应用至关重要[4]。目前,对聚合物热降解的研究主要聚集在热降解机制、热降解过程中热解气相产物的分析。常用的测试方法主要有热重(TGA)、热重红外联用(TG-IR)及气相色谱质谱联用(Py-GC/MS)[5-7]技术。利用TGA技术可研究聚合物降解动力学,Py-GC/MS及TG-IR技术可直接得到聚合物降解过程中的热解气相物质相关信息[8-10]。
生物基PA56纤维作为新型材料,其热稳定性还有待深入研究。鉴于此,本文利用TGA分别测定了不同升温速率下生物基PA56纤维的热降解过程,结合Kissinger法、Flynn-Wall-Ozawa法及Coasts-Redfern法3种不同的计算方式,计算了生物基PA56纤维热降解动力学参数,推测生物基PA56纤维降解机制。同时通过Py-GC/MS及TG-IR联用技术系统解析了生物基PA56纤维热解过程中的气相裂解产物。
1 实验部分
1.1 实验材料
生物基PA56纤维由上海凯赛生物技术股份有限公司提供,相对黏度为2.83,熔点为255 ℃。
1.2 测试与表征
1.2.1 热稳定性测试
采用TG 209 F1Iris型热重分析仪(德国耐驰公司)在氮气气氛下对样品进行热稳定性分析。取3~5 mg样品,分别以10、15、20、25 ℃/min的升温速率将样品从30 升至600 ℃。
1.2.2 气相热解产物分析
采用209 F1型热重-红外联用分析仪(德国耐驰公司)在氮气氛围下分析材料在热解过程中的气相产物。升温速率为10 ℃/min,波数范围为4 000~600 cm-1。采用GC/MS-QP-2010 Ultra型气相色谱质谱联用仪(日本岛津公司)对热解过程(455、500、550 ℃)中产生的气相热解产物进行分离及确定。
1.3 热氧降解动力学理论
当用TGA数据计算热降解反应动力学参数时,聚合物的质量损失率α为
(1)
式中:m0为试样的起始质量,g;mt为试样在t时刻对应的质量,g;mf为试样最终残余质量,g。
热分析动力学研究的基本关系式为
(2)
式中:dα/dt为失重分解速率;k(T)与g(α)分别为温度T和质量损失率α的函数。
k(T)对温度的依赖关系通常遵循Arrhenius方程[2]:
(3)
式中:A和E(kJ/mol)为动力学参数,分别代表指前因子及反应活化能;T为温度,℃;R为通用气体常数,为8.31 J/(mol·K)。
g(α)取决于特定的降解机制,一般被表达为
g(α)=(1-α)n
(4)
式中,n为反应级数。
结合式(2)~(4)可得到如下动力学方程:
(5)
非等温环境下,温度以固定的加热速率随着时间上升,升温速率β=dT/dt,则式(5)可表示为
(6)
式(6)的积分形式可写为
(7)

经上述分析可知,由质量损失率α及升温速率β可以确定表观活化能。表观活化能强烈依赖计算方式,常见的计算方法有Kissinger法、Friedman法、Flynn-Wall-Ozawa法、Kissinger-Akahira-Sunose法及Coasts-Redfern法[2-4]。本文使用Kissinger法及Flynn-Wall-Ozawa法计算生物基PA56的表观活化能,Coasts-Redfern法确定可能的降解机制。
2 结果与讨论
2.1 生物基PA56纤维的热降解过程分析
图1示出氮气氛围下采用不同升温速率(10、15、20、25 ℃/min) 得到生物基PA56纤维的TG及DTG曲线。可知:不同升温速率得到的TG曲线形状基本一致,表明加热速率对生物基PA56纤维质量损失的影响较小;图中所有DTG曲线均显示单一峰,表明在氮气氛围下PA56的热降解为一级反应。当升温速率为10 ℃/min时,PA56的起始降解温度为415 ℃,热质量损失主要发生在400~550 ℃。随着升温速率增加,PA56起始降解温度、最大热质量损失速率及最大热质量损失速率对应的温度均增加。

图1 不同升温速率下生物基PA56纤维在氮气气氛中的热重曲线
2.2 生物基PA56纤维的热降解动力学分析
热降解动力学参数强烈依赖计算方式。Kissinger法是通过微分法计算表观活化能,其优点是不需要提前知道热降解机制。Flynn-Wall-Ozawa法是通过积分法得到表观活化能,主要优点是不需要知道聚合物的真实降解过程及反应级数。Coasts-Redfern法被广泛用于推测聚合物的热降解机制,该计算方法不受升温速率影响。本文使用Kissinger法及Flynn-Wall-Ozawa法计算生物基PA56纤维的表观活化能,Coasts-Redfern法推测生物基PA56纤维的热降解机制。
2.2.1 Kissinger法
Kissinger法是利用最大质量损失速率对应的温度(T)计算活化能。按照Kissinger法,动力学参数的基本关系式(7)可改写为
(8)
PA56热降解过程的活化能可通过ln(β/T2)对1/T曲线线性拟合的斜率计算得到。图2示出根据图1利用Kissinger法拟合的ln(β/T2)与1/T关系曲线,其计算结果汇总如表1所示。可知生物基PA56纤维的活化能为235.00 kJ/mol。

图2 Kissinger法拟合的ln(β/T2)与1/T关系曲线

表1 Kissinger法计算得到的活化能及相关系数
2.2.2 Flynn-Wall-Ozawa法
按照Flynn-Wall-Ozawa法,动力学参数的基本关系式(6)可改写为
(9)
生物基PA56纤维热降解过程的活化能可通过lgβ对1 000/T拟合直线的斜率确定。图3示出根据图1通过Flynn-Wall-Ozawa法线性拟合得到的lgβ与1 000/T的曲线。可以看出,几条拟合曲线几乎平行,说明在本文研究的质量损失率范围(0.1~0.9)内,该方法是适用的,这表明PA56纤维的热降解机制为单一反应机制。根据不同质量损失率计算得到的活化能列于表2,其平均值为217.23 kJ/mol。当质量损失率α为0.4时,对应的活化能E值(231.09 kJ/mol)与通过Kissinger法计算得到的值(235.00 kJ/mol)非常相近,因此,说明通过Kissinger法及Flynn-Wall-Ozawa法得到的活化能是可靠的。
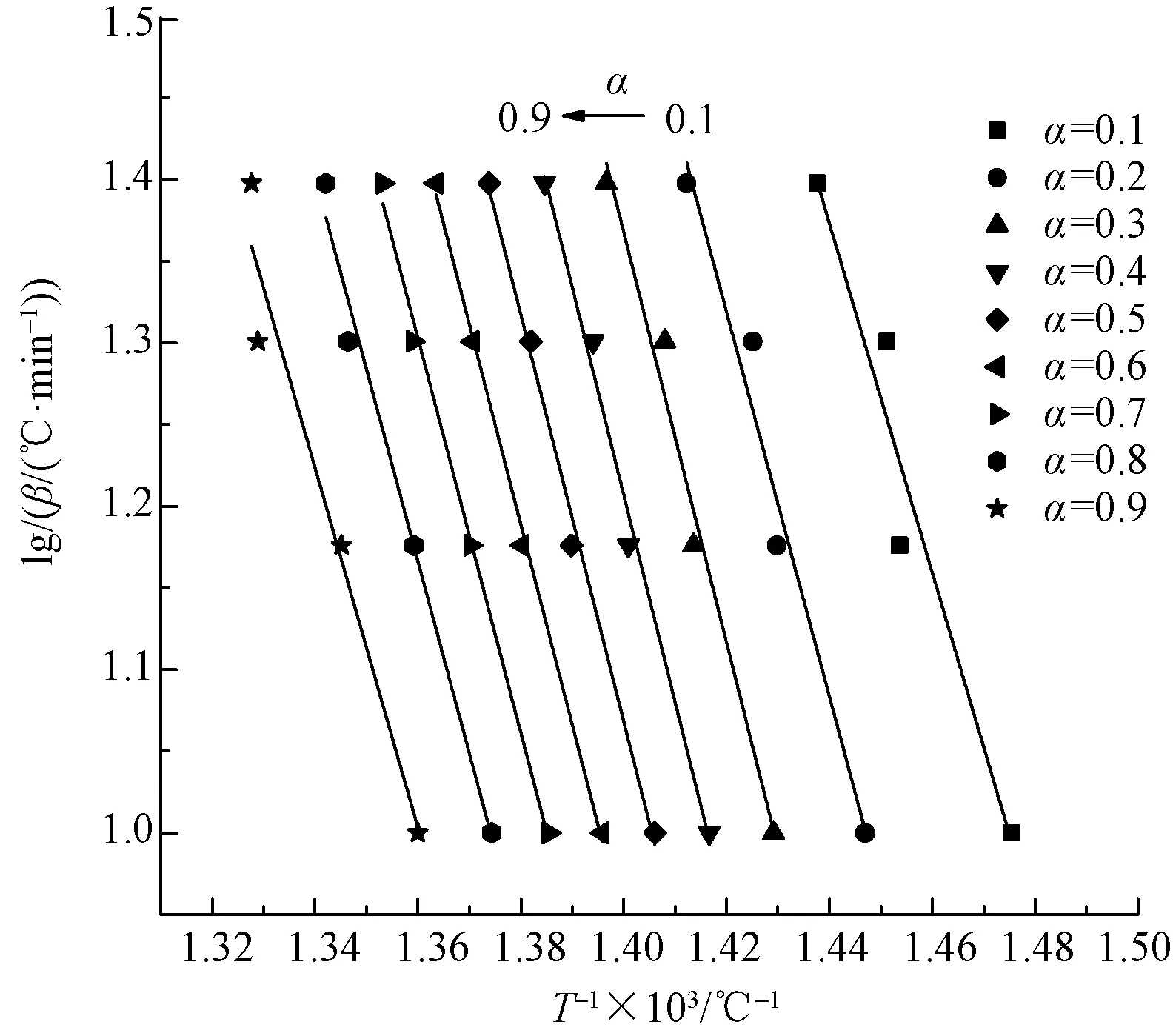
图3 Flynn-Wall-Ozawa法拟合的lgβ与1 000/T关系曲线
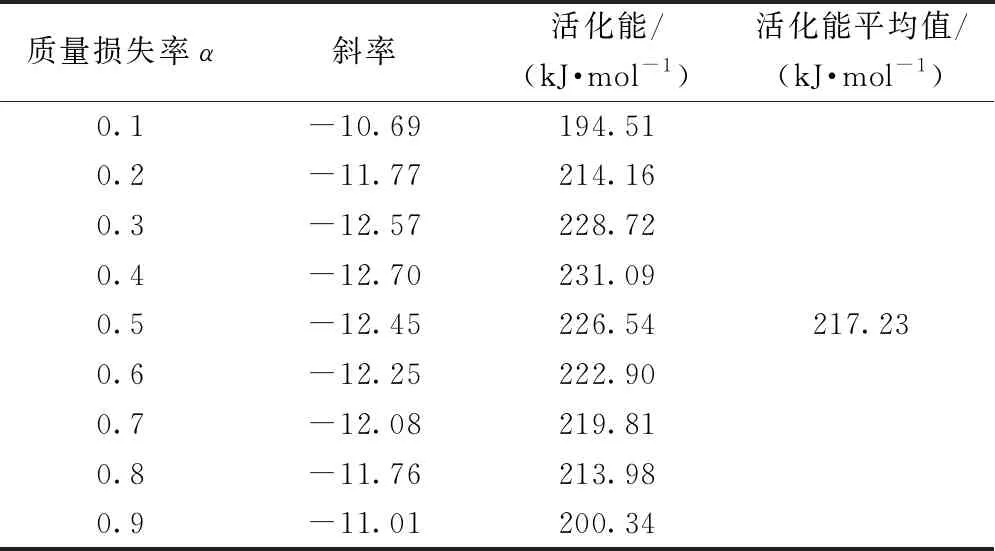
表2 Flynn-Wall-Ozawa法计算得到的活化能
2.2.3 Coasts-Redfern法
Coasts-Redfern法可推测聚合物的热降解机制,因此,通过Kissinger法及Flynn-Wall-Ozawa法计算得到的活化能,结合Coasts-Redfern法可确定生物基PA56纤维的热降解机制。
按照Coasts-Redfern法,动力学参数的基本关系式(6)可改写为
(10)
活化能可通过ln(g(α)/T2)对1 000/T的拟合曲线计算得到。根据不同的降解途径,理论函数g(α)对应不同的动力学机制及代数表达式[5]。图4示出4种不同升温速率下,采用不同的理论函数得到的ln(g(α)/T2) 对1 000/T拟合曲线。

图4 Coasts-Redfern法拟合的ln(g(α)/T2)与1 000/T关系曲线
不同的动力学机制得到的活化能E及相关系数R结果如表3所示。可以看出,生物基PA56纤维的降解机制类型为F1时(理论函数g(α)=-ln(1-α)),4种不同升温速率下得到的活化能均和通过Kissinger法及Flynn-Wall-Ozawa法求得的活化能接近,平均值为232.18 kJ/mol,因此,通过Coasts-Redfern法可推出PA56的热降解固态过程可能为在单个粒子上原子核随机成核。

表3 Coasts-Redfern法计算得到的活化能及相关系数
2.3 生物基PA56纤维的热降解过程研究
2.3.1 基于TG-IR技术的PA56热降解过程分析
TG-IR技术是常用的研究聚合物热降解过程的技术,其可以对聚合物受热过程中热解挥发物的演变过程进行实时监测。图5示出生物基PA56纤维在氮气氛围下热解气相产物的三维TG-IR谱图。可知,生物基PA56纤维起始降解温度(T5%)为403 ℃,最大热质量损失温度(Tmax)为453 ℃,温度达到500 ℃时基本降解完全。
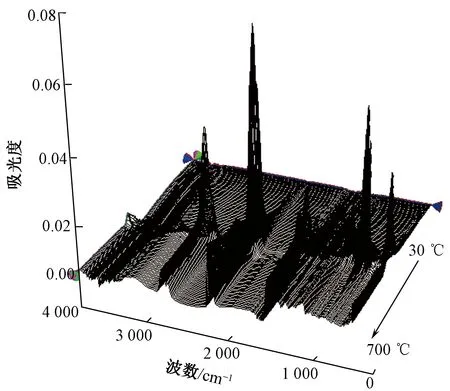
图5 生物基PA56纤维在氮气氛围下的三维 TG-IR谱图
为更直观地了解不同温度下生物基PA56纤维热解产物的类型及其产生的温度范围,将不同温度下生物基PA56纤维热解气相产物的红外谱图及主要热解气相产物含量随温度的变化曲线从三维 TG-IR谱图中解析出来,如图6所示。

图6 不同温度下生物基PA56纤维热解气相产物的红外光谱图
基于文献[6]可知,聚酰胺红外曲线在3 333 cm-1处为胺基,3 000~2 800 cm-1处为脂肪族碳氢化合物,2 408~2 239 cm-1处为CO2,1 767 cm-1处为环戊酮或其衍生物的特征峰,1 667 cm-1处为酰胺片段,1 528、1 438、1 229 cm-1处为芳香族化合物的特征峰;966、931 cm-1处为聚酰胺常见的气相挥发物的特征峰。由图6可知:当热解温度达到400 ℃时,生物基PA56纤维刚开始热解,热解气相产物主要为CO2;温度升至450 ℃(热解最剧烈)时,热解气相产物种类增加,除CO2外,从红外谱图上还可观察到胺/酰胺片段、脂肪族碳氢化合物、环戊酮或其衍生物、芳香族化合物及NH3等气相热解产物的特征峰;当热解温度达到550 ℃时,环戊酮或其衍生物及NH3特征峰消失,这表明环戊酮可能参与热解反应形成更稳定的芳香族化合物;当温度高于550 ℃时,红外谱图几乎不再发生变化,这是由于PA56在550 ℃时已基本热解完全。
图7示出生物基PA56纤维主要热解气相产物吸光度随温度的变化曲线。为更直观地观察气相产物含量的变化情况,TGA中的Gram Schmidt曲线同时被绘制在图7中。可以看出:生物基PA56纤维在380 ℃开始释放CO2,700 ℃仍能被检测到;环戊酮在400~500 ℃产生,NH3、酰胺片段、碳氢化合物在500 ℃以上仍能被检测到。结果表明,脱羧反应发生在整个热解过程,热解起始阶段形成环戊酮[7],可作为反应物参与反应形成更加稳定的芳香族化合物。
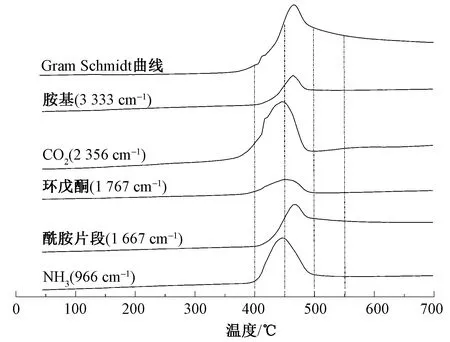
图7 生物基PA56纤维主要热解气相产物吸光度随温度的变化
2.3.2 基于Py-GC/MS分析PA56气相热解产物
为进一步确定生物基PA56纤维热解气相产物,推测其热解机制,采用Py-GC/MS技术对生物基PA56纤维在455、500及550 ℃下热解产生的气相挥发物进行分离检测,结果如图8所示。可以看出,尽管有许多小的信号峰可被观察到,但只有一小部分能够被准确检测。图8中所有能够被识别的热解气相产物(与NIST库中物质匹配度>85%)结果见表4所示。
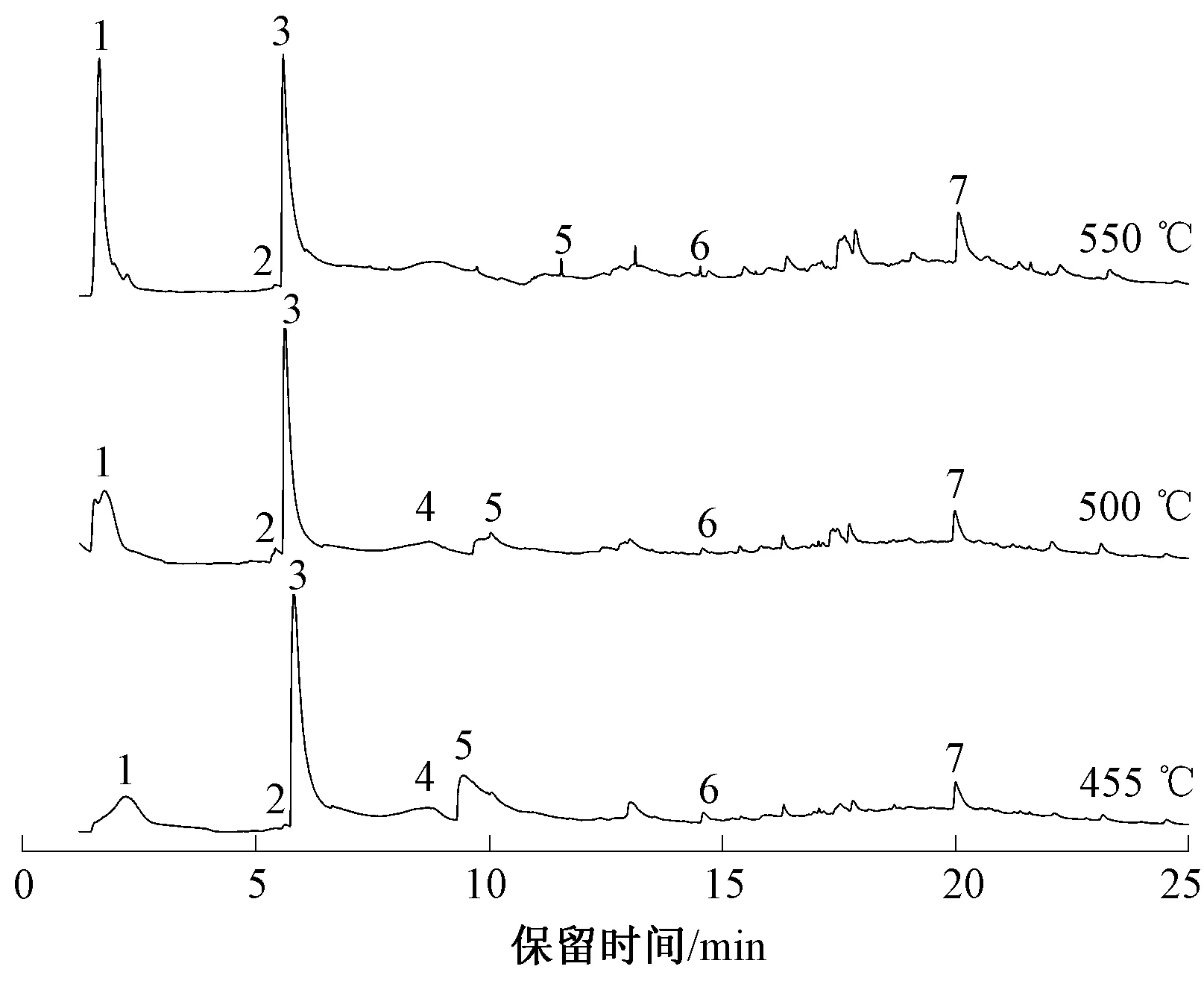
图8 不同热解温度下PA56的 Py-GC/MS谱图

表4 不同热解温度下PA56的热解挥发物对照表
结合图8和表4可知,在氮气氛围下,生物基PA56纤维的主要热解产物为CO2(1)、环戊酮(3)、1,5-戊二胺(5)、7-羟基-1-氮杂环烷-2-酮(7)。此外,还有少量吡啶及芳香族化合物产生。随着裂解温度的升高,CO2及7-羟基-1-氮杂环烷-2-酮相对含量增加,环戊酮及1,5-戊二胺相对含量降低。由表4还可以观察到,物质2随着裂解温度的变化而变化:热解温度为455 ℃时,物质2为吡啶,相对含量为0.35;当热解温度为500 ℃时物质2为氨基环戊烷,且相对含量几乎不发生变化;当热解温度达到550 ℃时,物质2为环戊烯。这一结果表明,不同热解温度下PA56可能存在不同的降解路径。
3 结 论
本文利用热重技术测定了氮气氛围下,生物基聚酰胺56(PA56)纤维在不同升温速率下的热降解曲线,结果表明,生物基PA56纤维在氮气氛围下的热降解过程为一级反应,随着升温速率的增加,其起始降解温度、最大热质量损失速率及最大热质量损失速率对应的温度均增加。通过Kissinger法、Flynn-Wall-Ozawa法及Coasts-Redfern法计算获得的生物基PA56纤维的活化能分别为235.00、217.23及232.18 kJ/mol。Coasts-Redfern法得到的结果推测PA56的热降解过程可能为单个粒子上原子核随机成核(F1型),积分形式为g(α)=-ln(1-α)。生物基PA56纤维在400 ℃开始热解,主要气相产物为CO2;温度达到450 ℃时出现胺/酰胺片段、脂肪族碳氢化合物、环戊酮或其衍生物、芳香族化合物及NH3等气相热解产物的特征峰;当热解温度达到550 ℃时,环戊酮或其衍生物特征峰消失,环戊酮作为反应物形成更稳定的芳香族化合物。气相色谱质谱联用技术研究结果进一步定性解析PA56的热解气相主要产物为CO2、环戊酮及1,5-戊二胺,且在不同热解温度下可能存在不同的降解路径。