南极假丝酵母脂肪酶B 基因在大肠杆菌中的表达和发酵优化
吴蓉 曹佳睿 曹君 刘飞翔 杨猛 苏二正,2
(1. 南京林业大学轻工与食品学院,南京 210037;2. 南京林业大学南方现代林业协同创新中心 南京林业大学林业资源高效加工利用协同创新中心,南京 210037)
脂肪酶(EC 3.1.1.3)是一类作用于三酰基甘油的酯键,将其水解成脂肪酸、二酰基甘油、单酰基甘油和甘油的生物催化剂[1]。脂肪酶广泛存在于自然界各种动植物和微生物体内,是一种重要的酯键水解酶,具有高度的化学、区域和立体选择性,在非水相体系也具有高效的催化活性[2]。南极假丝酵母脂肪酶B(Candida antarcticalipase B,CALB)作为一种性能优异的脂肪酶,它既可以高效催化水溶性底物,也可以催化非水溶性底物[3]。因而,在生物柴油生产[4-7]、有机合成[8-10]、医药中间体合成[11-12]、手性化合物拆分[13]、木质素增值化利用[14]和氨解反应[15]等领域得到广泛应用。
CALB 来源于在南极大陆被分离得到的南极假丝酵母,原始菌株酶产量低,发酵周期长,而且分离成本高,难以满足应用需求[16],所以目前基因工程技术法是生产CALB 的主要方法,通过构建异源表达系统实现CALB 的高效生产,将CALB 分别在大肠杆菌[17-22]、毕赤酵母[23-25]、酿酒酵母[26]和米曲霉[27]等宿主中进行表达。由于其具有遗传背景清楚,重组技术成熟,所用培养基简单廉价等优点[28-29],大肠杆菌是基因工程中最常用的宿主菌。Liu 等[18]首次在大肠杆菌Origami B 中进行了CALB的功能性表达,随后添加不同信号肽[30-31]、使用不同宿主菌[17]、密码子优化[19]和融合标记[32]等方法被广泛应用于提高大肠杆菌表达系统中CALB 的可溶性表达。但是,目前大肠杆菌异源表达CALB还存在一些问题,蛋白质翻译后无法被正确修饰,真核来源基因容易形成大量的包涵体[27],导致了较低的表达量。发酵优化是减少原核系统包涵体形成,提高蛋白质可溶性表达最直接有效的方法之一,同时还可以降低生产成本[33],对于大肠杆菌表达CALB 的发酵优化研究较少。因此,建立CALB 的大肠杆菌异源表达系统并探索最佳发酵工艺条件具有重要的意义。
本研究构建了带有不同信号肽的CALB基因重组质粒,并导入到不同的大肠杆菌宿主菌中,成功实现了CALB 在大肠杆菌中的异源表达。然后,以重组菌为研究对象,通过对基础培养基种类、诱导条件、培养基成分等的系统优化,期望实现CALB在大肠杆菌中高水平可溶性表达,为CALB 的低成本、高酶活重组大肠杆菌发酵生产奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌种和质粒 表达质粒pET-25b 和表达宿主E.coliBL21(DE3)和E.coliRosetta(DE3)由本实验室自主保藏。CALB基因片段由上海捷瑞生物工程有限公司合成。
1.1.2 主要试剂 PCR 扩增试剂盒(PrimeSTAR®HS DNA Polym)、限制性内切酶(NcoI、NdeI、EcoRI)和T4 连接试剂盒(T4 DNA Ligase)等均由大连TaKaRa 生物公司提供,异丙基硫代-β-D-半乳糖苷(Isopropyl-beta-D-thiogalactopyranoside,IPTG)、氨苄青霉素(Ampicillin,Amp)和氯霉素(Chloramphenicol,Cml)由上海生工生物公司提供,5×考马斯亮蓝G-250 试剂盒和牛血清蛋白(Bovine serum albumin,BSA)由北京索莱宝公司提供,胰蛋白胨和酵母提取物由Oxoid 公司提供。对硝基苯酚(pNP)和对硝基苯酚乙酸酯(pNPA)由上海源叶生物科技有限公司提供。其他试剂均为国产分析纯。
1.1.3 培养基 Luria-Bertani(LB)培养基:蛋白胨10 g/L,酵母提取物5 g/L,NaCl 10 g/L(固体平板加入琼脂粉20 g/L);Super Broth(SB)培养基:蛋白胨30 g/L,酵母提取物15 g/L,NaCl 15 g/L;Terrific Broth(TB)培养基:蛋白胨12 g/L,酵母提取物24 g/L,甘油5 g/L,K2HPO472 mmol/L,KH2PO417 mmol/L;YTGN broth(TY)培养基:蛋白胨20 g/L,酵母提取物 10 g/L,甘油 8 g/L,Na2HPO45 g/L。用于培养大肠杆菌E.coliBL21(DE3)的培养基中添加终浓度为100 μg/mL 的氨苄青霉素,用于培养大肠杆菌E.coliRosetta(DE3)的培养基中添加终浓度各为100 μg/mL 的氨苄青霉素和氯霉素。
1.2 方法
1.2.1 引物设计 根据南极假丝酵母脂肪酶B 基因序列(GenBank 登录号为 Z30645.1)设计如下引物。P1:5'-CATGCCATGGATGATGATGATGATCTACCTT CCGGTTCGGACCCT-3',P2:5'-GGAATTCAGGGGGT GACGATGCCGGAGCA-3';P3:5'-GTCCATATGAAAA AGATTTGGCTGGCGCTGGCGGGCCTGGTGCTGGCGT TTAGCGCGAGCGCCATGGATGATGATGATG-3',P4:5'-GGAATTCAGGGGGTGACGATGCCGGAGCAGGTC CTTT-3'。在P1、P2 两条引物的5'端分别引入NcoI和EcoRI 限制性酶切位点(划线部分),在P3、P4两条引物的5'端分别引入NdeI 和EcoRI 限制性酶切位点(划线部分)并添加保护碱基。为了促进CALB的可溶性表达,在原始基因序列的上游添加了5 个天冬氨酸融合标签[20]。引物由金斯瑞(南京)公司合成。
1.2.2 重组质粒的构建 以CALB基因作为扩增模板,以P1 和P2 为引物进行PCR 扩增获得重组质粒pET25b-CALB-1,以P3 和P4 为引物进行PCR 扩增获得重组质粒pET25b-CALB-2(94℃变性10 s,55℃退火5 s,72℃延伸1 min,工作30 个循环)。PCR 产物与表达质粒pET25b 使用NcoI/EcoRI 内切酶和NdeI/EcoRI 内切酶进行过夜酶切,胶回收后用T4 连接酶将目的基因和线性化载体连接,再使用氯化钙转化法将构建好的重组质粒进行感受态转化。筛选阳性重组子,培养并提取质粒进行菌落PCR 和双酶切验证。测序结果进行Blast 比对分析,若未发生突变,重组质粒构建成功。
1.2.3 重组工程菌的筛选和表达 构建好的重组质粒同时转入大肠杆菌E.coliBL21(DE3)和E.coliRosetta(DE3)中,然后在添加相应抗生素的LB 琼脂平板上37℃培养过夜。分别挑取重组菌pET25b-CALB-1/ BL21(DE3)、pET25b-CALB-1/Rosetta(DE3)、pET25b-CALB-2/ BL21(DE3)和pET25b-CALB-2/Rosetta(DE3)4 种单菌落,接种到10 mL LB 培养基中过夜培养,再按1%接种量接种到50 mL 的LB 培养基中,37℃,200 r/min 培养至OD600达到0.8 时添加终浓度为0.2 mmol/L 的IPTG 诱导表达,离心收集菌体和发酵液。将菌体用Tris-HCl 缓冲液(pH 8.0)复溶后,进行超声破碎(功率300 W,超声3 s,间隔5 s,工作时间10 min),并离心收集菌体上清液和菌体沉淀,用于酶活力测定、蛋白浓度测定和SDS-PAGE 分析。
1.2.4 基础培养基的筛选、诱导条件和培养基成分的优化
1.2.4.1 基础培养基的筛选 将方法1.2.3 筛选出的重组菌在LB、TB、SB 和TY 培养基中诱导发酵,比较不同培养基对CALB在大肠杆菌中表达的影响。
1.2.4.2 诱导条件的优化 研究不同浓度的IPTG 和乳糖作为诱导剂,在不同诱导温度下诱导CALB的表达情况。
1.2.4.3 培养基成分的优化 为了进一步提高CALB表达量的同时降低培养基的成本,分别用不同种类和浓度的碳源和氮源替代基础培养基中的原始碳源和氮源,用不同浓度的安琪酵母替代Oxoid 酵母提取物,并对无机盐的浓度进行了优化。
1.2.5 进程曲线 将重组菌接种到方法1.2.4 筛选出的最优成分的培养基中,在最优的诱导条件下诱导72 h,每隔6 h 取一次样,研究重组菌经过不同时间诱导后的生长情况和CALB的表达量。
1.2.6 分析方法
1.2.6.1 CALB 酶活力的测定 根据文献[17]所述并做了部分修改,通过测定pNPA 的初始水解速率,测定CALB 的活性。取10 μL 含有200 mmol/LpNPA的乙腈溶液,加入435 μL 乙腈溶液和5.5 mL Tris-HCl 缓冲液(0.05 mmol/L,pH 8.0),最后加入粗酶液10 μL,25℃反应5 min,测定反应液在404 nm 处的吸光值。一个酶活力单位(U)定义为在25℃,pH 8.0 的条件下,1 min 内催化生成1 μmolpNP 所需要的酶量,酶活力(U/mL)定义为每毫升发酵菌液具有的酶活力单位数,即单位体积重组菌胞内和胞外产生酶活的总和。
1.2.6.2 SDS-PAGE 分析 取方法1.2.3 中的发酵液、菌体上清液和菌体沉淀进行SDS-PAGE 分析。采用12%的分离胶和5%的浓缩胶制胶,电泳后使用考马斯亮蓝R-250 进行染色。
1.2.6.3 蛋白浓度的测定 根据Bradford 测定法[34]原理进行蛋白含量测定,按照蛋白定量试剂盒(5×考马斯亮蓝G-250),根据测定的吸光值绘制标准曲线 为:y=2.580 3x+0.003 7(0<x<0.16)R2=0.996 7,在0-0.16 mg/mL 浓度范围内的线性较强,该方程可以用于蛋白的定量分析。CALB 的比活力定义为在25℃,pH 8.0 的条件下,单位重量(mg)蛋白所具有的CALB 酶活力单位数。
2 结果
2.1 重组质粒的构建
按1.2.2 方法构建带有自身PelB 信号肽(图1-A)和DsbA 信号肽(图1-B)的重组质粒,构建的重组质粒分别经过NcoI/EcoRI 和NdeI/EcoRI 双酶切验证(图1-C),均在1 000 bp 和5 500 bp 左右形成了两个条带,下方条带与插入目的基因大小相同,上方条带与载体片段大小相同,测序结果进行Blast 比对分析,均未发生突变,表明带有自身PelB 信号肽和DsbA 信号肽的重组质粒构建成功,分别命名为pET25b-CALB-1 和pET25b-CALB-2。
2.2 重组工程菌的表达和筛选4种重组菌
pET25b-CALB-1/ BL21(DE3)、pET25b-CALB-1/Rosetta(DE3)、pET25b-CALB-2/ BL21(DE3) 和pET25b-CALB-2/Rosetta(DE3)接种到TB 培养基后在25℃下经过0.2 mmol/L 的IPTG 诱导48 h 后,表达的CALB 酶活力分别达到1.52、1.90、1.23 和1.58 U/mL,而相同条件下空宿主表达产物没有酶活力。从酶活力测定结果来看,带有自身PelB 信号肽的重组菌表达量明显高于带有DsbA 信号肽的重组菌,宿 主 菌E.coliRosetta(DE3)比E.coliBL21(DE3)更适合用于CALB 的异源表达。从SDS-PAGE 电泳结果来看,4 种重组菌发酵后的上清液(图2-A)、菌体上清液(图2-B)和菌体沉淀(图2-C)在33 kD 左右有明显条带,且带有自身PelB 信号肽的两种重组菌条带更为明显,而空宿主除本身的特征条带外没有该条带,表明4 种重组菌都可以成功表达CALB,带有自身PelB 信号肽的重组菌表达效果更好。所以,选择CALB 酶活力最高的重组菌pET25b-CALB-1/Rosetta(DE3)进行后续的发酵优化。
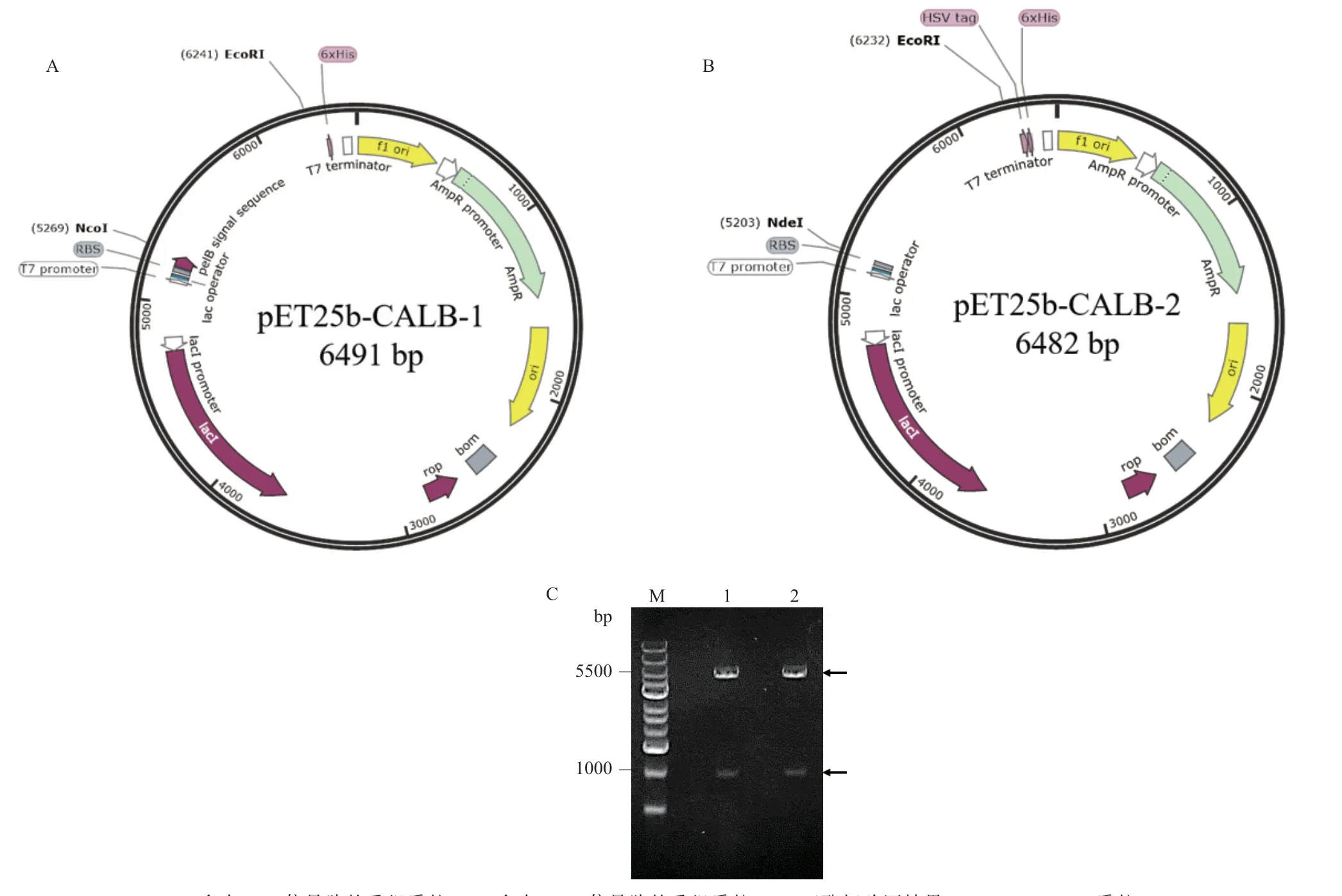
图1 重组质粒的构建和双酶切验证
2.3 基础培养基的优化
选用SB、TB、LB 和TY 四种基础培养基,重组 菌pET25b-CALB-1/Rosetta(DE3) 在25℃下 经过0.2 mmol/L 的IPTG 诱导48 h 和60 h 后的表达和生长情况,如图3 所示。在CALB 的可溶性表达方面,4 种培养基中以TB 和TY 培养基效果最好,SB培养基次之,LB 培养基效果最差,说明不同培养基对CALB 的表达效果具有不同的影响;对于SB、TB和LB 三种培养基来说,诱导时间的延长没有明显提高CALB的可溶性表达,而使用TY 培养基表达的CALB酶活力和比活力均有了显著的提高,且酶活力达到了最高值2.37 U/mL。在菌体生长方面,在TB和TY 培养基中获得的细胞密度明显高于SB 和LB,当重组菌在TB 培养基中培养60 h 时OD600达到最高值,说明TB 和TY 培养基更有助于大肠杆菌的生长。因此,选择诱导60 h 后可溶性表达效果最好的TY培养基作为下一步优化的基本培养基。

图2 重组菌的SDS-PAGE 分析图
2.4 诱导条件的优化
2.4.1 诱导剂种类和浓度的优化 重组菌在25℃条件下经过不同浓度的IPTG(0.05-1 mmol/L)和乳糖(0.5%-3%)诱导60 h 后研究CALB的可溶性表达和生长情况。如图4-A 所示,随着IPTG 浓度的升高,菌体生长和CALB 的可溶性表达均呈现出先升高后降低的趋势,酶活力在IPTG 浓度为0.1 mmol/L 时达到最高,为2.19 U/mL。如图4-B 所示,加入不同浓度的乳糖诱导剂对细胞密度没有显著的影响,但明显低于IPTG 诱导的重组菌细胞密度;当乳糖浓度低于1%时,CALB 的可溶性表达效果最好,乳糖浓度高于1%后,CALB 的酶活力逐渐下降,比活力保持稳定。当乳糖浓度为0.5%时,比活力最高,酶活力为2.79 U/mL,与0.75%和1%乳糖浓度下的酶活力没有显著性差异,与用0.1 mmol/L IPTG 诱导相比,提高了约0.27 倍。因此,浓度为0.5%的乳糖溶液是诱导大肠杆菌中CALB 表达的最佳诱导剂。
2.4.2 诱导温度的优化 加入乳糖诱导剂后分别在16、20、25、30 和37℃下诱导60 h,结果如图5 所示。随着温度的升高,CALB 的酶活力和比活力均呈现出升高后降低的趋势,在诱导温度为20℃时,酶活力达到最高为8.31 U/mL;而细胞密度OD600表现出先降低后升高的趋势,25℃时细胞密度OD600最低。高温和低温对于CALB 的表达都有不利的影响,但总体来说,高温有利于大肠杆菌的生长却更加不利于酶的可溶性表达,表现出更低的酶活力。因此,选择20℃作为最适于重组菌生长和表达的诱导温度。

图3 不同基础培养基对CALB 可溶性表达的影响
2.5 培养基成分的优化
2.5.1 碳源种类和浓度的优化 选择了1%(W/V)的6 种碳源(蔗糖、葡萄糖、甘油、山梨醇、淀粉和糊精)代替TY 培养基中的0.8%(W/V)甘油,结果如表1 所示。蔗糖、葡萄糖和淀粉导致了较低的酶活力、比活力和细胞密度,其中葡萄糖是最不利于CALB 表达的碳源;而甘油、山梨醇和糊精有利于CALB 的表达,促进了菌体生长,且产生了较高的酶活力和比活力。山梨醇是对重组菌生长和表达CALB 效果最佳的碳源,诱导60 h 后,CALB 酶活力最高达到了12.12 U/mL,相比于甘油作为碳源,酶活力提高了1.04 倍,所以选择山梨醇作为发酵培养的碳源。为了获得更高的酶活力,进一步优化了加入山梨醇的浓度(0.75%-2.5%,W/V),结果如图6 所示。随着山梨醇浓度的提高,细胞密度OD600值呈现出缓慢下降的趋势,CALB 的酶活力和比活力则逐步提高。当山梨醇浓度达到1.75%(W/V)后,酶活力和比活力最高,酶活力为18.86 U/mL,然后开始下降。因此,选择1.75%(W/V)糊精代替0.8%(W/V)甘油作为下一步优化的最佳碳源。

图4 不同浓度的IPTG(A)和乳糖(B)对CALB 表达的影响
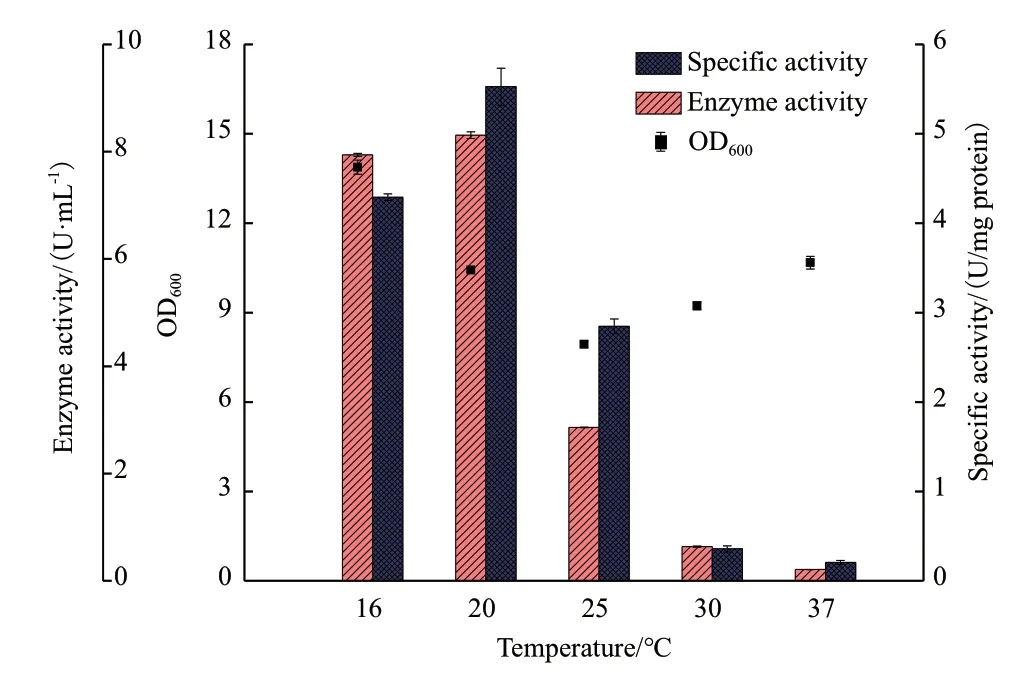
图5 不同诱导温度对CALB 表达的影响
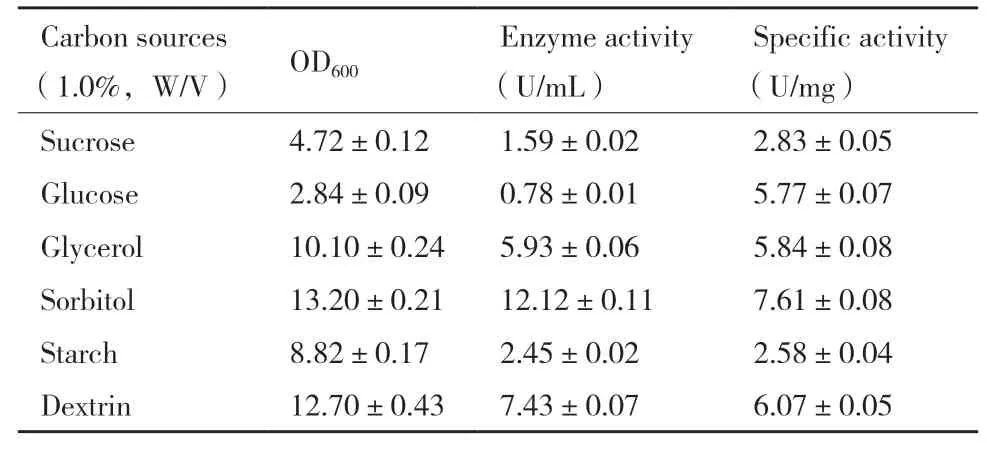
表1 不同碳源对重组大肠杆菌的生长和CALB 表达的影响
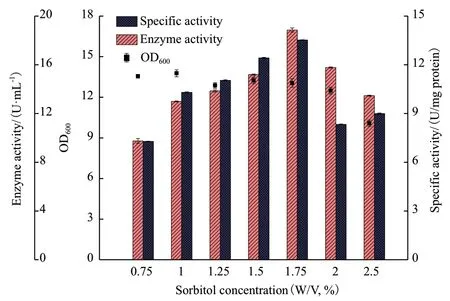
图6 不同浓度的糊精对CALB 表达的影响
2.5.2 氮源种类和浓度的优化 选择了2%(W/V)的6 种碳源,豆粕(Soybean meal,SM)、牛骨蛋白胨(Bovine bone peptone,BBP)、 鱼蛋白胨(Fish peptone,FP)、花生粉(Peanut powder,PP)和玉米浆(Corn steep liquor,CSL)代替TY 培养基中的Oxoid 胰蛋白胨,结果如表2 所示。使用SM、PP 和CSL 替代胰蛋白胨作为氮源后,CALB 的表达量明显下降了;而BBP 和FP 作为替代氮源对于CALB 的可溶性表达有显著的促进作用。其中,FP 是最适合用于重组菌生长和表达CALB 的氮源,CALB 酶活力达到22.70 U/mL。进一步研究了FP 浓度(1%-2.5%,W/V)对于CALB表达的影响,结果如图7 所示。当FP 浓度较低时,重组菌生长缓慢且CALB 的可溶性表达水平较低,随着FP 浓度升高,细胞密度OD600和CALB 的酶活力呈现出先上升后下降的趋势,比活力则逐步提高后保持稳定,当FP 浓度为2.25%(W/V)时,CALB 的酶活力最高,为23.90 U/mL,相比于2%(W/V)胰蛋白胨作为氮源,酶活力提高了0.23 倍。因此,选择2.25%(W/V)鱼蛋白胨代替2%(W/V)胰蛋白胨作为下一步优化的最佳氮源。

表2 不同氮源对重组大肠杆菌的生长和CALB 表达的影响

图7 不同浓度的鱼蛋白胨对CALB 表达的影响
2.5.3 安琪酵母替代物的优化 选择价格低廉的国产安琪酵母提取物替换TY 培养基的Oxoid 酵母提取物,并进一步优化安琪酵母提取物的浓度(0.5%-4%,W/V)以达到降低培养基的成本并保持CALB表达量的目的。如图8 所示,当国产安琪酵母提取物浓度为1%(W/V)时,CALB 的酶活力和比活力均达到最高值,酶活力为27.43 U/mL,相比于Oxoid 酵母提取物略有提高。因此,国产安琪酵母提取物的最佳浓度为1%(W/V)。
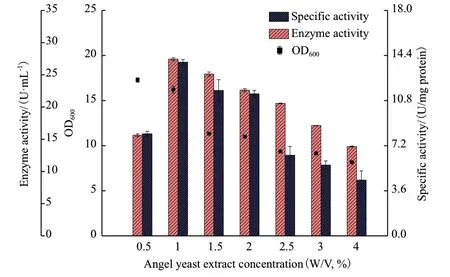
图8 不同浓度的安琪酵母提取物对CALB 表达的影响
2.5.4 无机盐浓度的优化 原TY 培养基中无机盐为0.5%(W/V)Na2HPO4,通过调节浓度(0.25%-1.25%,W/V)以获得更高的CALB 酶活力,结果如图9 所示。当无机盐Na2HPO4浓度为0.75%(W/V)时,CALB 的酶活力最高为36.43 U/mL,同时伴随着较高的细胞密度OD600和比活力,经过无机盐浓度优化后酶活力提高了0.26 倍。因此,选择0.75%(W/V)Na2HPO4作为培养基中最佳浓度的无机盐。
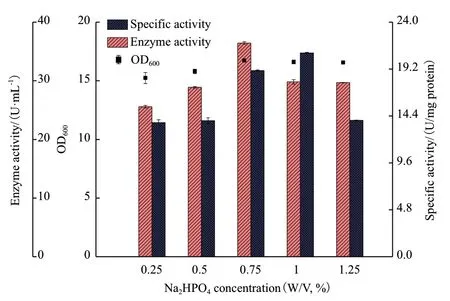
图9 不同浓度的Na2HPO4 对CALB 表达的影响
2.6 进程曲线
经过一系列优化后,在含有1.75%(W/V)山梨醇、2.25%(W/V)鱼蛋白胨、1%(W/V)安琪酵母提取物、0.75%(W/V)Na2HPO4的最优培养基中,加入0.5%(W/V)乳糖作为诱导剂,研究了pET25b-CALB-1/Rosetta(DE3)在摇瓶中的培养时间进程,结果如图10 所示。在发酵前期,重组菌呈对数增长,48 h 后细胞密度OD600趋于稳定,直至60 h 菌体开始步入衰亡期。CALB酶活力和比活力的变化趋势基本保持一致,60 h 时达到最高值,然后开始下降。因此,最佳的发酵时间为60 h,此时CALB 酶活力最高为35.67 U/mL,比活力为19.18 U/mg,细胞密度OD600为17.65。
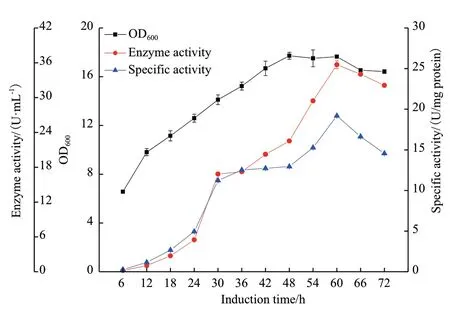
图10 最优条件下的发酵进程曲线
3 讨论
CALB 来源于真核生物南极假丝酵母,在大肠杆菌中的重组表达已有一些研究,然而,最终获得的酶活却不足以满足应用需求。Ujiie 等[19]利用E.coliBL21(DE3)作为表达CALB 的宿主菌,优化摇瓶诱导条件后CALB 的总酶活约为13 U/mL。Zhou等[32]为提高大肠杆菌中CALB 的可溶性表达,引入多氨基酸标记,成功表达了6His-CalB-10Lys,最终比活力为10.1 U/mL。Kim 等[20]构建了基于PelB信号肽连接5 个天冬氨酸标签的CALB 表达系统P-D5-CALB,并在E. coliBL21 star(DE3)中进行表达,结果表明重组菌胞外和胞内比活力分别为2.2 和0.3 U/mg,相对于没有添加5 个天冬氨酸标签的P-CalB分别提高了8.4 倍和3 倍。基于以上现状,本研究将添加了5 个天冬氨酸标签的CALB基因在大肠杆菌中进行表达,构建了带有不同信号肽和不同宿主菌的4 种重组菌,在摇瓶中进行初步发酵对比,筛选出最佳重组菌后进行培养基种类、诱导条件、培养基成分等的优化。
首先,通过重组菌的构建和表达研究发现,带有PelB 信号肽并在E. coliRosetta(DE3)中进行表达的重组菌pET25b-CALB-1/Rosetta(DE3)在CALB的表达上具有明显的优势,摇瓶初步发酵酶活力达到了1.90 U/mL。这一研究结果和Kim 等[20]构建的P-D5-CalB系统存在一定异同,说明了PelB 信号肽序列的结合促进了胞内和胞外CALB 的表达,且不同的信号肽影响CALB 表达的效果不同。PelB 信号肽可以将目的蛋白转运至周质空间,有利于目的蛋白的正确折叠,并维持构象[35]。添加DsbA 序列可以在蛋白质折叠过程中将肽链上的巯基氧化成二硫键[36-37],对目的蛋白的活性和稳定性具有重要作用。信号肽PelB 和DsbA 同样具有促进CALB 蛋白质正确折叠的作用,但是带有信号肽PelB 重组菌的酶表达量却明显优于DsbA。一方面,PelB 将目的蛋白表达定位在周质空间,周质空间具有氧化性,更有利于目的蛋白维持空间构象,而带有DsbA 信号肽的重组菌在胞内表达CALB,更容易受胞内复杂环境的影响,不利于维持蛋白的稳定性。另一方面,DsbA 并不是pET25b 的天然信号肽,可能会影响目的蛋白质的结构,导致较低的CALB 表达水平。因此,宿主菌E. coliRosetta(DE3)比E. coliBL21(DE3)更适合于CALB 的表达。
其次,适宜的基础培养基和诱导条件是获得过量重组蛋白的必要条件[38]。基础培养基的筛选研究结果表明,培养60 h 时TY 培养基效果最好,但细胞密度并不是最高的,说明菌体生长越好并不一定代表蛋白表达量越高。营养成分单一的LB 和SB 培养基效果明显不如营养成分丰富的TY 和TB 培养基,因为富含营养的培养基可能更有利于细胞生长和重组菌的酶表达[39]。随着培养时间延长,仅TY 培养基产生的CALB 酶活明显提高,说明使用TY 培养基具有获得更高表达量的潜力。在优化诱导剂的种类和浓度的研究中发现,相比于IPTG 作为诱导剂,在乳糖的诱导作用下重组菌的细胞密度更低,可能是因为乳糖也是一种碳源,糖类作为碳源不利于重组菌pET25b-CALB-1/Rosetta(DE3)的生长,这一点在本试验碳源种类和浓度的优化中得到了验证,蔗糖和葡萄糖的加入也导致了较低的细胞密度。在进行诱导温度的研究中发现,低温诱导更加有利于CALB 的可溶性表达,一方面可能是因为高温对菌体生长有益,重组蛋白来不及正确折叠,容易以包涵体的形式出现[40];另一方面,由于CALB 来源于南极大陆分离得到的南极假丝酵母,耐低温性强[41],所以低温条件下CALB 的表达量更高。
最后,探究了培养基成分对产量的影响,进行碳源、氮源、酵母提取物和无机盐的优化,最终确定了有利于CALB 表达的最佳培养基。各成分浓度的提高均有利于CALB 表达量的积累,但浓度过高会影响重组菌的生长和表达情况,原因可能是高浓度的培养基成分会影响重组菌生长环境的碳氮比、pH 和渗透压等关键因素,进而对酶的表达量产生不利影响[42]。相比于原始TY 培养基,本研究优化的最佳培养基采用价格低廉的鱼蛋白胨和国产安琪酵母提取物,降低了CALB 的生产成本。经过发酵进程曲线的研究发现,发酵60 h 后CALB 的酶活最高可达到35.67 U/mL。通过基础培养基种类、诱导条件和培养基成分的优化,CALB 的酶活力提高了17.77 倍,是目前以大肠杆菌为宿主菌摇瓶发酵生产CALB的最高水平。
本研究构建了异源表达CALB 的重组菌,并分别对基础培养基种类、诱导条件、培养基成分和进程曲线进行了探究,既降低了生产成本又实现了CALB 的高效表达。但是,一部分胞内的目的蛋白通过破碎菌体才能获得,有关CALB 的胞外分泌还需进一步加强研究。因此,在后续的研究工作中,我们将通过添加大肠杆菌胞外分泌的化学助剂、信号肽优化、CALB编码基因密码子优化、融合表达和共表达分子伴侣等方法提高CALB 的胞外分泌,并进行发酵罐放大培养的研究,旨在进一步提高CALB的胞外分泌效果并达到更高产量。
4 结论
本研究成功实现了CALB 在大肠杆菌中的异源表达,探究了不同信号肽和不同宿主菌对表达量的影响,并对培养基种类和诱导条件进行了优化,最佳组合是带有PelB 信号肽的 pET25b-CALB-1/Rosetta(DE3)重组菌株在20℃下使用0.5%(W/V)乳糖在TY 培养基中诱导表达。对TY 培养基的组成成分进行了详细优化,优化后的合成培养基成分为1.75%(W/V)山梨醇、2.25%(W/V)鱼蛋白胨、1%(W/V)安琪酵母、0.75%(W/V)Na2HPO4。在摇瓶中诱导60 h 后,CALB 酶活力最高达到35.67 U/mL。

