小鼠骨骼肌纤维类型定量PCR 内参基因的筛选
张静 熊燕 华永琳 郭玉 熊显荣 字向东 李键
(1. 青藏高原动物遗传资源保护与利用教育部重点实验室,成都 610041;2. 西南民族大学畜牧兽医学院,成都 610041)
不同部位骨骼肌代谢方式及功能存在较大差异,并且骨骼肌在运动、损伤等生理病理条件下,根据不同的代谢和功能需求进行持续的重塑[1]。对于家畜而言,不同的肌纤维类型组成,将影响家畜肉品质。骨骼肌的这些差异主要是由于肌纤维类型的组成不同。因此,检测骨骼肌纤维类型的组成对于研究骨骼肌的功能及家畜肉品质显得尤为重要。目前已经使用多种标准对肌纤维进行分型,包括组织化学方法[2]、收缩速度[3]、疲劳性、显性酶途径和肌球蛋白重链(Myosin heavy chain,MyHC 或Myh)亚型表达[4]。其中MyHC 亚型是肌纤维类型的分子标记,检测MyHC 亚型表达是最常用的分类标准。小鼠的肌肉纤维含有4 种MyHC 异构体,分别为I 型(Myh7),IIA 型(Myh2),IIB(Myh4)型 和IIX 型(Myh1),单根肌纤维通常表达单个MyHC 异构体[5-6]。其中I型纤维收缩速度慢,被称为慢肌纤维,以氧化代谢产生能量。IIB 型和IIX 型纤维收缩速度快,被称为快肌纤维,主要通过糖酵解途径代谢葡萄糖。IIA 型纤维为中间型纤维,收缩速度快,属于糖酵解/氧化磷酸化混合代谢类型[7]。近年来,为了从RNA水平研究肌肉组织肌纤维类型差异变化,阐明肌肉代谢和功能的分子机制,普遍采用灵敏度高,特异性好的逆转录荧光实时定量PCR(RT-qPCR)技术。
使用RT-qPCR 方法检测RNA 表达时,控制实验误差至关重要。目前RT-qPCR 检测技术以稳定的内参基因为参照,检测基因的相对表达量,降低实验误差对分析结果的影响[8]。然而,近年来研究表明常用管家基因肌动蛋白(Actb)和甘油醛-3-磷酸脱 氢 酶(Glyceraldehyde-3-phosphate dehydrogenase,Gapdh)可能不适合作为所有基因检测的内参基因。已有文献报道在山羊肌内前体脂肪细胞诱导分化不同时期[9]、子宫内膜异位[10]和水牛心肝肌肉等20 种组织中[11]Gapdh和Actb均不是最佳内参基因。在大鼠坐骨神经粉碎模型中,以Actb作为内参基因时,实验组靶基因表达发生显著变化,进一步分析表明发生实质变化是Actb而不是靶基因[12]。此外,越来越多的研究报道不同的组织、物种以及实验条件,稳定的内参基因具有特异性。例如,C57BL/10 小鼠股四头肌中表达稳定的内参基因为内质网滞留蛋白1(Retention in endoplasmic reticulum sorting receptor 1,Rer1)[13]。Hildyard 等[14]指 出,次黄嘌呤-鸟嘌呤磷酸核糖转移酶1(Hypoxanthine phosphoribosyltransferase 1,Hprt1)、琥珀酸脱氢酶亚基A(Succinate dehydrogenase complex flavoprotein subunit A,Sdha)和核糖体蛋白L13a(Ribosomal protein L13a,Rpl13a)是犬股外侧肌相对稳定的内参基因。McBryan 等[15]用geNorm 法分析猪背最长肌中β2-微球蛋白(Beta-2-microglobulin,B2m)为稳定的内参基因。综上所述,尽管在某一肌肉中的稳定内参基因已有研究报道,但是不同物种、不同部位肌肉组织稳定的内参均存在差异。基于RTqPCR 技术的肌纤维分型是肌肉功能研究的重要手段,但迄今为止在肌纤维类型的研究中,稳定的内参基因尚不清楚。因此,有必要筛选肌纤维类型检测的稳定内参基因。
本研究以小鼠肌纤维类型组成差异较大的腓肠肌(Gastrocnemius muscle,GAS)、比目鱼肌(Soleus,SOL)、胫骨前肌(Tibialis anterior muscle,TA)和趾长伸肌(Extensor digitorum longus,EDL)为试验材料,采 用RT-qPCR 技 术、geNorm[16]、NormFinder[17]、BestKeeper[18]和RefFinder[19]程序对Gapdh、Actb、Rer1、Hprt1和肽基脯氨酰异构酶A(Peptidylprolyl isomerase A,Ppia)、核糖体蛋白L7(Ribosomal protein L7,Rpl7)、B2m、Sdha和核糖体蛋白L27(Ribosomal protein L27,Rpl27)等9 个内参基因在4种肌肉组织表达的稳定性进行分析,旨在获得小鼠骨骼肌纤维检测的最佳内参基因,为后续骨骼肌纤维类型定量检测提供试验依据。
1 材料与方法
1.1 材料
1.1.1 实验动物 本试验所需实验鼠及小鼠标准化饲料均采购于成都达硕实验动物有限公司,6 周龄雌性C57BL/6 小鼠5 只,自由采食,12 h 黑暗,12 h 光照,断颈法处死小鼠,采集腓肠肌(GAS)、比目鱼肌(SOL)、胫骨前肌(TA)和趾长伸肌(EDL),将肌肉组织立即置于RNAiso Plus 中,使用眼科剪剪碎成每块1 cm3左右,反复冻融2 次,破碎细胞,然后储存于-80℃用于后续的实验。
1.1.2 主要试剂 RNAiso Plus(货号D9109)、PrimeScript RT reagent 反转录试剂盒( 货号RR047A)、SYSR®Premix Ex TaqTMⅡ( 货号RR036A) 购自TaKaRa( 美国);一抗:Myh2 MyHC- ⅡA( 货 号2F7)、Myh4 MyHC- ⅡB( 货号10F5)和Myh7 MyHC-I(货号BA-F8)均购自Developmental Studies Hybridoma Bank(美国);二抗:Goat anti-Mouse IgG1,Alexa Fluor 568( 货 号A-21124)、Goat anti-Mouse IgM,Alexa Fluor 488(货号A-21042) 和Goat anti-Mouse IgG2b,Alexa Fluor 488(货号A-21141)均购自Thermo Fisher Scientific(美国);山羊血清(货号005-000-121)购自Jackson ImmunoResearch(美国);Bovine serum albumin(BSA)(货号700-105P)购自Gemini Bio(美国);Triton X-100(货号 X100)购自Sigma-Aldrich(美国)。
1.2 方法
1.2.1 总RNA 提取和cDNA 的合成 按照RNAiso Plus 试剂盒的使用说明提取腓肠肌(GAS)、比目鱼肌(SOL)、胫骨前肌(TA)和趾长伸肌(EDL)的总RNA,利用紫外分光光度计检测RNA 样品的核酸浓度及A260nm/A280nm值(该值在1.8-2.1 的样品才可进行下步实验)。使用反转录酶试剂盒,以总RNA 为模板按照说明书进行反转录,将获得的cDNA 置于-20℃保存。
1.2.2 荧光定量RCR 引物设计及标准曲线的构建 本试验选取Gapdh、Actb、Rer1、Hprt1、Ppia、Rpl7、B2m、Sdha和Rpl27等9 个基因作为内参基因,利用NCBI 中BLAST 软件,根据GenBank 上9 个基因在小鼠中的基因序列设计荧光定量PCR 引物引物(表1),由成都擎科梓熙生物技术有限公司合成引物。将cDNA 模板按10 倍进行稀释,选取10-1-10-5稀释倍数样品进行RT-qPCR,构建标准曲线。
1.2.3 实时荧光定量PCR RT-qPCR 反应体系为15 μL:SYSR®Premix Ex TaqTMⅡ 7.5 μL,上游引物(10 μmol/L)1 uL,下游引物(10 μmol/L)1 μL,cDNA 2 μL,补充ddH2O 至15 μL。反应程序:95℃ 3 min;95℃ 10 s,60℃ 30 s,72℃ 45 s 共40 个循环。每种骨骼肌纤维组织样品设置2 个重复。

表1 9 个候选内参基因的引物序列
1.2.4 免疫荧光染色 实验方案参照Wang 等[20],采用Leica-CM1850 冰冻切片机,OCT 包埋,温度设定-20℃,切片厚度10 μm 制作冰冻切片,用封闭液(含5% 山羊血清、2% BSA 和0.2%的Triton X-100的PBS 溶液)室温孵育样品30 min。用封闭缓冲液稀释一抗(Myh2、Myh4 和Myh7 抗体以1∶300的比例稀释),4℃孵育过夜。PBS 洗5 次,每次5 min。用PBS 以1∶1 000 的比例稀释二抗,室温孵育50 min 后,PBS 洗5 次,每 次5 min。用mount medium 封片,避免气泡的产生,并用指甲油封盖玻片四周,防封片剂溢出并固定盖坡片。
1.2.5 数据分析 荧光定量数据获得自Bio-Rad CFX Manager 软 件(Bio-Rad,Foster City,CA,USA),导出格式为Excel,使用5 软件对该基因的表达稳定性进行评估。Delta CT 法是根据ΔCT 的标准差的平均值对内参基因进行稳定性排列;geNorm 和NormFinder 的分析均基于基因的相对表达量,即首先计算内参基因的△CT(预评估基因的CT 值减去同一样品中某一基因的最低CT 值),再根据公式2-△CT计算该基因的相对表达量,其中geNorm 分析要求所有内参照基因的M 值均低于1.5,具有最低M 值的基因具有最稳定的表达;NormFinder 方法,稳定性值越小变异系数越小,因此基因的表达稳定性较高;BestKeeper 则根据计算出的标准差(Std)、变异系数(CV)和相关系数(R)判断稳定性,其中R 值越大,Std 越小或者CV 值越小,内参基因的稳定性越好;RefFinder 法是在4 种方法的基础上使用几何平均数算法计算稳定性。
2 结果
2.1 引物特异性的检测及标准曲线的构建
采集小鼠后肢骨骼肌组织(GAS、SOL、TA和EDL)提取总RNA,A260nm/A280nm的比值范围为1.85-2.09,表明RNA 纯度符合PCR 实验要求。对候选内参引物进行荧光PCR 实验,获得扩增及溶解曲线。如图1 所示,溶解曲线均呈现单峰表明设计引物特异性较好。同时以样品浓度的对数为横坐标,CT 值为纵坐标绘制标准曲线,按照E=10-1/Slope-1 计算扩增效率(其中Slope 为标准曲线斜率)。经10 倍稀释得到的9 个基因的标准曲线(表2),其线性关系良好,扩增效率为94.4%-114.5%,R2决定系数为0.982 6-0.994 5,其均符合qPCR 实验对引物的要求。
2.2 内参基因的循环阈值
在4 种骨骼肌中,通过RT-qPCR 分析获得9 个候选内参基因的循环阈值(CT)值(图2)。结果显示,9 个候选内参基因的平均CT 值位于16-26 个循环之间,其中Hprt1循环阈值最高(26.63±0.86),Gapdh最低(16.28±0.36)。
2.3 内参基因在骨骼肌中的表达稳定性的评估
根据9 个候选内参基因在不同部位骨骼肌的 循 环 阈 值,用Delta CT、geNorm、NormFinder、BestKeeper 和RefFinder 五种方法综合评估9 个内参基因表达的稳定性。如表3 和图3 所示,以Delta CT 法 分 析 稳 定 性 前3 个 基 因 为Rpl7>Actb>Rer1,以NormFinder 法分析稳定性前3 个基因为Rpl7>Rer1>Actb,以BestKeeper 法分析稳定性前3 个基因为Rpl7>Gapdh>Actb。尽管geNorm 法分析稳定性前3 个基因为Actb>B2m>Rpl27,但以上3 种方法均得出在不同部位骨骼肌中Rpl7内参基因最稳定。为了综合评价以上分析结果,本实验采用RefFinder法计算上述4 种方法结果序列进行的几何平均数,显示内参基因的稳定性排序为Rpl7>Actb>B2m>Rer1>Rpl27>Gapdh>Sdha>Hprt1>Ppia,且5 种方法中Ppia均为最不稳定的内参基因。
2.4 稳定内参基因在肌纤维类型分型定量的验证
研究表明EDL 和SOL 分别是以快肌和慢肌纤维为主的骨骼肌,同时也是肌纤维类型研究的经典骨骼肌[20],本研究以EDL 和SOL 免疫荧光的肌纤维分型的结果为参照,验证上述筛选稳定内参Rpl7的可靠性。免疫荧光分型结果显示SOL 中主要的肌纤维类型为I 型,所占比例约55%,其次为IIa(图4-A,4-B),而EDL 中主要的肌纤维类型为IIB,所占比例约为60%,IIA 所占的比例较少,仅为10%左右(图4-A,4-C),表明本研究采集样本可靠。同时以最稳定的Rpl7基因及最不稳定的Ppia为内参基因,对Type IIA(Myh2),IIB(Myh4) 和IIX(Myh1) 进行qPCR 定量分析。然后计算免疫荧光及qPCR 检测方法获得IIA,IIB+IIX 肌纤维类型在EDL 和SOL肌肉中的比值,并对这两种分析方法获得的结果进行比较。通过免疫荧光方法检测显示SOL 中IIA 肌纤维类型约为EDL 中的2 倍,以Rpl7为内参基因,qPCR 定量检测SOL/EDL 的比值约为2.2,获得的结果与上述免疫荧光的结果一致,而以Ppia的定量结果显示IIA 肌纤维SOL/EDL 的比值约为1.2 倍(图4-D)。同理,以Rpl7为内参基因,IIB+IIX 肌纤维在EDL/SOL 的比值与免疫荧光一致,而Ppia为内参基因的定量结果与免疫荧光分析方法差异较大(图4-E)。因此,通过上述分析方法获得的稳定内参可靠,可广泛作为骨骼肌纤维类型分型的内参基因。

图1 骨骼肌中9 个管家基因的Real-time PCR 溶解曲线
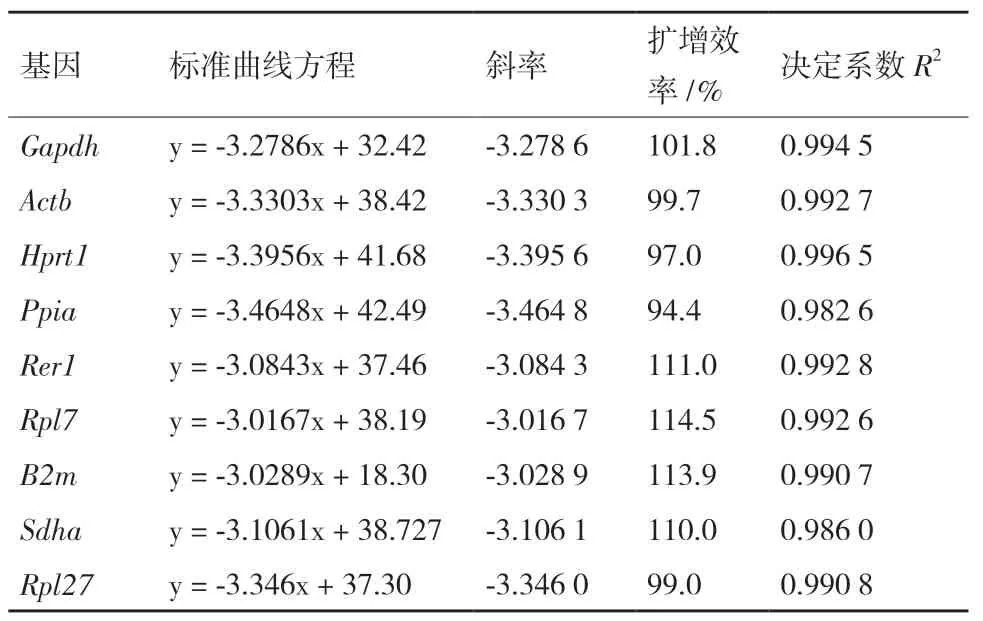
表2 内参基因标准曲线方程、决定系数R2 和扩增效率
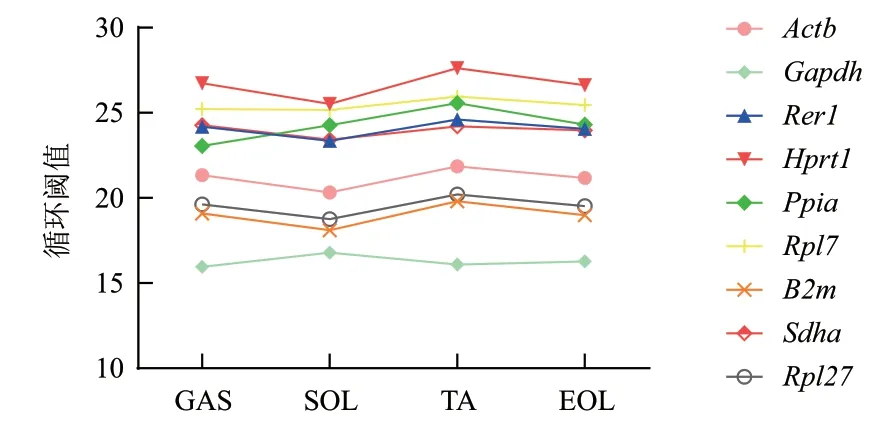
图2 骨骼肌中9 个候选内参基因的循环阈值

表3 九种候选内参基因在小鼠骨骼肌组织中的表达稳定性
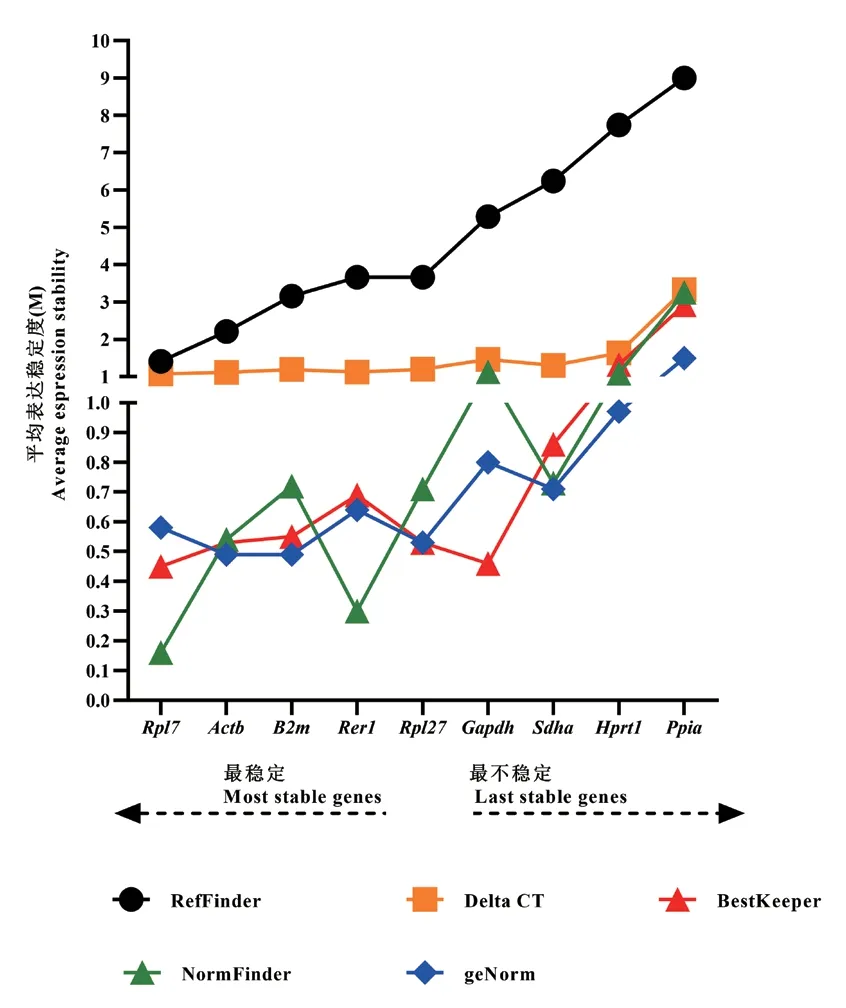
图3 九种候选内参基因在小鼠骨骼肌组织中的表达稳定性
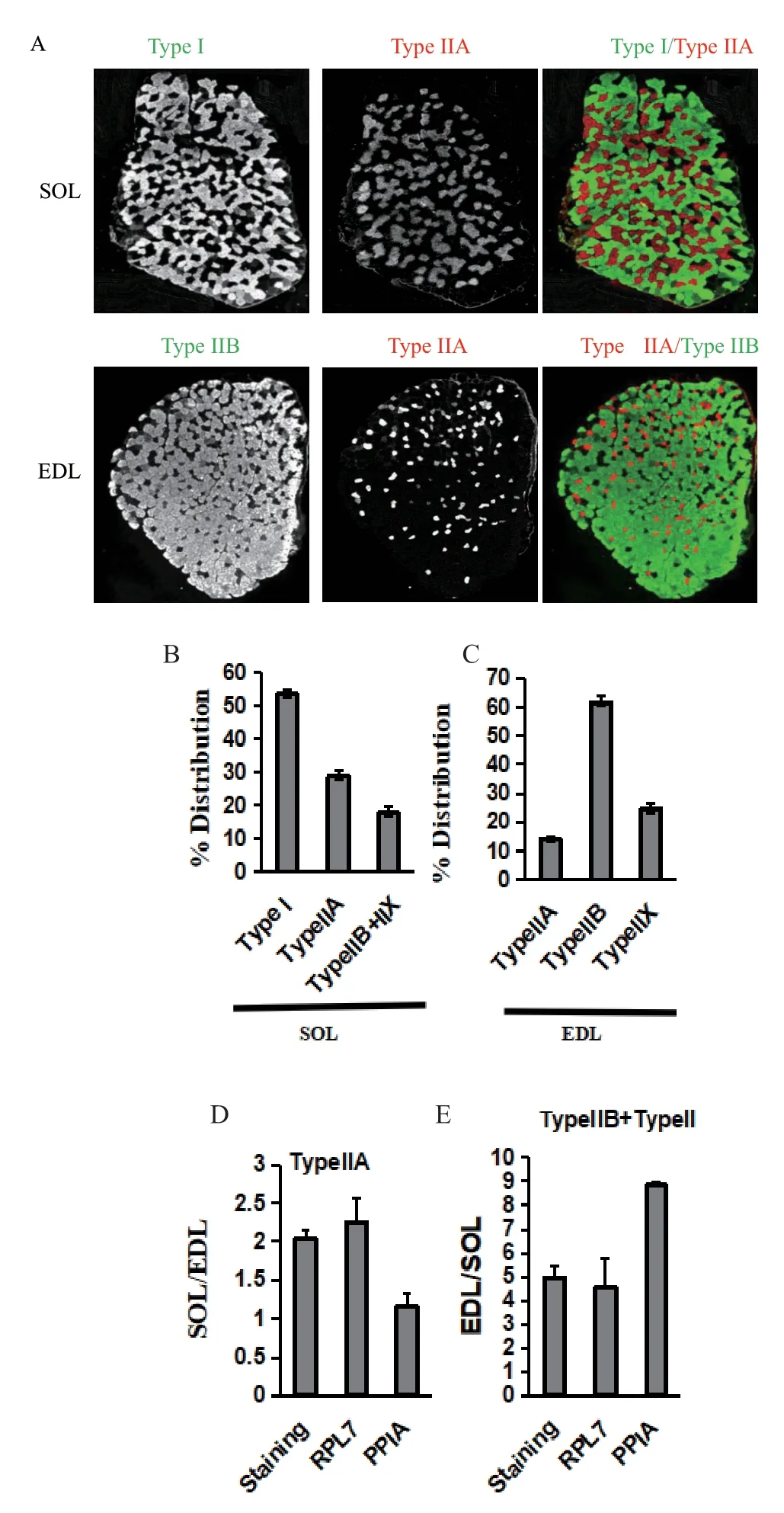
图4 内参基因的稳定性验证
3 讨论
RT-qPCR 是分析基因RNA 相对表达的首选方法[21-22]。即使是对于转录丰度较低的基因它也可以快速、准确地实时分析基因表达模式[23]。而内参基因的选择对其结果的准确性至关重要。目前,研究者多采用Delta CT、geNorm、NormFinder、BestKeeper 中的一种或两种评估稳定地内参基因。其中 Delta CT[24]根据基因表达差异的重复性对内参基因的稳定性进行排名,geNorm[18]根据内参基因之间的平均配对变异V 值确定最稳定的参考基因,并根据其表达稳定性值(M)对基因进行排序。而NormFinder[25]计算所有样本中内参基因表达的总体变化,以及组内和组间的变化,根据内参基因的稳定值(SV)对其进行排序,值越低表示基因表达稳定性越高,反之亦然。BestKeeper[26]则根据内参基因的标准偏差(SD)和变异系数(CV)对内参基因的稳定性进行排名。本研究用上述4 种方法分别评估所测候选内参基因的稳定性,同时采用RefFinder[19]计算每个候选内参基因在上述4 种方法中的几何平均值进行综合排名,提高了内参基因稳定性评估的可靠性。
尽管上述5 种运算原理存在差异,导致内参基因的稳定性排序略有不同[27-28],但本试验采用RefFinder 软件综合分析骨骼肌中较为适合的参考基因为Rpl7,最不稳定的基因为Ppia。Rpl7是一种多功能核糖体蛋白,在翻译控制和转录调控中起作用[29-30]。已有研究报道Rpl7基因是在小鼠股四头肌中稳定表达的内参基因[13]。Ppia是一种肽基脯氨酸异构酶,催化寡肽中脯氨酸亚胺肽键的顺反异构化反应[31]。与本研究结果一致,Gong 等[32]分析12 种内参基因在能量限饲小鼠股四头肌中最不稳定的内参基因是Ppia。并且本研究以免疫荧光检测肌纤维分型的数据为参照,验证了以表达最稳定的Rpl7作为内参基因,采用qPCR 检测肌纤维类型组成的可靠性,表明Rpl7可广泛的应用于qPCR 检测骨骼肌肌纤维分型的内参基因。
近年来,研究者在不同实验条件下对某一特定部位骨骼肌的内参基因进行了筛选,这些特定部位的骨骼肌主要集中在股四头肌和腓肠肌。研究表明高脂和高糖饲养小鼠腓肠肌稳定的内参基因为Actb>Ywhaz9(色氨酸5-单加氧酶激活蛋白)>Gapdh[33]。能量限制小鼠内参基因在股四头肌中稳定性位于前三的为Gapdh>Hprt>Tubα(微管蛋白α)[32]。然而,在不同饲料硒水平饲养股四头肌中Ppia和B2m较为稳定[34]。已有研究报道不同部位骨骼肌,快慢肌纤维类型差异较大[35]。本研究选取EDL、SOL、TA 和GAS 四个部位的肌肉,其中EDL主要由快肌纤维组成,而SOL 主要由慢肌纤维组成,分别是机体内典型的快骨骼肌和慢骨骼肌,因此用这些样品筛选肌纤维类型分型的稳定内参基因,更具有代表性。并且本研究所筛选的稳定内参基因可用于不同部位骨骼肌的基因表达比较分析,但是否能适用于其他组织,需要进一步的研究。
4 结论
本研究通过9 个常见内参基因首次分析在快肌和慢肌纤维为主的骨骼肌的表达稳定性,结果表明,Rpl7表达最稳定,Ppia最不稳定。Rpl7可作为出生后小鼠骨骼肌纤维类型检测的稳定内参基因。

