骆马湖水体中药品及个人护理品的污染特征及风险评估
陈 宇, 王涌涛, 黄天寅, 陈书琴, 庞 燕
1.苏州科技大学环境科学与工程学院, 江苏 苏州 215009 2.中国环境科学研究院, 湖泊水污染治理与生态修复技术国家工程实验室, 国家环境保护湖泊污染控制重点实验室, 北京 100012 3.安庆师范大学资源环境学院, 安徽 安庆 246133
PPCPs(pharmaceuticals and personal care products, 药品及个人护理用品)主要由两部分组成,其中药品包括抗生素、激素、止痛药、消炎药、血脂调节剂、β受体阻滞剂及其他抑制细胞生长的药物;个人护理用品包括肥皂、洗发水、护发素、牙膏、护肤产品、防晒霜、驱蚊剂、乳液和香水中的化学物质[1-2]. 随着医药行业的持续发展和个人防护需求的快速增长,该类物质大量进入环境并在各类水体中被广泛检出. Loos等[3]在2009年检测了欧洲一百多条河流,发现90%的河流受到了不同程度的PPCPs污染. 2012年Verlicchi等[4]调查分析后发现医院污水是该城市污水厂PPCPs污染的主要来源,其污染种类以抗生素、受体拮抗剂和脂质调节剂为主. Blair等[5]指出,密歇根湖水体中14种PPCPs的污染已经达到了中级或高级生态风险. 水体中过量的PPCPs不仅会抑制浮游生物生长[6],而且能够降低微生物活性并改变微生物群落结构[7]. 已有试验表明,PPCPs不仅对鲫鱼的新陈代谢及基因组存在危害[8],还可以通过饮水、用水途径与人体密切接触,干扰人体内分泌系统. 因此,水体中PPCPs污染危害已亟待解决[9].
我国作为世界药物生产和使用大国,药物产量占世界总产量的20%以上,每年生产的药物活性成分超过 1 500 种;同时,我国的PCPs消耗量世界排名第三,占全球消耗量的6.5%,仅次于美国(19.1%)和日本(9.4%)[10]. 尽管PPCPs污染持久性低,但全球每天都在进行着大量的生产、使用,这种假持久性[11]的污染危害早已不容忽视. 我国PPCPs的相关研究起步相对较晚,但也进行了许多有意义的探索. 例如WANG等[12]研究发现东洞庭湖PPCPs污染程度大于西洞庭湖,且水体中的克拉霉素(CAM)已对水生生物构成重大威胁;DING等[13]在不同季节对鄱阳湖表层水中的目标抗生素进行监测,发现鄱阳湖抗生素污染程度中等偏低,大多数抗生素的生态风险处于低水平;YU等[8]调查大龙湖水体中PPCPs时发现医院附近污染程度最高,并建议对磺胺甲恶唑(SMX)进行监管以降低其生态风险. 骆马湖作为全国第七大淡水湖,不仅是徐州、宿迁两市的饮用水源地,还是南水北调东线工程的关键节点[14-15]. 该水体中有关PPCPs的最新研究为2016年[16],自2017年始,骆马湖开展了一系列生态环境保护工程,PPCPs源汇关系及赋存特征均发生了较大变化,但相关后续研究尚未见报道. 为保证南水北调及徐州、宿迁两市饮水安全,对骆马湖水体新型污染物开展前瞻性研究显得尤为必要和迫切. 该文以骆马湖为研究对象,采用高效液相色谱串联质谱(HPLC-MS/MS)法,测定骆马湖表层水体中61种PPCPs的浓度水平,评估其生态风险,并对典型PPCPs来源进行探究,以期全面阐释骆马湖表层水中PPCPs的污染特征,为骆马湖的水生态环境保护和风险防控提供科学依据.
1 材料与方法
1.1 研究区域概况
骆马湖(34°00′N~34°11′N、118°04′E~118°18′E)位于江苏省境内,跨徐州、宿迁二市,为江苏省四大淡水湖之一,其来水主要由沂河、老沂河及中运河汇集,出水经新沂河、六塘河及京杭大运河流出. 骆马湖最大湖长27.0 km,最大湖宽20.0 km,湖水面积260.0 km2(水位为23.0 m),湖体容积约9.2×108m3,平均水深4.4 m,最大水深16.2 m. 骆马湖渔业养殖分布广泛,一定程度上导致了其生态系统的破坏及水质恶化. 2017年6月,为保护骆马湖生态环境,当地政府部门开始针对湖区养殖进行优化裁汰,但目前骆马湖北部区域的养殖密度仍较大,湖泊总体处于中度污染状态[17-18].
1.2 样品采集和前处理方法
2019年12月,根据网格法在骆马湖区域设置32个点位,并在两方鱼塘(Y1、Y2)、两方蟹塘(X1、X2)内增置点位,采样点设置如图1所示. 此次共采集44个样品(含4个平行以及4个鱼、蟹饲料样品),对其分别进行检测分析. 水样的采集和保存按照GB/T 12999—1999《水质采样 样品保存和管理技术规定》,采集位置在水面以下0.5 m处,将水样密闭保存于棕色玻璃瓶中,在0~4 ℃冷藏条件下运往实验室,采集后24 h内进行预处理操作.
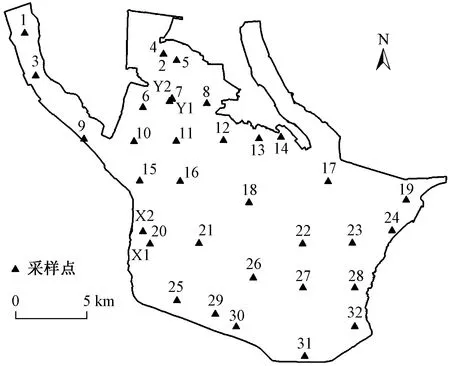
图1 骆马湖采样点示意Fig.1 Sampling sites in Luoma Lake
水样预处理步骤如下:①将1 L水样经47 mm玻璃纤维滤纸过滤,加入500 mg乙二胺四乙酸二钠、25 mg抗坏血酸,用盐酸调节pH至4~5. ②加入25 ng的提取内标液,混合均匀并老化30 min. ③固相萃取前,依次以10 mL甲醇、10 mL高纯水、10 mL高纯水(pH为4~5)活化、平衡HLB固相萃取柱,后将含有内标的水样以5~10 mL/min的流速通过固相萃取柱. ④水样萃取完毕后以10 mL高纯水淋洗,并在真空下抽干2 h除去水分,然后以8 mL甲醇洗脱. ⑤将洗脱液收集于10 mL离心管中,在水浴条件(温度35 ℃)下氮吹至干. ⑥最后用含0.025%甲酸的甲醇水溶液定容500 μL,加入25 ng进样内标液后置于涡旋振荡器中混合均匀. ⑦溶液经0.22 μm滤膜过滤,移入自动进样样品瓶中,4 ℃下冷藏备用.
常规指标的测定参照《水和废水监测分析方法》(第四版).
1.3 样品测定
采用高效液相色谱仪-串联三重四级杆质谱仪(Agilent 1260-6470,美国)测定水样中PPCPs浓度. 色谱柱为Agilent eclipse plus-C18液相色谱柱(3.5 μm×150 mm×2.1 mm),流动相分别为含0.05%甲酸的高纯水(流动相A)、甲醇(流动相B). 梯度洗脱,洗脱程序:0~15 min,5%B线性增至95%B,保留4 min,然后瞬间降至5%B,平衡11 min. 流速为0.4 mL/min,柱温为20 ℃,进样体积为5 μL. 采用喷雾电离源(Electrospray ionization, ESI)、多反应监测(Multiple reaction monitoring, MRM)模式检测. 鞘气温度为350 ℃,鞘气流量为7.0 L/min,干燥气温度为300 ℃,干燥气流量为7.0 L/min,高纯氮气压力为0.15~0.2 MPa.
1.4 数据分析方法
采用Excel 2010和SPSS 24软件进行水质数据的统计分析;利用ArcGIS 10.5软件选择克里金插值法绘制骆马湖表层水中PPCPs空间分布图.
1.5 风险评估方法
评估水体中PPCPs的潜在风险不仅需要浓度检测,还应考虑生态风险表征,即对暴露于各种应激下的有害生态效应的综合判断及表达[19]. 采用的风险表征方法为美国食品药品监督管理局(US FDA)和欧洲药品评估机构引入的药品环境风险评估指南(ERA)[20]. 若RQ>1,表示处于高风险;RQ在0.1~1之间,表示处于中风险;RQ<0.1,则表示处于低风险. 风险熵(RQ)计算公式:
(1)
式中:MEC为环境浓度,ng/L;PNEC为预计无效应浓度,ng/L.
鉴于部分抗生素急/慢性毒性数据难以从文献及数据库中查找到,使用美国环境保护局(US EPA)的ECOSAR软件根据转化产物结构进行估算.
2 结果与讨论
2.1 骆马湖表层水体中PPCPs组成及其浓度
由表1可知,骆马湖表层水体中61种PPCPs共检出15种. 其中人用PPCPs占比为46.67%,包括卡马西平(CBZ)、舒必利(SP)、咖啡因(CF)、诺氟沙星(NOR)、罗红霉素(RXM)、克林霉素(CDM)、对乙酰氨基酚(ATP);兽用PPCPs占比为26.67%,包括避蚊胺(DEET)、恩诺沙星(ENR)、氟苯尼考(FF)、泰妙菌素(TIA);人、兽共用PPCPs占比为26.67%,包括甲氧苄啶(TP)、磺胺嘧啶(SD)、林可霉素(LCM)、甲砜霉素(TAP).
由表1也可以看出,骆马湖表层水体中不同PPCPs赋存浓度差异明显,检出范围介于2.67~6 514.91 ng/L之间. DEET、TAP与FF平均值最高,分别为162.87、61.33及56.72 ng/L. DEET、CBZ、SP、CF与LCM的检出率达100%,除DEET外,剩下4种均可人用;FF、TAP、CDM的检出率超80%;NOR、ATP检出率较低,均低于10%,其他剩余PPCPs检出率介于12.5%~52.5%之间. 类型分析结果显示,抗生素占比为66.67%,构成主要污染;根据用途分析,人用PPCPs占比为46.67%,与徐州大龙湖[8]人用占比(61.54%)相比,骆马湖该类污染处于较低水平. 虽然相关部门已对骆马湖湖区养殖开展整改行动,但骆马湖北部区域仍存在大面积、高密度的养殖活动,另经环湖污染源调查发现北部湖岸有多处畜牧群游荡. 水产、畜牧养殖作为水环境中PPCPs的重要来源,将进一步造成骆马湖水体中PPCPs种类的增加及赋存浓度的升高,形成持续污染.

表1 骆马湖表层水中PPCPs浓度水平Table 1 PPCPs concentrations in surface water of Luoma Lake
骆马湖中DEET浓度的平均值是太湖[19]的30倍. DEET主要用于灭蚊,对一些鱼类及浮游植物具有轻微毒性,在水体中人为添加的可能性较低. 因此,骆马湖水体中DEET浓度高的原因值得深入探讨. 骆马湖中CF浓度的平均值是太湖[19]的2倍,作为一种中枢兴奋剂,CF在精神药品、饮品及巧克力中被普遍应用,往往因人们的不合理处置被暴露在环境中并汇集于水体. NOR是一种常见的用于治疗肠炎痢疾的抗菌药,根据农业部第2292号公告,自2016年12月31日起停止将NOR的各种盐、酯及其制剂用于食品动物. 目前骆马湖水体中NOR的浓度是巢湖[21]的2倍,其污染水平与下游洪泽湖[22]相当,但远高于上游南四湖[23]. 调查显示,骆马湖中NOR、ENR、SD和RXM的浓度均远高于上游南四湖[23]. 由此可见,骆马湖及其至上游南四湖的河道周围不仅存在新的污染源,而且已导致了较为严重的污染. 因此加强该段河流及骆马湖的污染治理至关重要,这将会是减少下游流域中PPCPs污染的有效措施.
与张芹等[16]2016年的调查结果相比,骆马湖中NOR浓度变化显著,从256.00~707.00 ng/L降至0~194.14 ng/L. 同时检出种类呈现增多趋势,2016年RXM、TP及CBZ均无检出,2019年其浓度范围分别为0~893.06、0~9.75、1.41~8.54 ng/L. 显然,骆马湖表层水中的PPCPs在近年有所变化,且污染情况更为复杂化.
2.2 骆马湖水体中PPCPs空间分布特征
骆马湖PPCPs的整体分布趋势为北高南低、西高东低(见图2),与张芹等[16]的研究结果略有差异. 人、兽共用PPCPs浓度变化趋势最为明显,北部(含沂河、老沂河、中运河三处入湖口)浓度远高于南部,这可能是河流输送导致. 骆马湖水质易受上游来水影响,这与张庆吉等[24]研究结果一致. 湖区西南部的人、兽共用PPCPs浓度相对较高,考虑到该处有饮用水源地取水口,污染情况应引起相关部门警觉.
人用PPCPs污染呈西北部高于中部和南部的特征,浓度分界线西起中运河,东至沂河,横穿大面积围网区域. 2020年4月在骆马湖植物调查中发现,分界线附近长有大量植物. 根据分布特征推断,骆马湖中人用PPCPs主要来自西北部入湖河流,由于水动力特征及人用PPCPs的迁移特点导致其全湖浓度呈均匀分布. 尽管南部及东部出湖口处浓度较低,但其对下游湖泊仍产生了一定影响. 已有[22]研究发现,下游洪泽湖中NOR的浓度与骆马湖相当.
目前骆马湖的水产养殖主要集中在北部,但兽用PPCPs在全湖均匀分布. 这可能是沉积物对ENR、FF具有较强吸附性及化合物本身的迁移特征造成的[25-27]. 另外,此次采样时间为12月份,低水温条件对沉积物的吸附能力具有一定的促进作用[28]. 沉积物的吸附对于降低部分PPCPs的浓度颇有成效,但是经水流冲刷后,沉积物中赋存的PPCPs也可能再次释放从而导致二次污染[29]. 因此只有从源头降低污染浓度,减少污染途径方是根本解决之道.
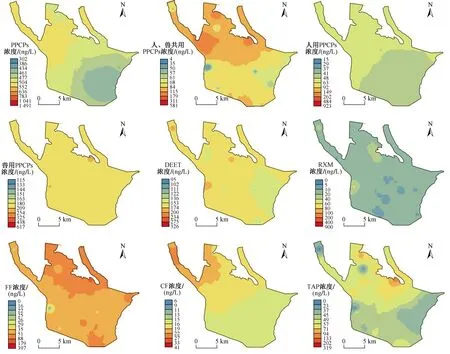
图2 骆马湖表层水中PPCPs浓度空间分布Fig.2 Spatial distribution of PPCPs concentrations in surface water of Luoma Lake
骆马湖水体中DEET的浓度高出太湖[19]30倍,且其在全湖范围内均有检出. 研究表明,鱼、蟹两种饲料中DEET浓度分别为31.74、25.15 ng/g,这与DEET主要来源于避蚊剂的认识[29]存在较大出入. DEET降解速度较快[30],残留饲料和鱼蟹代谢产物缓慢释放可能是骆马湖水体中DEET保持高浓度的主要原因. 2013年,骆马湖的人工养殖面积超过 3 100 hm2,后虽进行了围网拆除工作,但北部仍存大面积围塘、围网养殖. 此外,护理品也是DEET的重要来源. 骆马湖东南岸建有湖滨公园、沙滩公园,北部设有窑湾古镇,高密度人流必然提高护理品在水体中的赋存浓度. 杀虫剂中有效成分即为DEET,北部大量分布的小面积块状农田也为杀虫剂的使用创造了条件.
RXM在X2、Y2处检出浓度最高,分别为893.06、193.45 ng/L,两处均位于北部围塘养殖区域. FF的浓度在老沂河、沂河之间的东北部养殖地带呈更高态势. CF在中运河、老沂河的入湖口处浓度较高,这可能是上游输入性污染所致. TAP全湖分布北高南低,在沂河入口北部存在高浓度污染区域.
2.3 风险评估
运用风险熵评估方法,将PPCPs浓度的最大值作为MEC,不同文献中的毒理数据作为PNEC对骆马湖表层水进行PPCPs风险评估,结果如表2所示. 由表2可知,CBZ、CF存在高风险,ENR、NOR、SD、RXM及LCM存在较高风险. 其中CBZ、CF、NOR、RXM为人用PPCPs,占比为57.14%,兽用PPCPs仅有ENR. 由此可见,骆马湖中PPCPs风险主要来源为人用药物及护理品. PPCPs对水环境造成的风险情况不仅取决于水体的理化性质,还与自身的化学特性有关. 其中,CBZ因光降解速度缓慢导致其在水体中积累形成高风险;CF在水体中的吸附、挥发及沉淀效果均不明显,这些特性都将促使风险程度的提高[40];具有较高风险的SD、LCM与其在水生环境中的高稳定性、普遍存在性息息相关[13]. 由于风险熵所用物种毒性数据有限,存在不确定性,应加强长、短期毒理数据的研究和获取,完善评估依据.
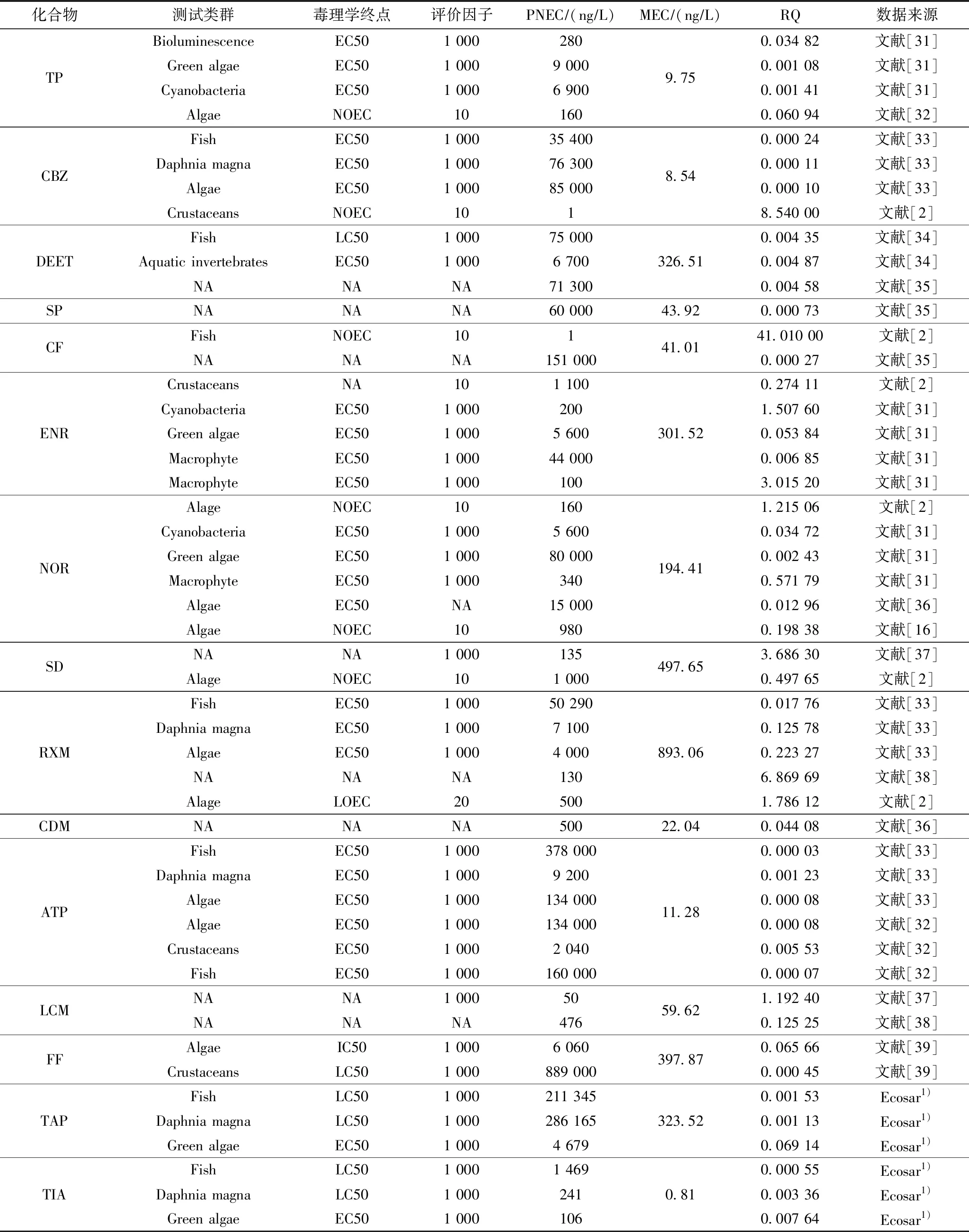
表2 骆马湖表层水体中PPCPs风险评估Table 2 Risk assessment of PPCPs in surface water of Luoma Lake
与张芹等[16]2016年对骆马湖进行的风险评估相比,NOR对鱼腥藻的危害有轻微下降趋势,但共同的是在所有面临风险的生物体中藻类的脆弱性仍最高[41-42],这与白洋淀[11]、巢湖[21]及长江中下游浅水湖泊[43]情况类似. 水环境中的PPCPs往往不只一种,很可能形成混合毒性,对藻类及其他水生生物造成更大危害.
3 结论
a) 针对骆马湖进行的61种PPCPs检测中,共检出15种,包括人用7种,人、兽共用4种,兽用4种. DEET、CBZ、SP、CF及LCM检出率为100%,除了DEET外其余4种均可人用. DEET、TAP及FF为平均值最高的三类,DEET浓度是太湖的30倍.
b) 骆马湖表层水体中全部检出PPCPs的空间分布特征为北高南低、西高东低. 人、兽共用PPCPs浓度自北向南逐渐递减,人用PPCPs在北部呈更高态势,兽用PPCPs在全湖分布均匀.
c) 运用风险熵进行生态风险评估,CBZ、CF呈高风险,ENR、NOR、SD、RXM及LCM呈较高风险. CBZ、CF、NOR、RXM均为人用PPCPs,占比为57.14%,骆马湖中风险来源主要为人用PPCPs.

