CeMn氧化物催化剂的制备及其对甲苯的催化降解性能
杨玉玲,周家斌,张天磊,丁丽丹,刘文博
(西南石油大学 化学化工学院,四川 成都 610500)
挥发性有机物(VOCs)是一类重要的空气污染物,会对生态环境造成一定危害[1-3]。催化燃烧是常用的VOCs处理技术之一,其关键在于催化剂的选择,常用的催化剂主要有贵金属催化剂[4]和非贵金属氧化物催化剂[5],其中最常见的是过渡金属氧化物和稀土氧化物催化剂[6-7]。尽管贵金属催化剂在VOCs催化降解方面效果显著,但因其价格昂贵、易中毒失活,使得该类催化剂无法大规模应用。目前,活性高、价格便宜、来源丰富的非贵金属氧化物材料已成为VOCs催化领域的研究热点[8]。锰氧化物具有良好的氧流动和氧储存能力[9-10],稀土氧化物CeO2表面具有丰富的氧空位[11],它们均展现出较好的低温催化活性。WANG等[12]通过水热法合成了CexMn1-x氧化物,CHEN等[13]通过氧化还原共沉淀法合成了CeMn氧化物,它们均具有很好的催化降解VOCs的性能。
本研究采用草酸沉淀法制备了CeMn氧化物催化剂,通过XRD、SEM、XPS等表征了催化剂的理化性质,探讨了其对甲苯的催化降解性能。
1 实验部分
1.1 材料和试剂
乙酸铈、乙酸锰、乙醇、草酸:均为分析纯。
1.2 催化剂的合成
将适量的乙酸铈和乙酸锰溶解在10 mL乙醇中,于80 ℃强烈搅拌下与草酸溶液(0.24 mol)混合。在80 ℃搅拌反应30 min,离心收集沉淀,用蒸馏水和乙醇洗涤数次,于80 ℃干燥12 h,于450 ℃煅烧3 h。
分别按照n(Ce)∶n(Mn)为1∶0,1∶1,1∶2,1∶3,2∶1,0∶1合成了一系列CeMn氧化物催化剂,分别计作CeO2,Ce1Mn1,Ce1Mn2,Ce1Mn3,Ce2Mn1,MnOx。
1.3 表征方法
采用美国布鲁克公司D8 Advance型单晶X射线衍射仪(XRD)对催化剂表面晶体结构进行分析;采用日本电子株式会社的JEM-7500F型场发射扫描电子显微镜(SEM)附加X-maxN80型能谱仪表征催化剂的形貌;采用美国赛默飞世尔公司ESCALAB 250 Xi型X射线光电子能谱仪(XPS)分析催化剂的元素价态;采用湖南华思仪器有限公司DAS-7000型高性能动态吸附仪进行H2-TPR表征。
1.4 催化剂性能评价
催化剂性能评价在固定床反应器中进行。将200 mg粒径为40~60目筛下物的催化剂置于内径2 cm石英管的中间位置,两端堵上石英棉,通入空速6 000 h-1、质量分数1×10-3的甲苯气体,在150~400 ℃条件下评价催化剂的催化效果。通过装有 FID 和 TCD检测器的气相色谱仪(GC-2014型,岛津公司)检测反应器进出口的甲苯质量浓度,计算甲苯转化率(η,%)。
2 结果与讨论
2.1 催化剂表征结果
2.1.1 XRD
CeMn氧化物的XRD谱图见图1。由图1可见:纯CeO2的XRD谱图中(JCPDS 04—0593),在28.55°、33.08°、47.49°和56.33°处均出现了衍射峰,表明存在立方萤石结构;纯MnOx的XRD谱图中呈现多种价态的锰氧化物,分别为Mn3O4(JCPDS 01—1127)和Mn2O3(JCPDS 06—0540)混合物的衍射峰;随着Mn含量的增加,2θ=47.49°处CeO2衍射峰的强度逐渐减小,表明Mn的加入可使CeO2的分散性提高,2θ=33.08°处衍射峰的强度逐渐增大,因为CeO2的晶格中进入了部分Mn3+,形成了CeMn固溶体,使CeO2出现不对称结构[14],致使CeO2衍射峰强度增大。
Mn进入CeO2后虽然改变了衍射峰强度,但4个主峰仍然存在,说明CeMn氧化物依旧表现出立方萤石结构。由于Mn2+和Mn3+的离子半径均小于Ce4+,小离子半径的Mn渗入到CeO2内部后,取代了部分Ce4+形成CeMn固溶体,会使其比纯CeO2的晶格更小,更容易形成晶格缺陷,从而产生了氧化物特征衍射峰变宽或略微向更高的2θ偏移的现象。同时,CeMn氧化物中由于Ce4+被Mn2+或Mn3+取代,为了使催化剂内部达到电荷平衡,更容易形成氧空位,从而提高了催化剂的活性。

图1 CeMn氧化物的XRD谱图
2.1.2 SEM
MnOx、CeO2、Ce1Mn2和 Ce1Mn3的SEM照片见图2。由图2a可见,MnOx为椭圆形的微球,表面存在凹凸不平的球状凸起,同时部分球体存在缺口,形成中空结构,使得表面积增大。由图2b可见,CeO2是由许多薄片重叠组成的片状结构。由图2c和图2d可见,随着Mn含量的增加,球状的MnOx空壳打开,变成片状小颗粒黏附在片状CeO2表面,同时部分MnOx逐渐嵌入片状CeO2内部,使得原本光滑的CeO2表面形成清晰可见的纹路。

图2 MnOx(a)、CeO2(b)、Ce1Mn2(c)和Ce1Mn3(d)的SEM照片
2.1.3 XPS
CeMn氧化物的Ce 3d、Mn 2p和O 1s的XPS谱图见图3。由图3a可知,样品表面同时存在Ce3+和Ce4+,其中U0(882.5 eV)、U1(889.1 eV)、U2(898.5 eV)、U"0(901.1 eV)、U"1(907.6 eV)、U"2(916.8 eV)均为Ce4+的峰,而V1和V"1为Ce3+的峰。由峰位判断出样品中Ce4+为主要价态,Ce3+容易产生不均衡电荷,使催化剂表面吸附氧物种增加,Ce3+的存在表明CeO2中存在氧空位,有利于活性氧物种的迁移[15]。从图3a还可以看出,随着Mn含量的增加,Ce3+的峰面积占比增加,表明CeMn氧化物表面氧空位浓度增加,同时形成的氧空位加速了氧物种在催化剂内部及表面的流动传输,提高了CeMn氧化物催化剂的活性。
由图3b可知,CeMn氧化物的Mn 2pXPS光谱图存在2种类型的峰,分别是Mn 2p3/2和Mn 2p1/2。将Mn 2p3/2特征峰分解为两个峰,在结合能为645.8 eV处出现的Mn 2p3/2的峰与报道的Mn3+的值相吻合[16];在结合能为642.0eV处Mn 2p3/2的峰归属于Mn2+[17]。XPS谱图中并没有观察到Mn4+物种的峰,可认为催化剂表面主要的Mn氧化物为Mn2O3和Mn3O4,这与XRD结果一致。此外,与纯MnOx相比,CeMn氧化物的Mn 2p3/2峰向更低的结合能偏移,这可能是CeO2与MnOx相互作用的结果。
由图3c可知,CeMn氧化物的O1sXPS光谱可拟合为两个峰:晶格氧(O2-,表示为Oα)结合能为529.3~530.0 eV,对应于CeO2和MnOx[18];高结合能区(531.3~531.8 eV)处的化学吸附态的氧(表示为Oβ)归因于表面的缺陷氧化物或氧物种[19]。与纯CeO2相比,随着Mn含量的增加,CeMn氧化物中晶格氧对应峰的结合能逐渐增高(从529.3 eV到530.0 eV),这表明氧的环境随着Mn含量的增加而变化,这一现象也归因于CeO2和MnOx之间的相互作用,CeMn氧化物的协同作用增强了晶格氧物种的流动性和可用性[11]。从图3c可以看出,Ce1Mn3的Oβ峰面积均大于CeO2、MnOx、Ce1Mn1和Ce1Mn2的Oβ峰面积,表明Mn含量的增加使催化剂中化学吸附态的氧比例明显升高。在催化反应中,CeMn复合催化剂具有氧化还原循环机制[20],在催化降解甲苯的过程中消耗活性氧物种,部分晶格氧(O2-)活化流动至CeMn氧化物的表面氧空位上,并形成分子吸附氧(O2-)或原子吸附氧(O-)。催化降解反应进行时,由于内部氧的消耗,使得催化剂表面气流压力减小,空气中O2被催化剂吸附到氧空位上活化形成吸附氧,形成氧循环。
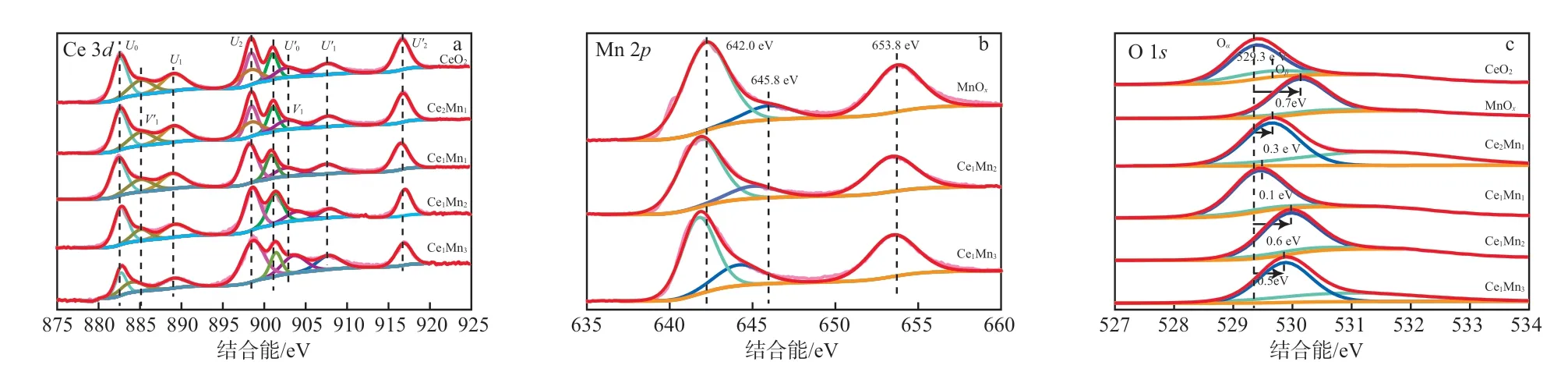
图3 CeMn氧化物的XPS谱图
2.1.4 H2-TPR
CeMn氧化物的H2-TPR谱图见图4。
由图4可见:纯CeO2出现两个还原峰,低温峰479 ℃是体表向Ce2O3的还原,高温峰823 ℃则归属于体相CeO2的还原;纯MnOx分别在304 ℃和428 ℃出现两个还原峰,低温峰和高温峰面积之比约为1∶2.14。TANG等[21]研究表明,Mn2O3经过两步还原,低温峰代表Mn2O3还原为Mn3O4,高温峰代表Mn3O4进一步还原为MnO,反应见式(1)和式(2)。
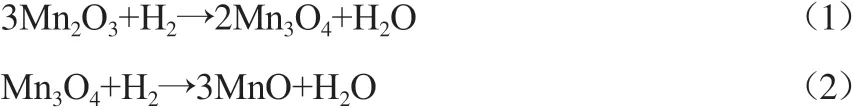
由式(1)和式(2)可知,理论氢耗比为1∶2,小于实际数据(1∶2.14)。CeMn氧化物的H2-TPR曲线在较低温度下由3个重叠峰组成,在较高温度下有1个峰。根据纯MnOx和CeO2的还原特性,可以推断,Mn2O3的两步还原反应形成较低的温度峰,750~830℃之间的峰归因于块状CeO2中的氧物种,较低温度(263℃和265℃)下的另一个峰可能是由于Mn2+/Mn3+与Ce4+之间的协同作用引起的,这与CeO2-MnOx固溶体有关,它可以促进CeMn氧化物中氧物种的迁移,因此,它们对甲苯的催化活性高于纯CeO2和MnOx。此外,Ce1Mn3在该温度段没有明显的峰是因为被其他峰所覆盖,CeMn之间的协同作用使得Ce1Mn3的第一个还原峰向低温区移动,使得还原温度更低,故Ce1Mn3降解甲苯的活性最高。
2.2 CeMn氧化物催化降解甲苯的性能
在空速为6 000 h-1、甲苯质量分数为1×10-3的条件下,CeMn氧化物催化降解甲苯的性能见图5。由图5可知,CeMn氧化物降解甲苯的活性大小顺序为:Ce1Mn3> Ce1Mn2> Ce1Mn1>MnOx> Ce2Mn1>CeO2。CeMn氧化物降解甲苯的T50和T90见表1。
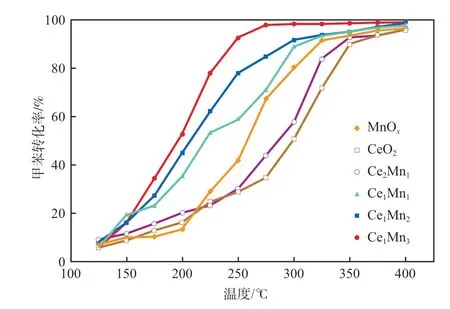
图5 CeMn氧化物催化降解甲苯的性能

表1 CeMn氧化物降解甲苯的T50和T90
在甲苯质量分数为1×10-3的条件下,空速对Ce1Mn3催化降解甲苯性能的影响见图6。由图6可见:随着空速的增加,Ce1Mn3催化降解甲苯的性能变差;当空速为6 000 h-1时,T50=198 ℃,T90=249℃;当空速为9 000 h-1时,T50=200 ℃,T90=252℃;当空速为12 000 h-1时,T50=225 ℃,T90=298℃。因为当甲苯气流快速通过催化剂时,气流在催化剂表面的停留时间太短,甲苯没有进入催化剂孔道内部,导致催化活性降低。
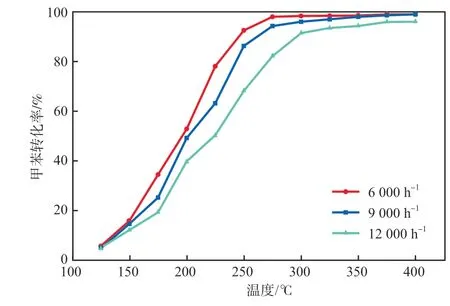
图6 空速对Ce1Mn3催化降解甲苯性能的影响
在甲苯质量分数为1×10-3、空速为6 000 h-1条件下,将Ce1Mn3在249 ℃下连续反应20 h,甲苯转化率变化不大,表明Ce1Mn3催化剂具有较好的活性稳定性。
3 结论
a)采用草酸沉淀法制备了CeMn氧化物催化剂,当n(Ce)∶n(Mn)=1∶3时得到的Ce1Mn3催化剂降解甲苯的活性最佳,T50=198℃,T90=249℃,且Ce1Mn3催化剂具有较好的活性稳定性。随着空速的增加,Ce1Mn3催化降解甲苯的性能变差。CeMn氧化物降解甲苯的活性大小顺序为:Ce1Mn3>Ce1Mn2> Ce1Mn1>MnOx> Ce2Mn1> CeO2。
b)表征结果显示:CeMn氧化物中Mn氧化物主要以Mn2O3和Mn3O4的形式存在,Mn物种进入CeO2晶格后催化剂仍保持立方萤石结构;CeMn氧化物形成的CeMn固溶体比纯CeO2和MnOx表面氧空位浓度增加,有利于将更多的氧分子转化为表面吸附氧物种,加快氧物种在催化剂内部及表面的流动传输,提高降解甲苯的活性;CeMn氧化物之间的协同作用使催化剂的还原峰向低温方向偏移,表明CeMn氧化物展现出更优异的低温活性。

