中耳胆脂瘤中P-Akt和Foxo3的表达及其和凋亡的关系
刘东亮 马秀岚
中国医科大学附属盛京医院耳鼻咽喉科耳科病房(沈阳 110004)
中耳胆脂瘤(middle ear cholesteatoma)是耳科常见疾病,它是一种位于鼓室乳突的囊性结构,随着囊袋中角化上皮不断脱落堆积而逐渐扩大,累及破坏相邻组织结构。胆脂瘤可分为先天性和后天性,后天性进一步分为后天原发性和后天继发性。后天性胆脂瘤形成机制还未明确,主要有四种假说[1,2]:①鳞状上皮化生学说;②基底细胞增生学说;③上皮迁移学说;④内陷袋学说。虽然存在多种假说,但研究方向比较一致,都集中在细胞增殖和凋亡。叉头框蛋白O(Forkhead boxO,Foxo)是最近比较受关注的一个蛋白家族,它与细胞的增殖和凋亡密切相关[3,4]。Foxo家族主要有四个成员组成,分别是Foxo1、Foxo3、Foxo4 和 Foxo6[5,6],其中Foxo3作为无脊椎动物、小鼠和人类中重要的调节寿命的因子,研究最为广泛。它参与重要生命过程的调控,如细胞的增殖、分化、凋亡以及衰老等[7]。相关研究[8]发现Foxo3可以被多种方式调控,包括磷酸化、乙酰化、泛素化等。笔者前期研究发现Pten/Akt通路对中耳胆脂瘤形成发挥作用[9],而Foxo蛋白是PAkt磷酸化的直接下游信号分子[10]。
本研究将通过免疫荧光及Western blot检测中耳胆脂瘤组织和正常皮肤中Foxo3和DAPI的荧光染色情况、Foxo3与P-Akt(ser473)蛋白表达和相关性,来明确Foxo3可以通过被Akt通路磷酸化,抑制中耳胆脂瘤细胞的凋亡。
1 材料与方法
1.1 临床资料
选取2019年8月-11月中国医科大学附属盛京医院中耳胆脂瘤手术标本30例,术中废弃或不能使用的耳后正常皮肤、皮肤碎块15例作对照组(术前已告知患者同意并签署知情同意书)。胆脂瘤标本分为原发性和继发性2组,分类标准为术前查体为松弛部或紧张部后上形成内陷袋的病例为原发性胆脂瘤组,术前查体为紧张部大穿孔或边缘性穿孔的病例归为继发性胆脂瘤组。同时结合术中观察验证。其中原发组23人,男13人,女10人。年龄35.34±21.67岁。病程8.13±7.58年。继发组7人,男4人,女3人。年龄34.39±19.23岁。病程10.47±6.87年。
1.2 实验方法
1.2.1 免疫荧光实验
冰冻切片复温,晾干,多聚甲醛固定15min,待甲醛完全干后于PBS中在脱色摇床上晃动洗涤3次,每次5min。置于盛满EDTA抗原修复缓冲液(PH8.0)的修复盒中在微波炉中进行抗原修复。低火10min,切勿干片。待完全冷却后将玻片置于PBS中在摇床上晃动洗涤4次,每次5min。甩干后用组化笔在组织周围圈出轮廓以防止抗体流走,甩干PBS,滴加BSA,封闭30min。在切片上滴加PBS按一定比例配好的一抗,切片平放于湿盒内4℃孵育12h。取出玻片置于PBS(PH7.4)中,在脱色摇床上晃动洗涤4次,每次5min。甩干后在圈内滴加二抗覆盖组织,避光室温孵育1h。PBS(PH7.4)洗涤3次,每次5min。稍甩干后在圈内滴加DAPI染液,避光室温孵育10min。再次洗涤甩干后用抗荧光淬灭封片剂封片。切片于荧光显微镜下观察保存图像(DAPI紫外激发波长330-380nm,发射波长420nm,发蓝光;FITC激发波长465-495nm,发射波长515-555 nm,发绿光)并用Image-Pro Plus 6.0图像分析软件进行半定量分析。切片免疫荧光实验结果判读:DAPI染出来的细胞核在紫外的激发下为蓝色,Foxo3阳性表达为绿光。
1.2.2 Western blot免疫印迹实验
⑴细胞总蛋白提取:组织块用冷PBS洗涤2-3次,剪成小块置于匀浆器。加入10倍组织体积本试剂冰上彻底匀浆冰浴30min,期间用移液器反复吹打,确保细胞完全裂解。12000 rpm离心10min,收集上清,即为总蛋白溶液。⑵蛋白浓度测定:BCA法测蛋白浓度。⑶SDS-PAGE电泳:玻璃板对齐后放入夹中卡紧,操作时要使两玻璃对齐,以免漏胶。配制分离胶加入TEMED后立即摇匀灌胶。大约45min后吸水纸将上层水吸干。按前面方法配5%的浓缩胶,加入TEMED后立即摇匀即可灌胶。将剩余空间灌满浓缩胶然后将梳子插入浓缩胶中。加足够的电泳液后上样电泳。将样品加入电泳孔中,电泳。浓缩胶电压75V,分离胶用120V。电泳至溴酚蓝刚跑出即可终止电泳,进行转膜。⑷转膜:准备6张7×9cm的滤纸和一张大小适中的PVDF膜,PVDF膜在使用前要甲醇活化。在加有转移液的盆里放入转膜用的夹子,两块海绵垫,一支玻棒,滤纸和PVDF膜。在垫子上垫海绵、滤纸和剥下的分离胶,将膜盖于胶上,并除气泡。在膜上盖三张滤纸并除去气泡。最后盖上另一个海绵垫。25 V恒压转膜过夜。⑸免疫反应:将转好的膜于室温下脱色摇床上用5%的脱脂牛奶(0.5% TBST配),封闭1h。稀释一抗(TBST溶解的5%脱脂牛奶,磷酸化蛋白使用TBST溶解的5% BSA),4℃孵育抗体3小时。TBST洗三次,每次5min。将二抗用TBST稀释3000倍,室温下孵育30min后,用TBST在室温下脱色摇床上洗三次,每次5min。⑹化学发光:将ECLA和ECLB两种试剂在离心管中等体积混合,将PVDF膜的蛋白面朝上与此混合液充分接触,1-2 min后,去尽残液,包好,放入暗匣中曝光。最后用显影、定影试剂进行显影和定影。根据不同的光强度调整曝光条件。⑺凝胶图像分析:将胶片进行扫描存档,PhotoShop整理去色,Alpha软件处理系统分析目标带的光密度值。
1.3 数据分析及统计学处理
应用SPSS 22.0统计软件对数据进行统计学处理,计量资料比较用两样本t检验,运用Pearson检验进行两两的相关性分析,以P<0.05为差异具有统计学意义。
2 结果
2.1 Foxo3和DAPI免疫荧光实验结果(图1)
Foxo3在胆脂瘤和正常皮肤的细胞核和细胞质都有染色,DAPI则染色于细胞核,两者在胆脂瘤的染色亮度明显弱于正常皮肤(图1A);用Image-Pro Plus 6.0图像分析软件进行半定量分析荧光值(图1B),发现Foxo3在中耳胆脂瘤的平均荧光值(27.47±2.35)明显低于正常皮肤(112.89±10.76),两者差异具有统计学意义(t=2.78,P=0.007,P<0.01),但原发性胆脂瘤组和继发性胆脂瘤组的Foxo3平均荧光值分别为27.11±2.51和28.73±2.22,两者无统计学差异;DAPI在中耳胆脂瘤的平均荧光值(13.29±1.57)也低于正常皮肤(79.62±7.67),两者差异具有统计学意义(t=2.08,P=0.03,P<0.05),但原发性胆脂瘤组和继发性胆脂瘤组的DAPI平均荧光值分别为12.91±1.64和14.63±1.52,两者无统计学差异。
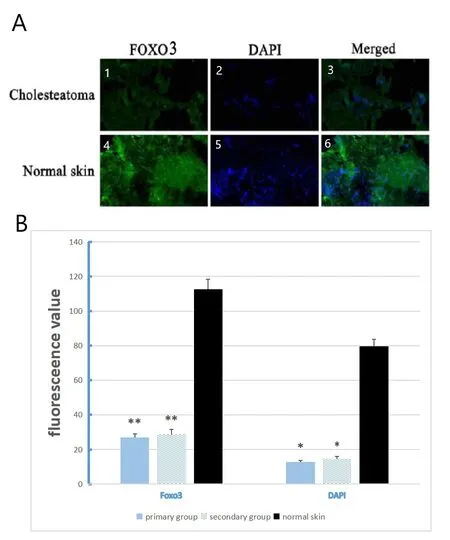
图1 Foxo3与DAPI免疫荧光染色情况:(A1)为Foxo3在胆脂瘤标本染色情况(绿色),着色于细胞核和细胞质,(A2)为DAPI在胆脂瘤标本染色情况,染色于细胞核(蓝色),(A4)为Foxo3在正常皮肤染色情况(绿色),着色于细胞核和细胞质,(A5)为DAPI在正常皮肤的染色情况(蓝色)染色于细胞核,(A3)为(A1)(A2)的融合图,(A6)为(A4)(A5)的融合图。(B)为Foxo3和DAPI在正常皮肤和胆脂瘤中的荧光值分析图,Foxo3在原发性胆脂瘤的平均荧光值27.11±2.51,n=23;Foxo3在继发性胆脂瘤的平均荧光值28.73±2.22,n=7;Foxo3在正常皮肤的平均荧光值112.89±10.76,n=15。Foxo3在胆脂瘤的染色明显弱于正常皮肤(t=2.78,P=0.007),原发组和继发组无统计学差异;DAPI在原发性胆脂瘤的平均荧光值12.91±1.64,n=23;DAPI在继发性胆脂瘤的平均荧光值14.63±1.52,n=7;DAPI在正常皮肤的平均荧光值79.62±7.67,n=15。DAPI在胆脂瘤的染色明显弱于正常皮肤(t=2.08,P=0.03),原发组和继发组无统计学差异。*P<0.05,**P<0.01Fig.1 Foxo3 with DAPI immunofluorescence staining situation:(A1)in cholesteatoma specimens for Foxo3 dyeing conditions(green),coloring in the nucleus and cytoplasm,(A2)for the DAPI in cholesteatoma specimens of dyeing,dyeing in the nucleus(blue),(A4)for Foxo3 in normal skin color(green),coloring in the nucleus and cytoplasm,(A5)as the DAPI in normal skin of dyeing conditions(blue)in the nucleus,(A3)for the integration of(A1)(A2),(A6)figure for the integration of(A4)(A5).(B)was the fluorescence analysis of Foxo3 and DAPI in normal skin and cholesteatoma.The average fluorescence value of Foxo3 in primary cholesteatoma was 27.11±2.51,n=23.The mean fluorescence value of Foxo3 in secondary cholesteatoma was 28.73±2.22,n=7.The average fluorescence value of Foxo3 in normal skin was 112.89±10.76,n=15.Foxo3 staining in cholesteatoma was significantly weaker than that in normal skin(t=2.78,P=0.007).The average fluorescence value of DAPI in primary cholesteatoma was 12.91±1.64,n=23.The mean fluorescence value of DAPI in secondary cholesteatoma was 14.63±1.52,n=7.The average fluorescence value of DAPI in normal skin was 79.62±7.67,n=15.DAPI staining in cholesteatoma was significantly weaker than that in normal skin(t=2.08,P=0.03),and there was no statistical difference between the primary and secondary groups.*P<0.05,**P<0.01
2.2 P-Akt(ser473)和Foxo3免疫印迹western bolt检测结果(图2)
P-Akt(ser473)在中耳胆脂瘤表达明显高于正常皮肤(图2A),两者相对灰度值分别为0.82±0.07和0.32±0.02,差异具有统计学意义(t=2.05,P=0.02,P<0.05)(图2B),但原发性胆脂瘤组和继发性胆脂瘤组的P-Akt(ser473)相对灰度值分别为0.81±0.04和0.83±0.06,两者无统计学差异;Foxo3在胆脂瘤中表达明显低于正常皮肤(图2A),两者相对灰度值分别为0.41±0.04和0.96±0.08,差异具有统计学意义(t=1.94,P=0.04,P<0.05)(图2B),但原发性胆脂瘤组和继发性胆脂瘤组的Foxo3相对灰度值分别为0.41±0.03和0.43±0.05,两者无统计学差异。本实验重复3次。
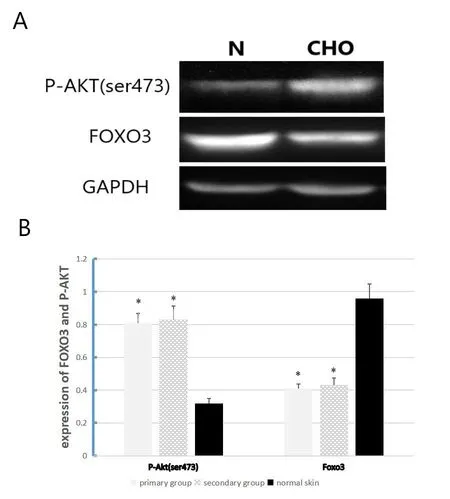
图2 P-Akt(ser473)和Foxo3在胆脂瘤和正常上皮的表达:(A)为Western blot检测P-Akt(ser473)和Foxo3的表达。(B)为P-Akt(ser473)和Foxo3在胆脂瘤和正常皮肤灰度值比较。P-Akt(ser473)在原发性胆脂瘤的相对灰度值为0.81±0.04,n=23;P-Akt(ser473)在继发性胆脂瘤的相对灰度值为0.83±0.06,n=7;P-Akt(ser473)在正常皮肤相对灰度值为 0.32±0.02,n=15。P-Akt(ser473)在中耳胆脂瘤表达明显高于正常皮肤(t=2.05,P=0.02),原发组和继发组无统计学差异;Foxo3在原发性胆脂瘤的相对灰度值为0.41±0.03,n=23;Foxo3在继发性胆脂瘤的相对灰度值为0.43±0.05,n=7;Foxo3在正常皮肤相对灰度值为0.96±0.08,n=15。Foxo3在中耳胆脂瘤表达明显低于正常皮肤(t=1.94,P=0.04),原发组和继发组无统计学差异。*P<0.05,**P<0.01Fig.2 Expression of P-Akt(ser473)and Foxo3 in cholesteatoma and normal epithelium:(A)Western blot detection of PAkt(ser473)and Foxo3.(B)the gray values of P-Akt(ser473)and Foxo3 in cholesteatoma and normal skin were compared.The relative gray value of P-Akt(ser473)in primary cholesteatoma was 0.81±0.04,n=23.The relative gray value of P-Akt(ser473)in secondary holesteatoma was 0.83±0.06,n=7.The relative gray value of p-Akt(ser473)in normal skin was 0.32±0.02,n=15.The expression of P-Akt(ser473)in middle ear cholesteatoma was significantly higher than that in normal skin(t=2.05,P=0.02).The relative gray value of Foxo3 in primary cholesteatoma was 0.41±0.03,n=23.The relative gray value of Foxo3 in secondary cholesteatoma was 0.43±0.05,n=7.The relative gray value of Foxo3 in normal skin is 0.96±0.08,n=15.The expression of Foxo3 in middle ear cholesteatoma was significantly lower than that of normal skin(t=1.94,P=0.04),and there was no statistical difference between the primary and secondary groups.*P<0.05,**P<0.01
2.3 相关性分析
2.3.1 Foxo3和DAPI的相关性分析
通过Pearson检验对Foxo3和DAPI在中耳胆脂瘤中荧光值的相关性分析,发现两者呈显著正相关r=0.451,P<0.01,见表1。
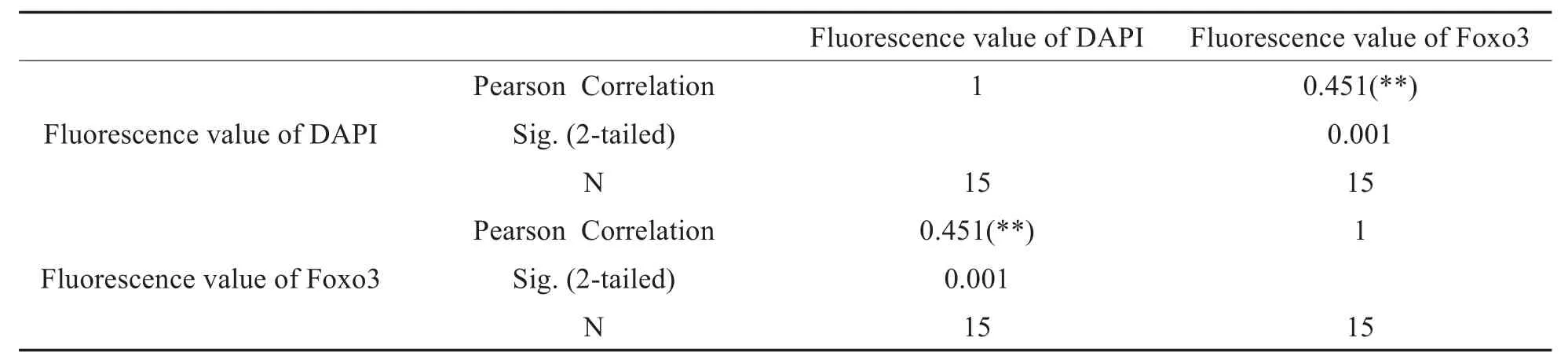
表1 Foxo3和DAPI在中耳胆脂瘤中表达的Pearson相关性分析Table 1 Pearson correlation analysis of Foxo3 and DAPI expression in middle ear cholesteatoma
2.3.2 P-Akt(ser473)和Foxo3的相关性分析
中耳胆脂瘤中P-Akt(ser473)和Foxo3的相关性分析见表2,两者呈显著负相关,r=-0.466,P<0.01。
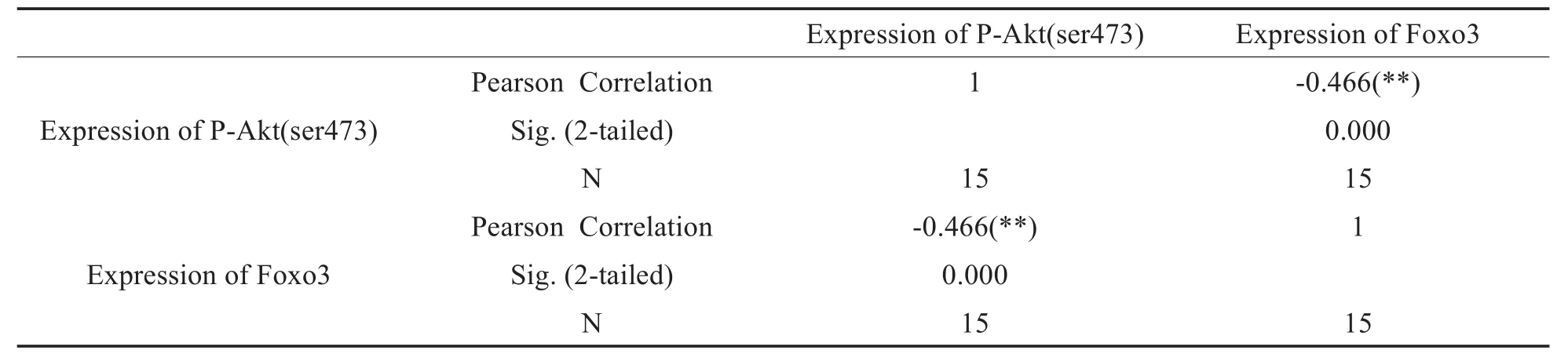
表2 P-Akt(ser473)和Foxo3在中耳胆脂瘤中表达的Pearson相关性分析Table 2 Pearson correlation analysis of p-Akt(ser473)and Foxo3 expression in middle ear cholesteatoma
3 讨论
3.1 Foxo3与凋亡的关系
众多研究表明Foxo3通过其靶基因包括抗氧化基因、细胞凋亡和细胞周期阻滞基因等达到抑制增殖促进凋亡的作用。比如,Foxo3能增加凋亡基因的表达,包括 Bim、FasL、TRAIL、PUMA 等[11-13]。Savkovi C等[14]发现在结肠癌祖/干细胞中有活性的Foxo3a促进TRAIL的表达,从而诱导细胞凋亡;Lv S等[15]发现KMT2D的减少使Foxo3的表达上调,使前列腺癌细胞发生细胞周期阻滞,同时可激活Bim和FasL降低肿瘤活性。本实验结果显示胆脂瘤中Foxo3荧光染色明显弱于正常皮肤。DAPI目前被广泛用于判定细胞凋亡情况[16],DAPI染色于细胞核呈蓝色荧光。正常细胞凋亡核浓缩,荧光显微镜下可见蓝光,大量凋亡表现为核碎裂成大小不等的凋亡小体,荧光显微镜下可见蓝白强光。本实验显示中耳胆脂瘤中DAPI为弱蓝光,所以凋亡明显被抑制,而且与Foxo3的减弱呈显著的正相关,所以说明在中耳胆脂瘤中Foxo3活性降低和细胞凋亡抑制有关。
3.2 Foxo3的亚细胞定位
研究表明Foxo3的促凋亡作用不仅与其含量高低有关,也和它的亚细胞定位密切相关。Corno C等[17]报道,在卵巢癌中FoxomRNA低表达或不表达而在正常卵巢高表达,核质均着色减弱;Hesp K等[18]发现IGF-1通过Foxo蛋白从细胞质转移到细胞核,诱导激活氧化应激、热休克反应等影响许多物种的寿命。正常情况下,Foxo3在细胞核、质均有表达,定位受到多种翻译后修饰的调控,Foxo3被修饰后从细胞核移出进入细胞质,使其不能作用于其靶向基因,丧失了转录因子活性[19],所以定位于细胞核的Foxo3对凋亡起重要作用。结合本试验结果Foxo3定位于胆脂瘤和正常皮肤的细胞核和细胞质,胆脂瘤Foxo3荧光值无论在细胞核或细胞质都明显弱于正常皮肤。所以在中耳胆脂瘤中细胞核Foxo3的减少使其促进凋亡的作用减弱。
3.3 Akt与Foxo3
在此强调,Foxo3不用修饰本身就有生物学活性,而经过修饰的Foxo3则失去了活性。可以对Foxo3进行修饰的方式有磷酸化、乙酰化、泛素化等,具体包括PI3K-Akt信号通路、p38 MAPK(p38 mitogen-activated kinase)、ERK(extracellular-signalregulated kinase)、SGK(serum/glucocorticoid regulatedkinase 1)、IKKβ (IkB kinase β)、AMPK、JNK(c-JunN-terminal kinase)、MST1 等[20]。在这些通路中,PI3K/Akt通路与Foxo3关系最为密切,PI3K/Akt信号传导通路与人类的多种疾病关系密切[21],主要调控方式是通过促进细胞增殖来抗凋亡或者抑制下游的抑癌基因来促进增殖[22]。磷脂酰肌醇3-激酶(phosphoinositide 3-kinases,PI3 K)是一种胞内磷脂酰肌醇激酶,它被激活(Pten最为常见)后会催化PIP2生成3,4,5-三磷酸磷脂酰肌醇(PIP3),PIP3通过与Akt的PH域结合,使Akt从胞质转移到细胞膜,并改变了它的结构使其磷酸化,具体是在丝氨酸473(Serine 473,Ser473)和苏氨酸308(Threonine 308,Thr308)这两个关键点发生磷酸化激活[23]。其中P-Akt丝氨酸473位点是Foxo3磷酸化的特异性位点[24],磷酸化的Foxo3结合细胞核内的结构蛋白14-3-3[10],从细胞核移位到细胞质,而细胞质中的磷酸化Foxo非常容易被泛素化降解[25];相反当Akt途径受到抑制时,大量未被磷酸化的Foxo3留在细胞核并加速细胞凋亡[26]。结合本实验,western blot显示胆脂瘤中P-Akt(ser473)的表达量明显高于正常皮肤,Foxo3的表达量明显低于正常皮肤,且两者的表达呈显著负相关。说明在中耳胆脂瘤中,大量ser473-P-Akt被激活,从而磷酸化Foxo3,导致其进入细胞质而降解,核Foxo3相应减少失去促凋亡作用。
综上所述,本实验表明在中耳胆脂瘤(无论原发性胆脂瘤还是继发性胆脂瘤),ser473-P-Akt表达增多(结合前期的研究[9,27],可能与Pten的减少有关),473位点的激活对于Foxo3的激活是必须,所以增多的ser473-P-Akt去特异性磷酸化Foxo3,磷酸化的Foxo3从细胞核转移到进入细胞质,导致核Foxo3明显减少,而到细胞质的Foxo3又进一步被降解,这与本实验的结果一致,即细胞核与细胞质中Foxo3均减少,这样Foxo3促凋亡的作用明显减弱,与本实验DAPI核染色减弱相一致。所以得出结论,在中耳胆脂瘤的发展过程中,Akt/Foxo3通路起到了抑制凋亡的作用。

