消毒技术在非洲猪瘟防控中的应用现状与问题
王巍, 罗玉子, 张丽, 马吉飞, 仇华吉*
(1.中国农业科学院哈尔滨兽医研究所, 兽医生物技术国家重点实验室, 哈尔滨 150069;2.天津农学院动物科学与动物医学学院, 天津 300384)
非洲猪瘟(African swine fever, ASF)是由非洲猪瘟病毒(ASFV)感染引起猪的一种烈性传染病。目前该病尚无商品化的疫苗和有效的治疗药物[1],已经给全球养猪业造成了巨大的经济损失。ASFV属于虫媒DNA病毒,是非洲猪瘟相关病毒科、非洲猪瘟病毒属的成员[2-4],对环境的抵抗力强,传染源众多且传播途径广泛,严格的生物安全措施是目前防控该病最有效的手段,其中最重要的环节是消毒和检测。
ASF消毒效果不佳是导致疫情未得到有效控制的重要原因。此外,检测技术也是防控ASF的重要手段,由于目前的分子及免疫学检测技术仅能测定样品中是否存在病毒的核酸或抗原,无法确定其感染性,因此也无法对消毒效果进行快速评价。1960年,Malmquist等[5]建立红细胞吸附试验,其原理是感染ASFV的猪外周血单核细胞或组织巨噬细胞能吸附在红细胞表面形成“玫瑰花环”,根据该特性可鉴别具有感染性的ASFV。但该方法耗时、成本高,仅适用于专业实验室进行确诊,不适用于常规、快速检测,也不适用于非血细胞吸附毒株的诊断。本文针对目前ASF的灭活方法进行了总结和分析,同时对快速鉴别感染性及失活的ASFV检测技术探索提出了新见解,以期为该病生物安全防控中消毒剂的正确选择和使用、ASFV消毒效果的快速评价以及现地防控提供参考。
1 ASFV消毒技术简介
目前常见消毒方式主要分成4大类:化学、物理、生物以及环境生态修复法。每种消毒方式的作用机理、适用范围和优缺点等各不相同(表1)。对各类常见消毒方式的原理和特点予以概述,以期为ASFV的灭活提供参考。
1.1 化学消毒剂
化学消毒剂主要包括醛类、卤素类等化学制剂,具有广谱性消毒效果。其中,醛类消毒剂能破坏病毒的囊膜结构,还可与DNA相互作用,干扰蛋白质-DNA交联代谢[6]。这类消毒剂具有潜在的致癌、致突变[7]和致呼吸道过敏反应的风险[8]。卤素类消毒剂包括氯、碘、氟、溴、砹5种元素以及它们与金属离子形成的化合物(盐类)。其主要通过渗透膜并氧化蛋白质,中断氧化磷酸化过程灭活病毒。其性状温和、抗有机物能力很强[8],但稳定性较差。氧化物及过氧化物类消毒剂能氧化包膜蛋白,使病毒包膜通透性增加,内容物外流从而失去活性。其作用时间短且不留残余毒性,但氧化能力易受到温度和酸碱度的影响[9]。酚类及苯酚衍生物能使蛋白质变性和凝固从而引起膜损伤。这类消毒剂性状稳定但具有腐蚀性,其消毒效果易受碱性物质影响[10]。碱类消毒剂属于单组分高效消毒剂。其在水溶液中解离的大量氢氧根离子能溶解ASFV的囊膜结构,其杀灭效果随氢氧根离子的浓度的增加而增强[9]。这类消毒剂极易受潮且安全性较差[10]。季铵化合物类消毒剂按照其结构组成特点可归纳为单链季铵盐、双链季铵盐、聚季铵盐、混合季铵盐4大类。单链季铵盐的烷烃链可与病毒包膜类脂层发生疏水相互作用而插入其中,导致酶失活和蛋白质变性[11]。双链季铵盐能结合到病毒包膜上影响新成代谢,干扰核酸和蛋白质合成,影响能量代谢[12]。使用时应避免与阴离子表面活性剂(肥皂、吐温80)和一些拮抗物质(碘化钾、蛋白银、水杨酸、升汞)同时使用[13]。
含碘消毒剂包括碘和以碘为主要成分的各种制剂,碘主要通过卤化作用与ASFV蛋白质氨基结合,使其失活[14]。它的消毒效果易受pH和有机物影响。
1.2 物理消毒法
紫外线能使病毒核酸内键和链发生断裂、形成光化产物等,其穿透力弱、辐射能量低,对人体有刺激和损伤作用,严重时可致癌。γ射线对分子的损伤主要源于初级电离(直接)和自由基的产生(间接)[15],其穿透力强、灭活速度快且不影响病原微生物的抗原性和免疫原性[16]。
1.3 生物消毒法
生物消毒剂是指用生物分泌的化学物质,如植物消毒剂、抗菌肽、噬菌体、生物酶等制备的消毒剂[17]。
1.4 环境生态修复法
环境生态修复是通过创造不利于病原微生物生存的条件来净化和修复环境。生态修复剂主要由微生物菌体和微量化学元素组成[18],其掉落地面形成的生物膜在物体表面发酵能消耗有机物和氧气[19]。这类消毒剂可在环境中稳定长效,具有很好的发展前景。
1.5 其他病毒清除技术
低 pH 孵放法是静脉注射人免疫球蛋白常用的病毒灭活方法,已有很多研究者对其灭活效果进行了验证[20-21]。低pH可改变病毒表面的抗原电荷,使其囊膜结构发生变性从而无法侵染细胞。
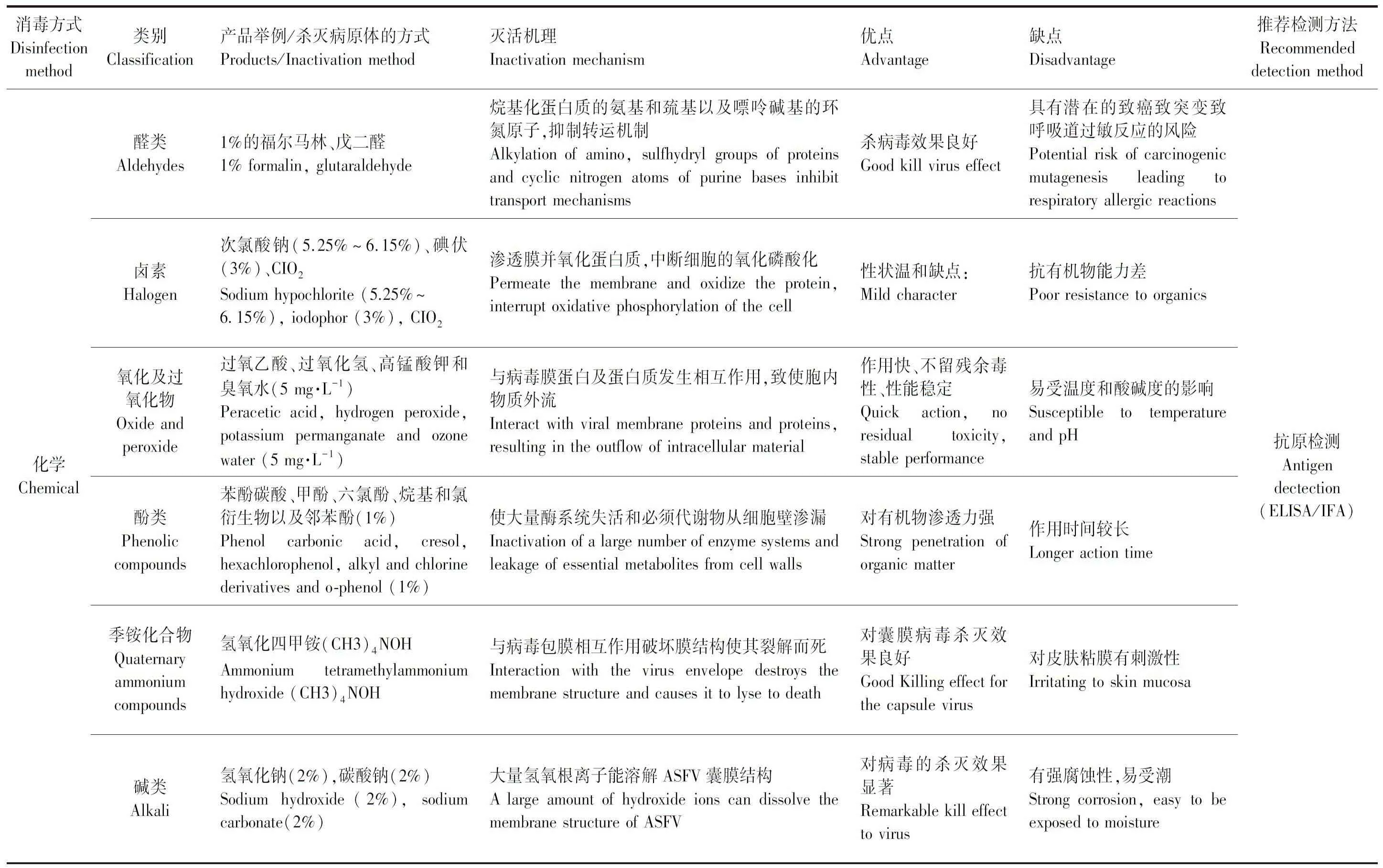
表1 ASFV主要消毒方式的特点及推荐消毒剂效果评价方法Table 1 Characteristics of main disinfection methods of ASFV and evaluation methods of recommended disinfectant effectiveness

它的特点是安全、高效且稳定。
纳滤(nanofiltration, NF)又称低压反渗透或“疏松反渗透”(loose),是一种介于反渗透和超滤之间的压力驱动膜分离过程,纳滤膜的孔径范围在几个纳米左右,能去除二价及多价离子和分子量大于200的各类物质[22]。
阴离子交换色谱(anion-exchange chromatography, AEX)是根据混合物中不同分子所带电荷性质的差异进行分离的一种色谱技术, 根据该原理也可用于样品中病毒的纯化或清除[23],其特点是操作简单、条件温和、重复性强。
2 不同消毒技术在疫病防控中的应用
2.1 化学消毒法在在疫病防控中的应用
2.1.1醛类1979年,Cunliffe等[24]发现,戊二醛能有效灭活暴露于22~26 ℃ 11 d的猪心脏组织中的ASFV。某醛制剂产品(12.74%戊二醛+ 4.84% 癸甲氯铵)于20 ℃作用30 min,稀释比例为1∶50,可使含1%有机物的磷酸缓冲液(PBS)中的ASFV滴度降低4.6 log,其在高温下的作用效果较好[25]。现地常用500 mL 40%的福尔马林与200 g高锰酸钾混合对封闭畜舍进行熏蒸消毒,时间为24 h,熏蒸后开窗通风8 h[26]。
2.1.2卤素类研究显示2.3%的氯(次氯酸盐)作用30 min能有效灭活ASFV[27]。猪场常用5%的次氯酸钠溶液喷洒至地面、墙壁、通道、排污沟、用具和设备等,包括漏缝地板背面等物体表面彻底湿润,2 h后再喷洒1次,4 h后用清水冲洗,自然干燥2~3 d[26]。
2.1.3氧化物及过氧化物类近期研究发现,5 mg·L-1臭氧水能有效杀灭ASFV[28],其杀灭效果受到臭氧分子向液体中转移总速率的限制[29-30]。卫可消毒剂(VirkonS)[31]的有效成分是过硫酸氢钾三盐复合物,1%的卫可作用10 min能完全灭活不锈钢表面3.2 log10 TCID50·mL-1的ASFV,5%的卫可作用10 min能完全灭活多孔混凝土中的ASFV[32]。现地常将1% 过硫酸氢钾溶液喷洒于环境物体表面,作用2 h后再喷洒1次,4 h后用清水冲洗,自然干燥2~3 d[26]。
2.1.4酚类1%邻苯酚能有效灭活ASFV,最短灭活时间为1 h[33]。苯酚对有机物具有良好的渗透力,主要用于含有机物质(如感染食物和排泄物等)的场所消毒。
2.1.5碱类2%的碳酸钠腌制28 d能有效灭活生皮中的ASFV。2%氢氧化钠24 h内能杀死血液中ASFV[34]。猪场常采用3%的NaOH溶液对畜舍喷洒消毒1~2次,4 h后用清水冲洗,干燥3~5 d 后用5% NaOH+20%的石灰水进行白化处理[26]。
2.1.6季铵盐类近期研究发现,单双链季铵盐复配使用能大幅增加抗有机物能力,其主要用于环境表面ASFV的消毒[35]。
2.1.7碘制剂类消毒剂碘制剂抗有机物能力差,不适用于环境消毒,常用于手术部位、皮肤、粘膜消毒以及发生疫情时带猪、带禽消毒[12]。近期研究发现,三碘氧化合物能克服传统碘制剂抗有机物能力差的缺陷[36]。
2.2 物理消毒法在疫病防控中的应用
2.2.1高温消毒ASFV高度耐低温不耐高温。Mazur等[37]根据非线性回归模型估计半衰期值,预测ASFV在-20 ℃能存活353~713 d,4 ℃能存活35~136 d,23 ℃能存活9~17 d。实验室条件下,100 ℃持续1 min可彻底灭活106TCID50·mL-1病毒悬液,火焰温度下可瞬间灭活ASFV。现地由于高温灭活效果会受到现地污物(粪便、泔水、血浆等)的影响。在绝对压力为300 kPa(3 Bar)的情况下,应将泔水保持在121 ℃至少10 min[35]。pH为8的条件下,将猪粪水按照100 L·h-1的速度通过53 ℃的泥浆,可有效灭活ASFV。在密闭容器中最低温度为70 ℃时维持30 min以上可灭活肉中的ASFV[38]。对于猪肉为原料的血液制品的消毒,采用的喷雾干燥设备温度应不低于220 ℃,干燥后的物料要在60 ℃以上维持20 min以上才能确保ASFV完全灭活[38]。
2.2.2紫外线消毒紫外线(ultraviolet, UV)是实验室和现地室内场所常采用的消毒方式。Risa等[39]发现,不同波长的UV照射能使受感染细胞内甲型流感病毒(IAVs)的核酸总量减少,并抑制细胞内mRNA(信使RNA)、vRNA(病毒RNA)和cRNA(互补RNA)的积累。UV灭活的ASFV刺激外周血单核细胞时能使T细胞系CD4+亚群和CD8+亚群同时增加[40]。900 J·m-2的UV照射剂量能使纤维蛋白原和凝血酶中的脂包膜病毒滴度下降至少4 log,且紫外照射前后纤维蛋白原和凝血酶的蛋白含量和结构没有发生明显变化[41]。近期有研究发现,254~257 nm的UV能使ASFV的核酸拷贝数随照射时间的增长而减少[42]。此外,由于经水传播的肠道病毒对紫外线具有一定的抵抗力[43],因此,针对病毒的灭活需要提供至少186 J·m-2的有效消毒剂量[44]。当空气湿度大于60%,应适当延长照射时间。
2.2.3γ射线消毒1983年,研究者采用20 kGy的γ射线灭活了ASF急性发病猪组织样品中的ASFV,病毒的感染效价为104.6~107.8之间[45]。25 kGy钴60-γ射线可有效灭活动物源性膜材中的病毒[46]。赵彦涛等[47]证实,γ射线辐照可使同种异体肌腱上的病毒滴度下降超过4 log,且不会影响肌腱的极限拉伸载荷和组织结构。
2.3 生物消毒法
生物消毒剂对囊膜病毒(如ASFV)可能具有良好的杀灭作用。但通常具有消毒作用的天然活性物质产量少,不能满足大规模应用,因此,美国科学家研发出以人工合成维生素作为生物活性物质的消毒剂产品,已用于船舶压舱水处理[48]。
2.4 环境生态修复法
研究人员对实施生态修复的试验水体进行连续7个月的监控,结果显示,水体的各项理化指标中总有机碳(TOC)、化学需氧量(COD)和总磷(TP)浓度均较使用修复剂之前大幅下降[48]。
2.5 其他新型病毒清除工艺
2.5.1低pH孵放法低pH孵放法对水疱性口炎病毒(VSV)和伪狂犬病毒(PRV)等脂包膜病毒灭活效果显著。研究显示,该法对VSV灭活效果≥4. 62 log TCID50·0. 1 mL-1,对PRV的灭活效果≥6.12 log TCID50·0.1 mL-1[49]。
2.5.2纳滤膜技术传统的水处理工艺中,跟超滤膜相比,纳滤截留低分子量的能力更强,其可有效去除粒径在纳米级范围的病毒[50]。2018年,Bao等[51]通过19 nm滤膜成功去除甘氨酸溶液中的猪圆环病毒(porcine circovirus,PCV)。
2.5.3阴离子交换层析阴离子交换色谱法(anion-exchange chromatography , AEX)是纯化单克隆抗体药物、蛋白质及血液等的常用方法[52-53]。Sivanathan等[54]采用阴离子交换色谱与二乙基氨基乙基(DEAE)纤维素作为弱阴离子交换器清除了血液中的寄生虫。该法也被用于某些包膜病毒的清除,例如,逆转录病毒(MuLV)和伪狂犬病病毒(PRV)[55]。
3 现阶段消毒与检测技术存在的问题
3.1 消毒效果不佳
消毒不彻底导致少量病毒残留是猪场复养失败、引发重大疫情和加大疫情传播风险的重要原因。现地消毒剂使用不规范,部分猪场为图便宜选择不符合规定的劣质消毒药[56];不明确消毒剂的适用范围,盲目选择消毒药;为省事不按照规范严格控制消毒周期、消毒剂量和消毒时间;对于消毒药的药性不熟知[57],保存不当导致药效减弱或丧失;消毒设施不完善[58];消毒意识淡薄,没有建立健全的消毒制度[59]等主观原因是导致消毒不彻底的重要因素。
化学消毒剂的消毒效果受pH、被消毒物质质地、消毒剂浓度和作用时间以及病原微生物对外界环境抵抗力等因素的影响。近期研究发现,1% Virkon S 作用10 min能完全杀灭无孔表面和病毒悬液中的ASFV,不能完全杀灭经5% CO2(pH<8.5)处理过的多孔混凝土中的ASFV[60]。2 000 ppm次氯酸钠能灭活无孔表面的ASFV和FMDV,但无法灭活木制材料上的FMDV[61]。据报道,4%的碳酸钠溶液能使FMDV降低4个log单位以上,但只能降低3 log单位的ASFV[62]。因此,pH小于8.5、多孔质地、病毒囊膜结构均会影响消毒剂的消毒效果。此外,由于南北地域差异,空气湿度、环境温度、气候条件、气压等因素也会使ASFV的灭活效果存在差异。
3.2 当前检测技术的局限性
由于ASF的临床特征与经典猪瘟等类似,临床上难以鉴别,需要经实验室检测以确诊。实验室检测包括病原学和血清学检测。病原学检测是通过检测ASFV的核酸、抗原或病毒进行诊断。聚合酶链式反应(PCR)和实时荧光定量PCR(qPCR)是国际贸易中OIE指定的ASFV检测方法[63-64]。Tignon等[65]基于p72基因设计的PCR引物和探针能检测到的阳性率比OIE推荐的PCR和qPCR高21%和26%。研究显示,现地经3% NaOH和5%次氯酸钠消毒后,对部分环境样品进行荧光定量PCR检测,结果为阳性。因此,PCR阳性仅表明样品中存在靶核酸序列但并不能说明样品含有感染性的病毒[66]。双抗体夹心ELISA常与qPCR方法平行对现地样品进行检测,敏感性、特异性较高,但仍无法确定目标抗原是否具有活性[67]。Heuschele等[68]通过免疫荧光法(IFA)快捷地检测ASFV,该方法对急性ASF的诊断具有很高的灵敏度,但是对亚急性和慢性ASF的检测灵敏度较低,而且荧光素的非特异性反应会造成假阳性结果。新型检测技术,如微滴数字PCR(droplet digital PCR, ddPCR)、等温扩增技术、荧光微球免疫层析试纸法等大幅提高了检测的灵敏度和效率[69],它们有望替代传统的检测方法,但同样无法鉴别活病毒和灭活病毒。
针对活猪血液样品,不需要确定其是否具有感染性,但针对曾经爆发过ASF的现地环境样品,通过常规检测手段就无法确定其中是否存在活病毒。基于ASFV的EP402R基因编码的外囊膜蛋白CD2v能够诱导红细胞吸附现象[70],研究者建立了血细胞吸附试验(hemadsorption, HAD)用以鉴别ASFV的感染性,但实验所需的猪肺泡巨噬细胞等价格昂贵,且ASFV细胞感染试验需要在Ⅲ级生物安全实验室(BSL-3)内进行,对于强阳性样品通常在接种细胞的最初24 h内可观察到红细胞吸附现象,而对于不具有红细胞吸附特性的ASFV则无法用该方法进行检测。建议将HAD作为参考试验用于确认ELISA、PCR或FAT的阳性结果。因此,目前还没有检测技术能够完全、准确、快速地区分具有感染性的ASFV。
4 活病毒与灭活病毒鉴别检测技术探讨
非洲猪瘟感染性病毒的鉴别及消毒效果的评价是该病防控亟需攻克的重要难题,彻底清除病毒残留是猪场复养的先决条件[71],除了合理使用消毒剂外,感染性测定是必不可少的。针对现地样品(除生猪血液样品外),检测技术是检验消毒效果的必要手段,然而目前的感染性测定方法,如细胞感染试验和红细胞吸附试验等,均具有一定的局限性,因此,鉴别检测技术的建立对ASF的有效防控至关重要。
目前,已确定物理消毒对核酸分子结构具有破坏作用,化学消毒剂则主要破坏病原微生物的包膜结构,因此,根据不同消毒方式可采用相应的检测技术。针对ASFV活病毒和灭活病毒的鉴别,应该在确定ASFV各种灭活方法的机理基础上通过分析ASFV基因组结构和序列特点,挖掘ASFV的代谢脆弱区进行核酸检测,以及从检测包膜完整性的角度入手,建立一种快速、敏感、适用范围广且经济实用的检测技术。还可以借助目前的新技术检测方法如等温扩增技术、微滴数字PCR、荧光微球免疫层析等,提高检测的简便性和敏感性。这项技术的研发将对ASF的现地防控提供新技术支持,减少疫病传播风险,降低经济损失,同时,也能够为未来可能的ASF弱毒疫苗的质控提供检测手段。
武汉病毒研究所最近采用光敏荧光染料叠氮溴化丙锭(PMA)结合qPCR用于检测样品中是否具有感染性的ASFV粒子[72]。其原理是利用PMA不能穿透病毒包膜结构,但能非特异性修饰核酸分子,使其不能通过PCR或qPCR扩增,可用于鉴别包膜结构完整的ASFV。但其精确性和灵敏度还有待进一步检验。现地检测中建议针对紫外和生物消毒法等主要通过破坏核酸使病毒失活的消毒方式灭活的样品,可以相应采用核酸检测技术(表1),如PCR、定量PCR、多重PCR、套式PCR方法等;针对络合碘、酚类、双胍类等主要通过破坏病毒包膜结构的消毒剂灭活后的样品,则应采用抗原检测方法,如ELISA配合免疫荧光法;若是针对热灭活、醛类、卤素类、季铵化合物类消毒剂或新型病毒清除工艺灭活的样品,以上检测技术均可使用。非洲猪瘟对我国养猪业造成巨大打击,我国猪肉供应离不开散养户,散养户在养殖过程中选用合理的消毒剂,规避消毒剂的缺陷,采用相对应的检测技术是我国疫病防控的重要手段。
5 展望
ASF严重危害养猪业,消毒和检测是防控该病的重要手段。目前的研究显示,福尔马林、戊二醛、次氯酸盐、过氧化物、臭氧水和苯酚均是ASFV的高效消毒剂。高温、紫外和射线照射、生态修复剂、低pH敷放法和纳滤等广谱消毒方式对ASF也有杀灭作用。化学消毒法主要通过破坏ASFV的蛋白质包膜结构使其失活,物理消毒法主要通过破坏其核酸结构使其失活。针对化学消毒剂灭活的环境样品,建议选择抗原检测方法,针对物理消毒法消毒的样品建议采用核酸检测手段。
了解不同消毒方式的优缺点和适用范围,规避消毒剂的缺陷,针对不同场所采用合适的消毒剂,针对不同质地和不同病原微生物适当调整灭活时间和消毒剂浓度。按规定合理使用消毒剂,并不断完善检测技术,根据消毒剂的灭活特点合理选择检测技术进行消毒效果评价对疫病的有效防控至关重要。同时,活病毒与灭活病毒的快速鉴别也是亟待解决的重大难题。

