基于可视化基因芯片技术指导幽门螺杆菌个体化治疗的临床研究
杨莉丽 邹傲 吴慧华 郭海 张芳婷 邹兵 王俊萍
幽门螺杆菌(Helicobacter pylori,H.pylori)的发现是对上胃肠道疾病重新认识的里程碑,已经确认它与慢性活动性胃炎、消化性溃疡、胃癌以及胃黏膜相关淋巴组织(MALT)淋巴瘤的发病密切相关,WHO 国际癌症机构确定的I 类致癌因子[1]。我国H.pylori 感染率高达50%[2]。但是近年来H.pylori 根除率愈来愈低[3]。2012年我国标准三联疗法H.pylori 根除率只有73.5%[4]。主要原因H.pylori 耐药率不断增长和质子泵抑制剂(proton pump inhibitor,PPI)在不同患者体内的代谢速度存在差别,最终影响H.pylori 的根除效果[5]。因此,克服上述原因、提高H.pylori 的根除率是摆在临床医生面前的难题。本研究利用可视化基因芯片检测技术,在H.pylori 初始治疗前进行左氧氟沙星、克拉霉素等抗生素耐药性及CYP2C19 基因多态性的检测,根据测试结果给予患者“个体化”H.pylori根除治疗,评价其优越性。
1 材料与方法
1.1 研究对象
选取2015年5月至2017年5月因上消化道症状于本院行胃镜检查患者244 例,其中,男性141例,女性103 例,年龄为24~78 岁,男女的平均年龄分别为(47.3±12.79)岁和(51.2±14.02)岁。
入选标准:①13C 呼气试验和胃粘膜组织快速尿素酶染色均阳性确认H.pylori 现症感染;②胃镜表现为慢性胃炎伴糜烂或消化道溃疡;③符合2012年中国专家共识意见中[2]根除H.pylori 的适应症,且均为初次根除治疗患者;④所有患者均无胃镜检查的禁忌症,无青霉素过敏史。排除标准:①入组前1月内曾服用可能影响研究结果的药物,如抗生素、铋剂、PPI、或H2 受体阻滞剂者;②消化道出血;③消化道恶性肿瘤;④对本研究的所有药物有过敏史;⑤严重肝病、心脏病、呼吸系统疾病、肾功能衰竭等严重疾病;⑥妊娠或哺乳期妇女;⑦精神病、严重神经官能症等。本研究通过北京大学深圳医院伦理委员会审批,遵循赫尔辛基宣言,所有受试者均签署知情同意书。
1.2 方法
1.2.1 Hp 耐药性及CYP2C19 基因型多态性检测
采用深圳市普瑞康生物技术有限公司提供的幽门螺杆菌感染个体化治疗检测试剂盒(基因芯片法)。按照说明书操作。
1.2.2 Hp 个体化治疗方案
主要依据第四次全国H.pylori 感染处理共识报告推荐铋剂四联方案:PPI+铋剂+两种抗生素[2],疗程14 天。铋剂选用胶体果胶铋胶囊200 mg/次,bid。抗生素依据左氧氟沙星和克拉霉素的耐药情况选择用药,方案有以下三种:方案1:如果对左氧氟沙星和克拉霉素均耐药,则选用阿莫西林+呋喃唑酮;方案2:如果对克拉霉素敏感,对左氧氟沙星耐药,则选用阿莫西林+克拉霉素;方案3:如果对克拉霉素耐药,对左氧氟沙星敏感,则选用阿莫西林+左氧氟沙星。剂量分别为:阿莫西林1.0/次,bid;克拉霉素0.5/次,bid;左氧氟沙星0.5/次,qd;呋喃唑酮0.1/次,bid。PPI 根据人CYP2C19 基因多态性选择用药,具体方案:1、强代谢型(EM 型)、中间代谢型(IM 型)选用雷贝拉唑10 mg/次,bid;2、弱代谢型(PM 型)选用泮托拉唑40 mg/次,bid。
1.2.3 根除成功标准
治疗1、2 周及结束后3 天电话随访,评价不良反应及依从性。治疗结束4 周后进行13C 尿素呼气试验检测,若结果阴性,提示Hp 根除成功。
1.3 统计学方法
采用SPSS 19.0 软件进行数据分析,计量资料采用t检验,以(±s)表示,计数资料用n(%)表示,采用χ2检验,P<0.05 为差异具有统计学意义。
2 结果
2.1 抗生素耐药检测结果
任意一个突变点显示阳性判定为耐药,不同基因组两个以上突变点显示阳性则判定双重或多层耐药。见表1。

表1 H.pylori 抗生素耐药检测结果[n(%)]Table 1 H.pylori antibiotic resistance test results[n(%)]
2.3 CYP2C19 基因多态性结果
CYP2C19基因型结果判断:CYP2C19*1/*1为EM型;CYP2C19*1/*2、CYP2C19*1/*3 为IM 型;CYP2C19*2/*2、CYP2C19*2/*3和CYP2C19*3/*3为PM型。244例胃粘膜样本中检出CYP2C19的代谢基因型有242例(99.18%),未检出有2例(0.82%)。见表2。
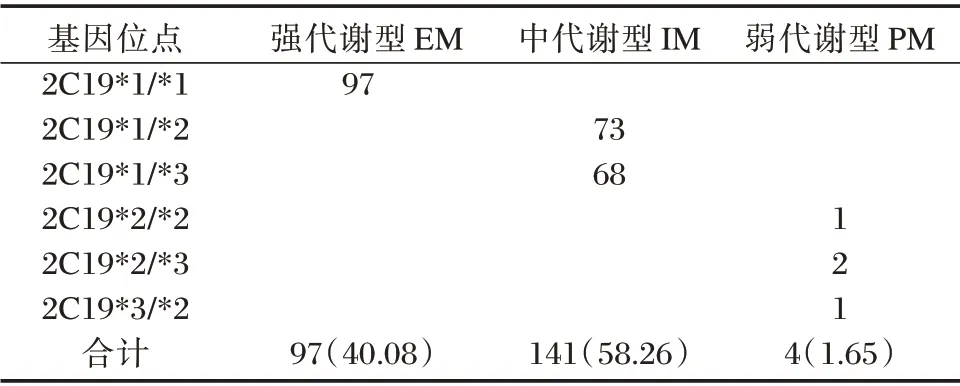
表2 CYP2C19 基因多态性分布统计[n(%)]Table 2 Distribution statistics of CYP2C19 gene polymorphism[n(%)]
2.3 各代谢型Hp 根除率比较
同时检测出代谢基因型及耐药情况的242 例患者中240 例完成治疗,2 例因药物副作用未能坚持服药。各代谢型幽门杆菌根除率比较,差异无统计学意义(P>0.05)。见表3。

表3 各代谢型幽门螺杆菌根除率比较Table 3 Comparison of eradication rate of H.pylori in different metabolic types
3 讨论
全球约超过一半的人口存在H.pylori 感染,近年来我国的感染率呈逐年上升的趋势[6]。在这些感染者中约15%~20%发生消化性溃疡,约5%发生胃恶性肿瘤(胃癌、MALT 淋巴瘤)[7]。目前,由于抗生素耐药性的产生以及CYP2C19 的基因多态性导致Hp 根除率越来越低,根治越来越困难。国内的几项大样本研究也显示标准三联疗法根除率远低于80%的最低要求。
近年来我国H.pylori 对左氧氟沙星和克拉霉素的耐药率不断攀升[8]。韩一凡等[9]研究显示,H.pylori 对克拉霉素和左氧氟沙星的耐药率分别为20.8%和8.9%;且耐药率逐年上升。本研究显示,H.pylori 对克拉霉素为22.95%,与国内外的平均水平相近。根据我国第五次幽门螺杆菌感染处理共识报告,当克拉霉素耐药率>15%,选用含克拉霉素三联治疗方案前应进行药物敏感试验[10]。故在广东深圳地区,H.pylori 根除方案若选用克拉霉素,建议行该药物耐药性检测。本研究中,左氧氟沙星的耐药率仅为5.33%,明显低于国内外学者的报告,故推荐左氧氟沙星作为本地区根除H.pylori治疗方案的首选药物。
H.pylori 根除方案均含有PPI[11]。PPI 在根除H.pylori 治疗中的主要作用是减少胃酸对胃黏膜损害,并能通过各种机制增强胃内抗生素的抑菌和杀菌能力[12]。PPI 经肝脏CYP450 酶的CYP2C19、CYP3A4 代谢,其中CYP2C19 起主导作用。CYP2C19 存在多种突变等位基因,其中CYP2C19*2 和CYP2C19 *3 是功能缺失等位基因,均能造成CYP2C19 酶活性的降低或完全丧失,根据CYP2C19 基因多态性分为:EM、IM 和PM 三种表型,其药物代谢能力表现为EM>IM>PM,PM 型体内药物的代谢能力最弱,体内药物浓度高。在亚洲人群中,CYP2C19 基因型主要为EM 型及IM 型这两种表型,PM 型的比例较少[13]。本研究结果与上述研究结论一致。不同的PPI 受CYP2C19 影响作用程度不同。奥美拉唑、泮托拉唑和兰索拉唑主要经CYP2C19 代谢,故这三种药受CYP2C19 基因多态性影响较大,在根除H.pylori 治疗效果会存在明显的个体差异。因此,在EM 型和IM 型患者中不建议这三种药用于H.pylori 根除治疗。雷贝拉唑具有酶代谢和非酶代谢两条途径,但主要是经非酶代谢,故其受CYP2C19 基因多态性影响较小[14]。对于EM 型和IM 型,笔者选用受CYP2C19 基因多态性影响较小的雷贝拉唑,而PM 型药物代谢慢,血药浓度高,则选用泮托拉唑进行H.pylori 根除治疗。
本研究结果显示CYP2C19 基因多态性的测定选用合适的PPI,减少PPI 在根除H.pylori 治疗中存在的个体差异,能明显提高H.pylori 根除效果。本研究结果提示个体化H.pylori 根除治疗可能是未来最有效而持久的治疗方法。
基因芯片技术是近年可同时进行基因多位点的多态性分型检测的新技术,具有信息量大、灵敏度高、平行快速检测等特点。李云振[15]已提出基因检测技术是未来H.pylori抗生素耐药性检测的发展方向。姚雪等[16]建立了一种可同时检测幽门螺杆菌喹诺酮和克拉霉素耐药和CYP2C19 基因多态性的基因芯片,试验证明其具有较高的特异性和敏感性,结果准确且易判读。本研究采用了此技术指导临床进行H.pylori个体化治疗,取得了满意的治疗效果,值得临床推广。

