染色体22q11.2微缺失检测在先心病产前诊断中的应用
许育双 刘思平 宋兰林 吴瑞枫 裘毓雯 贾蓓★
22q11.2 微缺失综合征(22q11.2 deletion syndrome,22q11.2DS)是22q11.21-22q11.23区域缺失引起的一类临床症候群,在新生活产婴儿中患病率约为1∶4 000,男女患病率比较差异无统计学意义,是人类最常见的微缺失综合征[1]。22q11.2 微缺失综合征最常见的临床症状被概述为CATCH22(Cardiac defects,Abnormal facial features,Thymic hypoplasia,Cleft palate,and Hypocalcemia ,Chromosome 22)[2],其表型极具多样性,轻症者可表现正常,重症者则可以出现累及全身各个组织和器官的症状,表现为严重的机能障碍。其中最主要的表征为合并先天性心脏病,约占70%~80%,而合并的先天性心脏病中动脉圆锥发育异常最为常见,如法洛氏四联症(17%~22%)、主动脉弓离断(14%~15%)、室间隔缺损(13%~14%)等[3]。此外,在先天性心脏病的前瞻性研究中发现,室间隔缺损、主动脉弓离断、法洛氏四联症中存在22q11DS 的比例分别为22.73%、9.09%、18.8%[4]。本研究将对产前超声发现先天性心脏病的胎儿进行22q11.2 微缺失的遗传学产前诊断,并对其表型与基因型进行关联分析,以期为遗传咨询、妊娠指导、出生后临床干预提供重要依据。
1 资料与方法
1.1 研究对象
2014年1月至2019年10月在本院妇产科经胎儿超声检查诊断为先天性心脏畸形的胎儿228例。其中单纯性心脏病162 例,心脏复杂畸形66例;平均孕周为(23±4.80)周;平均(29.48±5.50)岁。
1.2 方法
对获得的胎儿细胞进行培养行染色体核型分析,选择染色体核型正常的样本行全基因组单核苷酸多态性微阵列芯片(single nuclectide polymorphisme array,SNP-array)分析,对确诊为染色体22q11.2 微缺失的胎儿样本,进一步用荧光原位杂交(fluorescence in situ hybridization,FISH)和多重连接依赖探针扩增(multiplex ligation-dependent probe amplification,MLPA)技术对胎儿及其父母进行22q11.2 微缺失验证。本研究已获得医院医学伦理委员会的批准同意,所有入选孕妇及其家属签署了知情同意书。
1.2.1 染色体核型分析和基因组DNA 的提取
实施绒毛取样、羊膜腔穿刺术或脐带血穿刺术,采集胎儿的绒毛、羊水或脐血,同时采集胎儿父母外周静脉血。对胎儿样本常规行细胞培养,后行G 显带、核型分析。同时按照试剂盒操作说明,使用基因组DNA 提取试剂盒(北京天根生化科技公司)提取样本基因组DNA。
1.2.2 SNP-array 分析
对核型未见异常的DNA 标本,采用全基因组SNP 微阵列芯片技术(lumina HumanCytoSNp12 Beadchip/Iumina®OmniZhongHua- 8v1.3 Beadchip,美国),按照操作程序进行DNA 提取、gDNA 变性、全基因组扩增过夜、DNA 片段化、DNA 片段醇沉淀重悬、芯片杂交过夜、单碱基延伸、芯片扫描、结果判读。以专用分子核型软件(Karyostudio Software)对数据进行拷贝数变异及基因分型分析,按照说明书,以≥50 个探针标记和≥100 Kb 分辨率检测人类基因组拷贝数变异及杂合性缺失。
1.2.3 FISH 检测
对结果为22q11.2 微缺失的样本行FISH 进行验证,采用双色荧光探针试剂盒(DiGeorge/VCSF Region Probe,Vysis,美国),其内含有TUPLE1 探针(22q11.2 区域,红色)和对照探针ARSA(22q13.3 区域,绿色)进行检测。按照FISH 操作程序进行制片、干燥、变性、杂交、洗涤、染色和镜检,拍取荧光信号。
1.2.4 MLPA 检测
采用荷兰MRC-Holland 公司的22q11.2 微缺失检测试剂盒(SALSA MLPA P250 Kit)进行验证。按照试剂说明对提取的全基因组DNA 进行变性、杂交、连接、PCR 扩增,使用AppliedBiosystems 3500型测序仪(ABI,美国)对扩增产物进行电泳,应用MRC-Holland 公司提供的Coffalyser.Net 软件进行数据分析,计算该区域各基因位点的拷贝数。
1.2.5 统计学方法
采用SPSS 17.0 软件进行数据分析,计数资料以n(%)表示,采用χ2检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 胎儿染色体核型分析结果
228 例样本中染色体非整倍体64 例,其中21三体25 例、18 三体30 例、13 三体4 例、45,X 2 例、48,XXY,+18 1 例、染色体三倍体2 例,64 例染色体数目异常胎儿大部分病例合并心外多发畸形。
2.2 胎儿全基因组SNP 微阵列芯片检测结果
在染色体非整倍体未见异常的164 例样本中,发现9 例22q11.2 微缺失(图1),检出率为5.49%(9/164)。其中,法洛氏四联症胎儿16 例,检出3 例,占比为18.75%(3/16),在先天性心脏病确诊中占比最高(表1);非法洛氏四联症先心病胎儿148例,检出6 例,占4.05%(6/148)。法洛氏四联症胎儿确诊率(18.75%)高于非法洛氏四联症先心病胎儿确诊率(4.05%),差异有统计学意义(P<0.05)。确诊22q11.2 的9 例胎儿中,7 例为LCR A 与LCR D 之间的经典缺失,1 例为包含TBX1 基因的非经典缺失,1例为不包含TBX1 基因的非经典缺失(图2);行父母全基因组SNP 微阵列检测的2 对,结果均未见异常,另7 例父母未做相关基因检测。

图1 病例2诊断为22q11.2微缺失综合征的SNP-array结果Figure 1 SNP-array analysis results analysis diagram of case 2 diagnosed with 22q11.2 microdeletion syndrom
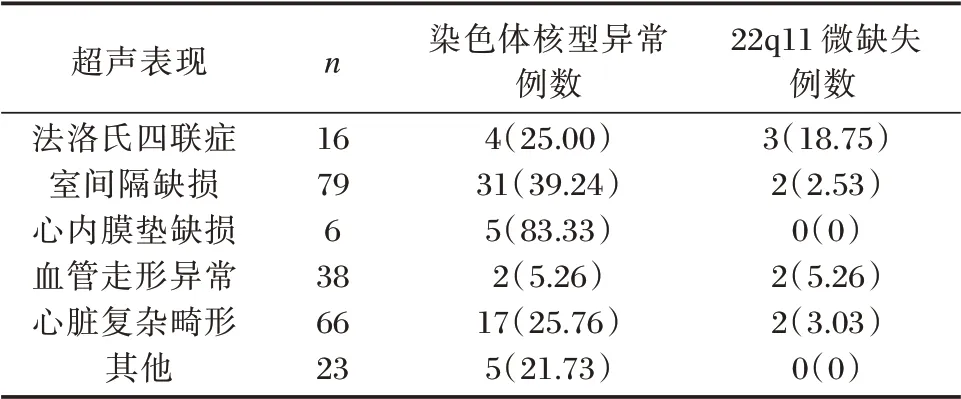
表1 228 例先心病胎儿染色体及22q11.2 微缺失检测结果[n(%)]Table 1 Chromosome deletion and 22q11.2 deletion syndrome were detected in 228 cases of congenital heart disease[n(%)]

图2 9 例22q11.2 缺失区域的分布图Figure 2 22q11.2 deletion region distribution in 9 case
2.3 胎儿FISH 和MLPA 验证结果
9 例22q11.2 微缺失胎儿间期细胞,仅一条22号染色体见一红色荧光杂交信号(TUPLE 探针)和一绿色荧光杂交信号(ARSA 探针),另一条染色体仅见一绿色荧光杂交信号,表明22q11.2 存在缺失。见图3~4。

图3 病例2 诊断为22q11.2 微缺失综合征的FISH 图像(×1000)Figure 3 FISH image of of case 2 diagnosed with 22q11.2 microdeletion syndrome(×1000)

图4 mlpa 电泳结果图Figure 4 Figure of MLPA electrophoresis results
2.4 妊娠结局
9 例22q11 微缺失胎儿和167 例染色体异常胎儿均终止妊娠。继续妊娠的有:15 例室间隔缺损、1 例法洛氏四联症、23 例血管走形异常、8 例心脏复杂畸形、5 例其他心脏病,均分娩后心胸科随诊,部分患儿适时手术,术后恢复良好。
3 讨论
在相关报道中,约75%~85%的染色体22q11.2微缺失综合征表现为伴有先天性心脏病[5],先天性心脏病胎儿染色体22q11.2 微缺失综合征的发生率为1.56%[6]。本研究结果高于既往报道,可能与孕妇行胎儿超声检查的孕周有关。这也说明染色体22q11.2微缺失综合征是导致胎儿先天性心脏病的重要因素。染色体22q11.2 微缺失综合征是22 号染色体上22q11.21~22q11.23 区域缺失导致,该区域的缺失是低拷贝重复序列(low copy repeats,LCR)非同源重组导致的[7]。在基因型与表型关联研究中,最受关注的是缺失导致TBX1 基因单倍剂量不足,影响了胚胎期心脏神经嵴细胞功能的正常表达,导致心脏发育异常[8-9]。另外,该区域内Hira 基因突变将影响心脏的环化以及神经崎细胞的正确迁移,进而导致先天性心脏病[10]。
在本研究中,病例8 的缺失区域不包含TBX1和Hira 基因但同样表现为复杂的心脏发育异常。检索DECIPHER 数据库的病例发现,与本案例基因拷贝数变异(Copy number variations,CNV)大小有60%以上交叠的有8 个病例(ID:254238,2366,401245,249397,251228,262483,276696,292353)。Lopez-Rivera 等[11]分析了携带22q11.2 缺失的14 例患者,其中有12 例合并有肾脏发育异常(肾发育不全或发育不良),2 例合并其它泌尿系统异常;泌尿系统异常合并心脏发育异常的仅有1 例。通过病例对照研究斑马鱼和小鼠模型,Lopez 推测CRKL基因的单倍型不足是22q11.2 微缺失患者肾脏发育异常的遗传驱动因素。然而在本研究的9 例携带22q11.2 缺失的胎儿中,只有1 例胎儿观察到肾脏的超声软指标异常,提示CRKL 基因剂量不足导致的肾脏异常胎儿期表现可能不明显,导致心脏发育异常的证据尚不充分。22q11.2LCR C~D 缺失导致心脏发育异常可能是邻近基因效应,或区域内存在调控基因下调了主效应基因TBX1 的编码功能。
染色体22q11.2 微缺失患儿临床表征复杂多样,除了先心病外通常有免疫力低下、甲状旁腺发育不良、语言功能障碍异常等[12]。患儿出生后需花费巨额的费用进行治疗,术后死亡率及并发症较未携带该缺失的患儿高[13]。89.7%的患儿智力落后和学习困难,同时患儿成年后精神分裂症、冠心病发病风险也比正常人增高[14-15]。上述症状通常随着年龄增长逐渐显现及加重,因此早期有效的诊断染色体22q11.2 微缺失十分重要,这有利于对重症者进行早期干预,对降低出生缺陷具有重要意义。
综上所述,先天性心脏病与染色体22q11.2 微缺失综合征之间关系密切。对于超声筛查提示先心脏病的患儿应警惕是否存在染色体22q11.2 微缺失,建议在孕妇知情同意的情况下行侵入性产前检查,从分子水平上明确先心病的病因。利用产前筛查和产前诊断技术,及早发现和干预先心病患儿,这对于探索先心病的治疗方案和提出针对性的预防措施具有重要意义。

