盐胁迫对苋菜种子的发芽及幼苗生长的影响
王廷芹 甘秋霞 李倩茹

摘 要:采用0、40、80、120、160 mmol/L的NaCl溶液对苋菜种子进行浸泡发芽以及浇灌其幼苗,研究不同盐胁迫下对苋菜种子的发芽及幼苗的生长的影响。结果表明:随着盐浓度增加,苋菜种子的发芽率呈下降趋势,幼苗生长缓慢。MDA含量和POD活性随盐浓度的升高而不断增加,说明幼苗的生长能力不断加速,脂质作用增强,根系老化的速度加快;而电导率不断上升,CAT活性呈上升趋势,苋菜幼苗细胞膜受到伤害,抗逆性增强;NaCl溶液在40~120 mmol/L时,可溶性蛋白质含量和硝酸盐含量与CK差异显著,说明在一定浓度范围内,苋菜幼苗的生长发育变化大。
关键词:盐胁迫;苋菜;幼苗;抗逆性
中图分类号:S636.4
文献标志码:A
苋菜原产我国,品种很多,而人们通常使用的主要是人工种植的赤苋和绿苋[1]。随着人们的食用营养水平提高,苋菜这种优质多用途的蔬菜已引起了人们的关注[2]。苋菜叶里含有高浓度的赖氨酸,可补充谷物中氨基酸不足的缺陷,对促进生长发育有良好的作用,具有清热解毒之效[3]。
同时,苋菜富含多种维生素,被称为“菜中维生素丸”。苋菜还可当饲料添加剂,生产天然的饮料和儿童营养食品[4]。 苋菜在盐分胁迫中的金属离子及营养元素蓄积差异[5],盐胁迫下镉的亚细胞分布及转运[6],苋菜对水分胁迫适应性[7]等。外源物GA3(赤霉素)对苋菜幼苗的生长促进作用最强[8]。有人研究硫对苋菜的生长[9]、磷肥对苋菜生长的影响[10]。还有赤霉素[11]、Pb(铅)[12]、钴[13]等胁迫下对苋菜的影响。
盐渍土在我国分布广泛,西北、华北、东北及沿海是我国盐渍土的主要集中分布地區,耕地中也有大量盐渍化土壤分布[14]。通常,大棚在使用3年以后,土壤含盐量在0.10 %~0.38 %[15]。土壤中盐分不断增加,有人研究不同地区土壤盐渍化的动态变化[16-18]。
因此,在土壤盐渍化越来越严重、而苋菜对人们生活有比较重要作用的情况下,探究盐胁迫下对苋菜种子发芽和幼苗生长的影响,为苋菜适应盐胁迫提供理论依据。
1 材料与方法
由山东省禾之元种业提供花红苋菜,早熟品种。
试验在广东海洋大学兴农楼316的人工气候箱中进行。NaCl溶液浓度为0、40、80、120、160和200 mmol/L。期间,培养皿中的滤纸保持湿润状态,每隔两天进行滤纸的更换。测定其发芽率[19]、发芽指数[19]、相对盐害率[19] 、相对发芽率[20]、发芽势[21]。同时使用穴盘进行种子播种,用NaCl溶液进行浇灌,分别在播后的第6天、第12天、第18天进行取样测定根长度[21]、茎高度[21]、根茎之比[22]、可溶性蛋白含量[23]、硝酸盐含量[23]、电导率[24]、丙二醛含量[25]、SOD活性[26]、CAT活性[27] 、POD活性[28]。
用SPSS和Excel软件进行统计分析,进行多重差异比较。
2 结果与分析
2.1 盐胁迫对苋菜种子发芽质量的影响
2.1.1 盐胁迫对苋菜种子发芽率和发芽势的影响
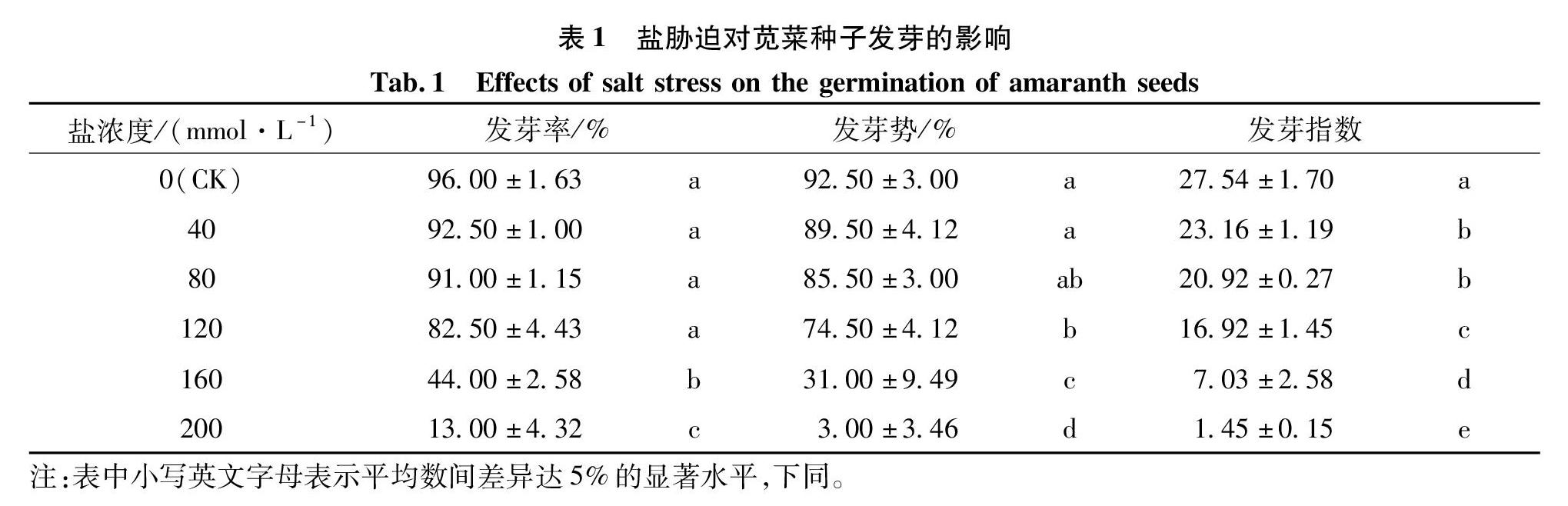
由表1中可以看出,随着盐胁迫程度不断增大,苋菜种子的发芽率呈逐渐下降的趋势,且当盐浓度达到160 mmol/L时,种子的发芽率与CK差异显著(P<0.05),发芽率骤然下降,与CK相比下降52%,其显著抑制种子发芽。
在规定的时间内,种子的发芽势与CK有显著性差异,当盐浓度为40和80 mmol/L时,生长势与CK的差异不大,后期的生长速度与CK一致。从120 mmol/L的盐浓度开始,种子的生长势与CK差异显著,盐浓度为160 mmol/L时,生长势较CK下降了60%,说明高浓度的盐胁迫严重抑制了苋菜种子的萌发,并给种子萌发造成了一定的致死伤害。
2.1.2 盐胁迫对苋菜种子相对发芽率和相对盐害率的影响
由表2中可以看出,在盐浓度≥120 mmol/L时,各处理间的相对发芽率和相对盐害率呈显著性差异(P<0.05)。40、80和120 mmol/L的相对发芽率与CK无显著差异,盐浓度对苋菜种子的影响不大,苋菜种子对低浓度的盐胁迫有一定的抗盐性。当盐浓度为160 mmol/L时,相对发芽率的差异性明显,浓度过高,出现抑制发芽的现象。160 mmol/L处理下苋菜种子的相对盐害率与CK差异显著,种子萌发受到明显抑制。
2.2 盐胁迫对苋菜幼苗形态指标的影响
2.2.1 盐胁迫对苋菜幼苗根长度的影响
由表3中可知,播后6 d,各处理的根系长度无明显变化。播后18 d,高浓度处理的苋菜幼苗的根长与CK有显著差异,且处理的根长比CK都低。浓度越高,对根系长度影响越明显,说明根系细胞内水分不平衡导致根系生长缓慢。在高浓度胁迫下,根系生长受到抑制,较低浓度处理下的根系开始逐渐伸长。
2.2.2 盐胁迫对苋菜幼苗茎高度的影响
由表4可知,随着盐浓度的增加,苋菜幼苗茎高与CK成负相关。播后6 d,低浓度处理的苋菜幼苗茎高与CK无明显差异;120 mmol/L处理的茎高与CK有显著差异,说明高盐胁迫处理的苋菜幼苗生长速度也比较缓慢,盐浓度过高抑制根系的吸收,从而影响幼苗茎的生长。苋菜幼苗生长过程中,NaCl浓度为40 mmol/L时,茎的生长速度比CK低,茎高与CK差异显著,且处理的苋菜幼苗生长比CK慢,说明盐胁迫对苋菜幼苗茎伸长有抑制作用。
2.2.3 盐胁迫对苋菜幼苗根茎比的影响
表5中,播后的6 d和12 d, 120 mmol/L处理的根茎比比CK偏高,是CK的1.5倍,与CK呈现显著差异性(P<0.05)。播后的6 d、12 d,低浓度处理与CK的根茎比无明显变化,说明根部吸收供给地上部的速率一样。播后18 d,各浓度处理的苋菜幼苗的根茎比都比对照高,且呈显著性差异,说明在盐胁迫下,苋菜表现出抑制地上部生长的趋势。
2.3 盐胁迫对苋菜幼苗生理指标的影响
2.3.1 盐胁迫对苋菜幼苗可溶性蛋白质含量的影响
由表6可得,40~80 mmol/L的NaCl溶液处理种植的苋菜幼苗的可溶性蛋白质含量总体偏低。低浓度盐胁迫下,苋菜的可溶性蛋白质含量比CK低,出现显著性差异。120 mmol/L的盐浓度处理的蛋白质含量与对照无显著差异。随着处理天数增加,160 mmol/L高浓度盐处理的蛋白质含量快速下降,播后6 d和播后12 d的可溶性蛋白质含量显著比对照高,播后18 d时,显著比对照低,说明盐处理抑制了蛋白质的合成。
2.3.2 盐胁迫对苋菜幼苗叶片硝酸盐含量的影响
由表7中可以看出,鹽浓度在40~120 mmol/L之间时,苋菜幼苗的硝酸盐含量都比CK偏大,高浓度(160 mmol/L)处理的苋菜幼苗的硝酸盐含量比CK低。苋菜生长过程中,80 mmol/L NaCl溶液处理的硝酸盐含量比CK高,盐胁迫下的苋菜幼苗硝酸盐含量积累较多。
2.3.3 盐胁迫对苋菜幼苗质膜透性的影响
从表8中可以发现,随着盐胁迫程度增大,细胞质膜透性增大。高浓度处理的苋菜幼苗受逆境伤害程度最高,与对照差异显著。播后18 d,40 mmol/L处理的细胞质膜透性是CK的两倍,其它处理的苋菜幼苗的细胞膜伤害更大。盐胁迫下,苋菜细胞膜会受到一定程度的伤害,导致其抗性降低。
2.3.4 盐胁迫对苋菜幼苗丙二醛(MDA)含量的影响
表9中,苋菜幼苗中MDA的含量在不断地增加,脂质过氧化物效果增强。播后6、12和18 d,40 mmol/L处理的MDA含量与CK无显著差异。苋菜幼苗生长过程中,120和160 mmol/L处理的丙二醛含量与CK显著差异。播后18 d,80 mmol/L处理的MDA含量与CK也差异显著,说明在高盐胁迫下,苋菜幼苗衰老的速度比较快。高浓度盐处理导致丙二醛(MDA)含量急剧上升。
2.3.5 盐胁迫对苋菜幼苗超氧歧化酶(SOD)活性的影响
由表10中看出,播后6 d,80 mmol/L处理苋菜幼苗的SOD活性比CK高,且差异显著;160 mmol/L处理的苋菜幼苗SOD活性则比CK低,为CK的0.5倍。播后18 d,其他处理的SOD活性比CK低,高浓度和低浓度处理的SOD活性与CK差异不明显。
2.3.6 盐胁迫对苋菜幼苗过氧化氢酶(CAT)活性的影响
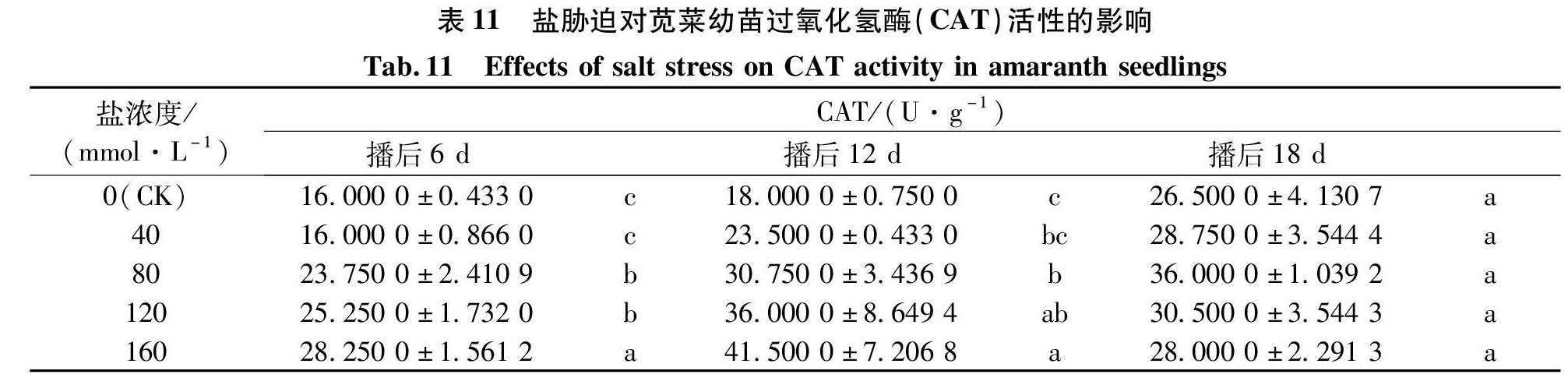
表11中,苋菜生长的过程中,40 mmol/L处理的幼苗CAT活性与CK无显著差异,说明低浓度盐胁迫下处理的苋菜幼苗CAT活性与CK变化不大。80 mmol/L处理的幼苗与CK差异显著,说明高浓度处理的苋菜幼苗因细胞膜受到Na+的胁迫而导致细胞内CAT活性增加,缓解逆境情况。同时,在高浓度下CAT活性都是比CK高。
2.3.7 盐胁迫对苋菜幼苗过氧化物酶(POD)活性的影响
由表12中可得,不同浓度盐处理对苋菜幼苗的过氧化物酶(POD)活性呈现正相关。整个幼苗生长过程中,CK的POD活性最低,因此其根系老化的程度最弱。高浓度处理的POD活性比CK高,最高可达对照的5倍。由于盐浓度逐渐提高,生长发育受到抑制。
3 讨论
盐胁迫使植物生长发育缓慢,苗期耐盐性对生产实践很重要[29]。本试验中,盐胁迫下苋菜种子的发芽率呈现下降的趋势, Na+浓度的不断提高,严重影响了植物组织细胞膜的通透性,导致生理干旱、生长受阻等,幼苗的生长速率与盐胁迫相关[30]。
在盐碱胁迫下,植物的氧化损伤能力增强,能够有效的维系植物细胞内环境的正常生理代谢[31-33]。丙二醛(MDA)是生物膜上脂质过氧化物反应的产物,为植物衰老的指标。本试验中,丙二醛含量不断上升,其植株衰老的速率加快。
植物的生长量与其抗逆性有明显的关系,生长受到抑制的程度越大,受逆境胁迫就越明显[34]。植物细胞质膜受到的损害越大,抗性越弱;反之则抗性越强[35]。植物在正常条件下,活性氧的形成和清除之间保持着一种动态平衡[36]。当受到外界逆境胁迫时,植物通常会利用自身的抗氧化酶系统和抗氧化剂对活性氧进行消除,从而提高自身抗逆性[37]。在本试验中,随着盐胁迫程度的增加,其电导率也在不断地升高,同时CAT活性不断上升,盐胁迫改变其细胞膜透性,致使细胞内的物质大量外渗,导致组织浸泡液的电导率增大,逆境伤害程度增大,抗逆性增大。同时POD活性也在随着胁迫强度的增加而不断上升,根系的老化也在不断地加快,地上部的营养就有可能会供应不足,导致脂质过氧化反应加强。超氧化物歧化酶 (SOD) 是膜系统有关的因子,在植物遭受逆境胁迫时,可以利用抗氧化酶系统来清除氧自由基, 以防止氧化损伤[38]。 本试验中,SOD活性在播后6 d时,低浓度下的幼苗与CK无明显的差异,而高浓度下处理的幼苗与CK有差异显著。可溶性蛋白含量在细胞内的积累对于降低细胞内溶质的渗透势、平衡原生质体内的渗透压等具有比较重要作用[39]。本试验发现,高浓度盐处理的可溶性蛋白含量、硝酸盐含量与CK存在显著差异。无论是发芽阶段还是幼苗阶段,苋菜对低浓度盐处理有一定抗性。
参考文献:
[1] 张玉祥.清新明目话苋菜[J].服务科技,2001(6):42.
[2] 张志焱.长寿之菜——苋菜[J].中国土特产,1996(4):25.
[3] 赵秀玲.苋菜的营养成分与保健功能[J].食品工业科技,2010,31(8):391-393.
[4] 吴时敏.苋菜的开发利用[J].山西食品工业,1999(1):13-14,16.
[5] 李松松.盐胁迫下不同品种苋菜对重金属及营养元素蓄积差异的研究[D].广州:暨南大学,2014.
[6] 周丽珍,罗璇,何宝燕,等.NaCl胁迫下苋菜中镉的亚细胞分布及转运研究[J].生态环境学报,2015,24(1):139-145.
[7] 庞雯,阚丽艳,谢长坤,等.野生苋菜在水分胁迫下的适应性表现及其应用探讨[J].上海交通大学学报(农业科学版),2018,36(3):33-38.
[8] 刘生财,谭吉祥,潘君飞,等.外源物质对苋菜种子萌发及幼苗生长的影响[J].种子,2018,37(4):66-70.
[9] 张国芹,牟建梅,徐瑶,等.施硫对苋菜生长及品质的影响[J].安徽农业科学,2017,45(35):48-49,52.
[10]邹茸,王秀斌,霍文敏,等.不同磷肥品種对苋菜镉累积的影响[J].中国土壤与肥料,2018(1):37-42.
[11]叶倩,朱富伟,陈汉才,等.赤霉素对苋菜产量和营养品质的影响及其残留研究[J].中国农学通报,2018,34(18):65-70.
[12]陈丽惠,余惠武,黄启同,等.Pb胁迫下红苋菜与油麦菜的微量金属累积分析[J].闽南师范大学学报(自然科学版),2016,29(4):38-43.
[13]徐冬平,王丹,曾超,等.钴胁迫下红苋菜中钴积累分布及其生理特性的研究[J].环境科学与技术,2014,37(11):105-110.
[14]杨劲松.中国盐渍土研究的发展历程与展望[J].土壤学报,2008(5):837-845.
[15]陈思奇,蒋毓婷.设施土壤次生盐渍化的成因、危害及治理措施[J].辽宁化工,2018(11):1146-1148.
[16]韩燕.新疆玛纳斯河流域土壤盐渍化动态监测及风险性评价[D].石河子:石河子大学,2018.
[17]马海丽.黄河三角洲典型区地下水动态及其与土壤盐渍化的关系[D].济南:济南大学,2015.
[18]王雪梅.干旱区典型绿洲土壤盐渍化及其生态效应研究[D].乌鲁木齐:新疆大学,2010.
[19]李会云,李伯寿,张延召,等.NaCl模拟盐胁迫对蜜本南瓜种子萌发的影响[J].农业与技术,2018,38(11):1-3.
[20]朱迎春,孙德玺,邓云,等.NaCl胁迫对西瓜种子发芽的影响[J].中国瓜菜,2018,31(12):19-23.
[21]牛希华,艾海舰.NaCl胁迫对谷子种子萌发及幼苗生长影响的研究[J].榆林学院学报,2018,28(2):78-81.
[22]张慧波,邢乃林,王迎儿,等.不同盐胁迫时间对南瓜苗期生长的影响[J].黑龙江农业科学,2018(5):5-9.
[23]张宪政,陈凤玉,王荣富.植物生理学实验技术[M].沈阳:辽宁科学技术出版社,1994:144-145,150-151.
[24]王爱国,罗广华,邵从本,等.大豆种子超氧物歧化酶的研究[J].植物生理学报,1983(1):77-84.
[25]赵世杰,史国安,董新纯,等.植物生理实验技术[M].北京:中国农业科学出版社,200.
[26]李合生,孙群,赵世杰.植物生理生化实验原理和技术[M].北京:高等教育出版社,2003:119-120.
[27]李小艳,白瑞琴,蔺予曼,等.NaCl 胁迫对几种柳树生长和生理特性影响的研究[J].内蒙古农业大学学报(自然科学版),2018,39(5):7-14.
[28]陈金龙.不同浓度盐分胁迫对枸杞生理指标的影响[J].林业科技通讯,2018(8):68-72.
[29]米永伟,王国祥,龚成文,等.盐胁迫对菘蓝幼苗生长和抗性生理的影响[J].草业学报,2018,27(6):43-51.
[30]王爱国,邵从本,罗广华.丙二醛作为植物脂质过氧化指标的探讨[J].植物生理学通讯,1986(2):55-57.
[31]魏淑贞. 盐胁迫对甜菜品种筛选及幼苗生理生化性质的影响[D].呼和浩特:内蒙古农业大学,2017.
[32]陈翠莲.氮蓝四唑(NBT)法测定超氧化物岐化酶(SOD)活力[M]//李合生,孙群,赵世杰,等.植物生理生化实验原理和技术.北京:高等教育出版社,2000:169-176.
[33]朱延凯,王振华,李文昊.不同盐胁迫对滴灌棉花生理生长及产量的影响[J].水土保持学报,2018,32(2):298-305.
[34]章华婷.盐胁迫对夏蜡梅幼苗生长的影响及机理研究[D].上海:上海师范大学,2018.
[35]张丽丽,倪善君,张战,等.外源赤霉素对盐胁迫下水稻种子萌发及幼苗生长的缓释效应[J].中国稻米,2018,24(2):42-46.
[36]袁俊杰,蒋玉蓉,吕柯兰,等.不同盐胁迫对藜麦种子发芽和幼苗生长的影响[J],草业学报,2015,24(12);204-212.
[37]彭程.盐胁迫对植物的影响及植物耐盐性研究进展[J].山东商业职业技术学院学报,2015,13(1):61-66.
[38]JIA W L,WANG C P,MA C X,et al. Mineral elements uptake and physiological response of Amaranthus mangostanus (L.) as affected by biochar[J]. Ecotoxicology and Environmental Safety,2019,175:58-65.
[39]SOTO K M,HERNNDEZ-ITURRIAGA M,LOARCA-PIA G,et al. Antimicrobial effect of nisin electrospun amaranth: pullulan nanofibers in apple juice and fresh cheese[J]. International Journal of Food Microbiology,2019,295:25-32.
(責任编辑:曾 晶)
Effect of Salt Stress on Seed Germination and
Seedling Growth of Amaranth
WANG Tingqin, GAN Qiuxia, LI Qianru*
(College of Coastal Agricultural Sciences, Guangdong Ocean University, Zhanjiang 524088, China)
Abstract:
In this experiment, 0, 40, 80, 120 and 160 mmol/L NaCl solutions were used to soak and germinate amaranth seeds and water their seedlings, the effects of different salt stress on the germination of amaranth seeds and seedling growth were investigated. The results show that the germination rate of amaranth seed decreased with the increase of salt concentration. Seedling growth was also slow with salt stress. Among them, malondialdehyde content and POD activity increased with the increase of salt concentration, indicating that seedling growth ability was accelerated, lipid effect was enhanced, and root aging was accelerated. With the increase of electrical conductivity, the activity of CAT increased, and the injury degree of membrane of amaranth seedlings increased. When NaCl solution was 40~120 mmol/L, the content of soluble protein and nitrate was significantly different from that of CK, indicating that the growth and development of amaranth seedlings varied greatly within a certain concentration range.
Key words:
salt stress; amaranth; seedling; stress resistance

