LiFePO4改性电极同时测定抗坏血酸、多巴胺和尿酸*
梁亚鸣,袁红雁
(四川大学化学工程学院,四川 成都 610065)

人体健康与体液中各种生物分子的含量密切相关。抗坏血酸(AA)是人体必需的营养物质,当AA不足时,会发生坏血病或内脏出血,危及生命[3-4]。多巴胺(DA)作为一种神经递质,可以调节中枢神经系统的生理功能,其含量与人类情绪和各种神经疾病有关,例如帕金森病、精神分裂症和艾滋病病毒等[5-6]。尿酸(UA)也是人体血清和尿液中重要的生物分子。尿酸值过高会导致痛风和高尿酸血症等疾病[7-8]。通常,DA在人体内的浓度为10-8~10-6mol·L-1,AA的浓度是DA的10~100倍,UA的含量为2.4×10-4~5.2×10-4mol·L-1[9]。因此,快速、有选择性、灵敏地检测这三种生物分子有利于生物学和临床医学的研究。电化学法具有灵敏度高、易小型化、成本低、操作简便等优点,在众多检测方法中脱颖而出。然而,由于AA、DA和UA通常在电极的同一表面上具有相似的阳极峰,传统的修饰电极如GCE,大多不能同时有效的识别共存的AA、DA和UA。为了解决这一问题,人们研究了多种传感材料来制备化学修饰电极,碳材料与金属或金属氧化物混合后由于其良好的导电性,可以达到较低的检测限和较宽的线性范围。此前,本课题组利用另一种锂离子电池材料LiCoO2[10]与石墨混合修饰玻碳电极,实现了在AA和UA存在下对DA的快速灵敏检测,但高浓度的AA仍有弱的阳极峰,无法与DA分离。因此,本文研究了另一种电池材料LFP制备电化学传感器,以期实现DA、AA和UA的同步、灵敏检测。
本文将LFP与石墨粉末混合用来修饰GCE。制备的LFP-G/GCE实现同时测定AA、DA和UA。用循环伏安法(CV)和差分脉冲伏安法(DPV)可以很好地区分这三种化合物在LFP-G/GCE表面的氧化峰。LFP和石墨粉末都是工业化的材料,容易获得。结果表明,LFP-G/GCE对实际样品中AA、DA和UA的回收率均达到了满意的水平。此外,还可以检测人血清中UA的原始含量,说明该传感器在临床诊断中具有潜在的应用价值。
1 实 验
1.1 试剂和仪器
LFP,德阳威旭锂电科技有限公司;98%盐酸多巴胺(DA)和(AA),Alfa Aesar;UA(99%),大连美仑生物;99.8%石墨粉,上海胶体化工厂。实验中使用的其他试剂均为分析级,未经进一步纯化。不同pH值的磷酸盐缓冲溶液(PBS)由0.1 M K2HPO4和0.1 M KH2PO4配制而成。每次实验使用的AA、DA、UA和PBS溶液分别现配制。
循环伏安法(CV)和差微分脉冲伏安法(DPV)在CHI660e电化学工作站进行。电化学阻抗谱(EIS)在Autolab PGSTAT 302电化学工作站进行。X射线衍射图在DX-2700B型X射线粉末衍射仪Cu Kα辐照下收集。X射线光电子能谱(XPS)由Kratos XSAM 800光谱仪获得。扫描电子显微镜(SEM)图像由日立S4800获得。所有的电化学实验都是在三电极体系下进行的,以裸GCE(d=3.0 mm)或改性GCE作为工作电极,Ag/AgCl电极作为参比电极,铂(Pt)电极(d=3.0 mm)作为辅助电极。
1.2 LFP/GCE和LFP-G/GCE的制备
10 mg LFP粉末均匀分散于1 mL水和异丙醇(4:1)混合溶液中,加入20 μL Nafion (5%),得到LFP悬浮液。用同样的方法制备了不同质量比(20:1、10:1、5:1、3:1)的LFP-G悬浮液。分别用0.3 μm和0.5 μm氧化铝粉对GCE表面进行抛光,并用去离子水进行超声波清洗。将5 μL相应悬浮液滴于清洁的GCE表面,在室温下自然干燥,制备LFP/GCE和LFP-G/GCE传感器。LFP具有特定的氧化还原峰,它会掩盖被分析物的氧化还原峰,从而影响定量分析结果。因此,制备的LFP/GCE和LFP-G/GCE在空白PBS中通过CV法循环20个周期,确保在所有定量分析之前获得稳定的背景电流。
2 结果与讨论
2.1 LFP-G/GCE对AA、DA和UA的电化学行为
首先用CV法比较了AA、DA和UA在裸GCE、LFP/GCE和LFP-G/GCE上的电化学行为(图1a)。在裸GCE表面,AA在~0.14 V处出现不明显的不可逆氧化峰,DA和UA的氧化峰分别在~0.27 V和~0.43 V。在LFP/GCE和LFP-G(5:1)/GCE电极上,AA、DA和UA分别在~0.07 V、~0.22 V和~0.36 V处有相似的阳极峰。三种分析物在LFP/GCE和LFP-G(5:1)/GCE上的阳极峰电位均低于裸GCE,说明AA、DA和UA在LFP/GCE和LFP-G(5:1)/GCE上发生了的氧化反应。此外,三种分析物在LFP-G(5:1)/GCE电极上的氧化峰电流(ip)是LFP/GCE电极上的两倍,高于裸GCE电极,表明石墨粉的加入提高了电极的导电性,LFP-G(5:1)/GCE对这三种物质具有最灵敏的响应。以上结果还表明,LFP-G(5:1)/GCE对AA、DA和UA具有电催化和吸附作用,加速了分析物向LFP的电子转移。如图1b所示,DPV曲线显示三种分析物的阳极峰分离良好,阳极电流随DA、UA和AA的加入而增大,表明AA、DA和UA可以同时检测。

图1 裸GCE、LFP/GCE、LFP-G(5:1)/GCE在含有1000 μM AA、5 μM DA和50 μM UA的0.1 M PBS(pH 7.0)溶液中的
石墨的加入可以提高电极对AA、DA和UA的响应,因此在Fe[(CN)6]3-/4-溶液中探究了不同比例的石墨修饰电极的可逆性和导电性。图2a表明,增加石墨含量可以降低改性层的电阻,提高导电性。图2b显示导电性的改善可以改善LFP-G/GCE的可逆性。图3是AA、DA和UA在LFP-G/GCE表面的氧化过程。

图2 不同的电极在5×10-3 mol·L-1Fe[CN6]3-/4-中(a)EIS和(b)CV曲线

图3 LFP-G/GCE表面AA、DA、UA氧化过程示意图
2.2 实验条件的优化
为了达到定量分析的最佳条件,以DA为主要研究对象,优化了检测的实验条件,包括改性材料中石墨的比例、电极的负载质量和pH值。
由图4a和图4b可知,LFP与石墨的最佳质量比为5:1,电极负载质量为50 μg。三种分析物的阳极峰值电流(ipa),电压(Ep)与PBS 的pH值之间的关系如图4c所示。考虑到生理pH值接近中性pH值,所以选择pH 7.0的PBS进行定量检测。
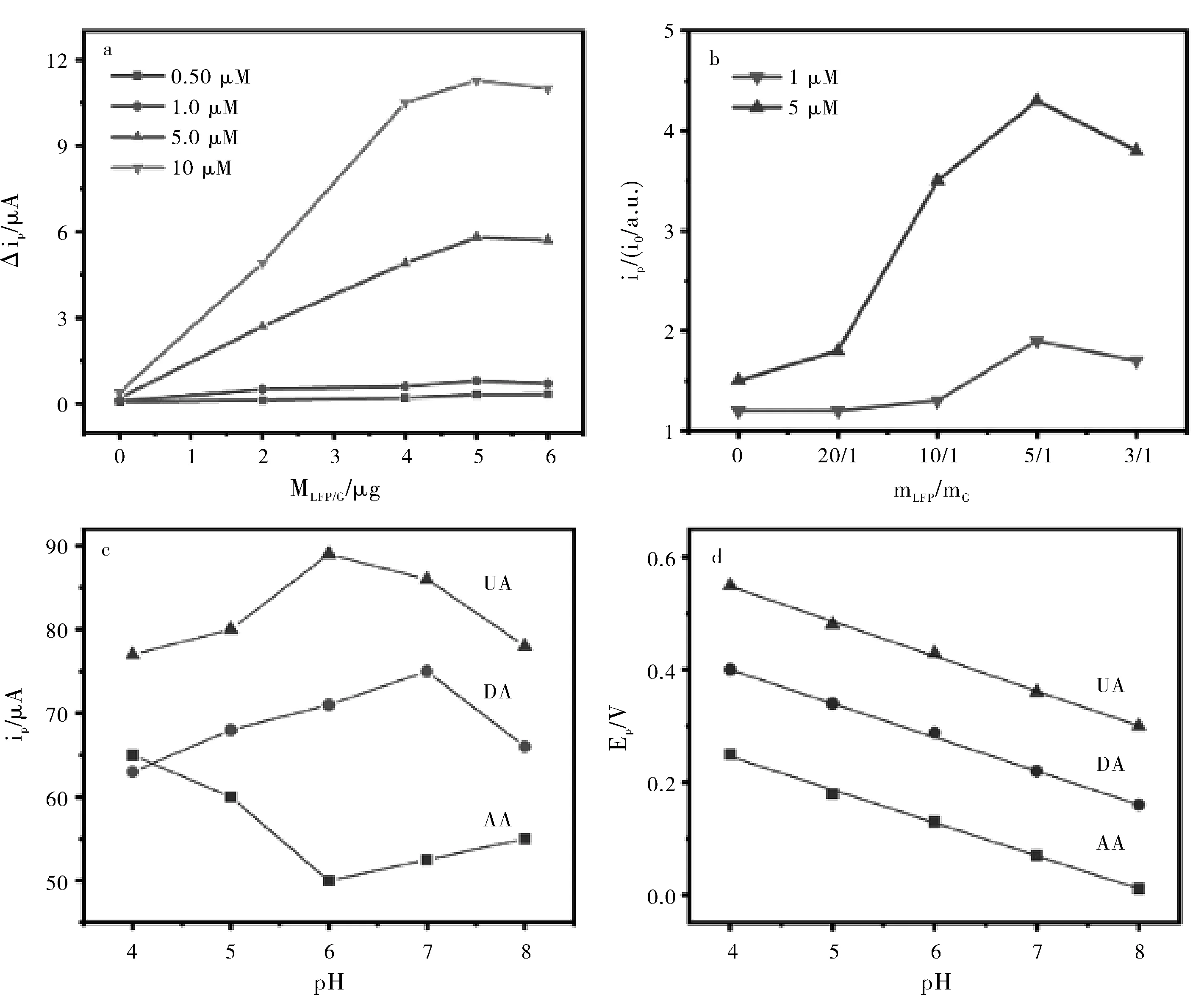
图4 不同负载量的LFP-G/GCE的△ip比较(a);不同比例的LFP-G/GCE的ip/i0(b);CV下电极在不同pH下的ip(c)和Ep(d)
2.3 LFP-G的形貌和结构
为了研究LFP的结构稳定性,我们观察了未处理(LFP)、空白PBS(LFPB)中用CV法处理100圈以及在含200 μM DA(LFPDA)的PBS中循环100圈的LFP粒子的形貌。从图5a的SEM可以看出,LFP呈短棒状,长度约为400 nm。在空白PBS和含有DA的PBS中的CV循环不会导致LFP的任何形态变化(图5b和图5c)。但是,在LFPDA上发现了一些物质,这可能是由于LFP对分析物的吸附行为造成的,氧化产物不能立即解吸。氧化产物的覆盖将占据分析物的吸附位置并抑制电流响应。
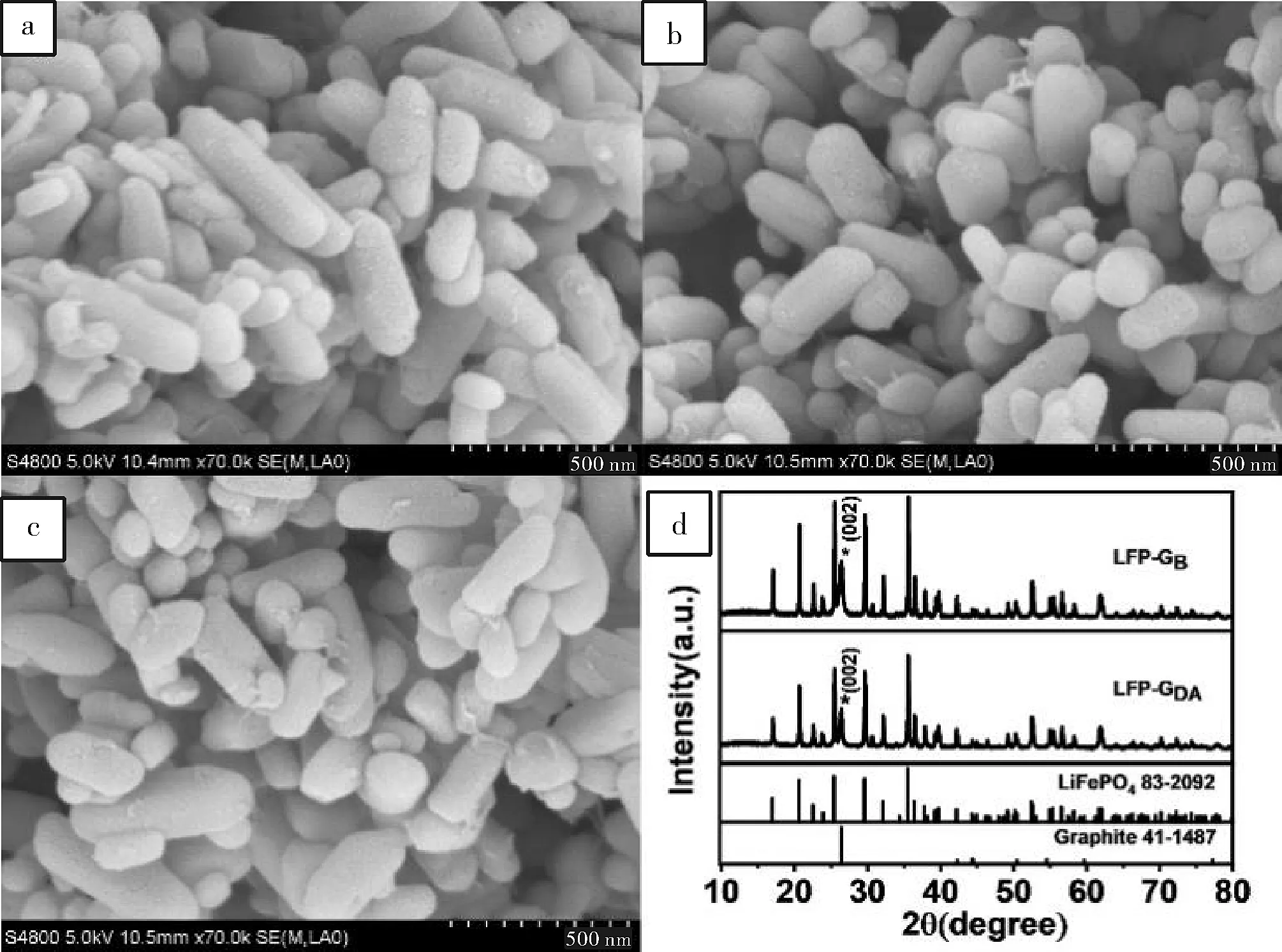
图5 LFP(a);LFP在空白PBS(LFPB)中用CV法处理100个循环(b);LFP在含有200 μM DA(LFPDA)的PBS中用CV法处理100个循环(c);LFP-GB和LFP-GDA的XRD图谱(d)
图5d中的X射线衍射(XRD)图谱显示了在PBS(LFP-GB)和含有DA(LFP-GDA)的PBS中CV 循环100次后LPF-G的晶体结构。两者的结构完全符合LFP(JCPDS No.83-2092)和石墨(JCPDS No.01-1260)的标准卡片。26.5°处的峰属于石墨的(002)晶面,其余为LFP。CV处理前后晶体结构无明显变化,说明LFP的结构稳定性较好。
利用X射线光电子能谱(XPS)分析了LFP、LFPB和LFPDA的表面组成和价态。由于自旋轨道耦合,Fe的2p轨道被分成两部分,图6a中,位于~710 eV和~724 eV处的峰分别属于Fe2+的Fe 2P3/2和Fe 2P1/2,而Fe3+具有较高的结合能,位于~712 eV和~726 eV处的峰属于Fe 2P3/2和Fe 2P1/2。在含DA的PBS中CV循环后,LFPDA中Fe3+含量增加。O1s光谱表明,LFPDA表面的氧含量高于LFP,这可能是DA氧化产物在LFPDA表面吸附所致。此外,DA氧化还原过程中Li+的损失也可能促进Fe2+氧化为Fe3+。Li 1s光谱也证实了这一结论(图6c)。Li+的损失可能加速DA在LFP表面的吸附。

图6 LFP、LFPB和LFPDA的XPS光谱
2.4 DPV法测定AA、DA和UA
采用DPV技术同时检测AA、DA和UA。在每次检测中,仅连续添加一种分析物,另外两种物质保持恒定。图7显示,AA、DA和UA的阳极峰分离良好,分别位于-0.035 V、~0.15 V和~0.29 V。图7a显示了AA在200.0~2000 μM范围内与5.0 μM DA和50 μM UA共存的DPV滴定曲线;图7c显示了DA在10.0 nM~200 μM范围内与0.50 mM AA和50 μM UA共存的DPV滴定曲线;图7e显示了UA在50.0 nM~400 μM范围内与0.50 mM AA和5.0 μM DA共存的DPV滴定曲线。图7b、图7d和图7f分别显示了峰值电流与AA、DA和UA浓度的线性关系。AA对应的线性方程为ip,AA=0.01012×cAA+22.94(R2=0.9916);DA为ip,DA=1.172×cDA+16.13(R2=0.9918),UA为ip,UA=0.1957×cDA+17.43(R2=0.9932)。检测限分别为156 μM、4.14 nM和0.186 μM(信噪比=3)。用LFP-G/GCE检测AA、DA和UA的结果与文献报道的结果进行了比较,总结在表1中。本研究所制备的电化学传感器不仅可以同时检测AA、DA和UA,而且与其他报道的结果相比,检测限也较低。

图7 0.1 M PBS(pH 7.0)对不同浓度AA(200.0~2000 μM),5.0 μM DA和50 μM UA的LFP-G/GCE的DPV曲线;不同浓度DA(10.0 nM~200 μM),500 μM AA和50 μM UA;以及(c)不同浓度UA(50.0 nM~400 μM),500 μM AA和5.0 μM DA的LFP-G/GCE的DPV曲线;线性关系ip和(d)AA,(e)DA和(f)UA的浓度

表1 不同生物传感器同时检测AA、DA和UA
2.5 LFP-G/GCE的选择性
血液和体液中除DA、UA、AA外,还含有多种离子、氨基酸等生物分子。用DPV和计时电流法(i-t)研究了不同物质的干扰。在Fe2+、Ca2+、Zn2+、Cl-、SO42-和葡萄糖、柠檬酸、叶酸、对乙酰氨基酚、甘氨酸、赖氨酸、丙氨酸、苏氨酸、间苯二酚等有机分子存在时,对DA、UA、AA的检测无明显干扰,邻苯二酚有轻微干扰(图8)。这种良好的选择性使LFP-G/GCE能够检测人体血清等真实样品中的AA、DA和UA。

图8 (a)LFP-G/GCE对甘氨酸、赖氨酸、丙氨酸、苏氨酸、间苯二酚、邻苯二酚、对乙酰氨基酚的选择性。在0.1 M磷酸盐缓冲液(pH 7.0)中添加700 μM AA(b);10.0 μM DA(c);20.0 μM UA和1 mM其它化学品(d)后LFP-G/GCE的安培曲线
2.6 人血清检测
人体血液经10000 rmp/分离心15 min后取上清液,用0.1 M PBS(pH 7.0)稀释50倍。首先检测稀释血清,观察LFP-G/GCE能否识别血清中的三种分析物。然后,在稀释血清中分别加入一定量的AA、DA和UA。检测结果的计算和汇总见表2和表S1。回收率在96.6%~103%之间,相对标准偏差小于4%。稀释血清中尿酸的浓度可检测为~7.52 μM,原血清中尿酸的浓度计算为375 μM,与人体内尿酸的正常水平相对应。

表2 人血清中AA、DA、UA的回收率
3 结 论
本文将商业磷酸铁锂(LFP)与导电剂石墨简单混合,改性GCE,实现了AA、DA和UA的高灵敏同时测定。LFP对三种分析物具有催化和吸附作用,提高了氧化还原峰电流,降低了检测限。同时检测时,LFP-G/GCE表面AA、DA和UA的线性范围较宽,检测限低于文献报道的结果。该传感器具有良好的选择性。此外,LFP-G/GCE可用于实际样品中UA的检测,人血清中UA的浓度计算为375 μM,同时人血清中AA和DA的回收率令人满意,表明LFP-G/GCE可用于临床分析。

