核受体HNF4α通过调控雄激素受体表达促进去势抵抗性前列腺癌进展
南方医科大学附属深圳龙华医院泌尿外科,广东 深圳 518109
目前,前列腺癌仍是威胁男性健康的重要因素,尤其是去势抵抗性前列腺癌(castration-resistant prostate cancer,CRPC),患者预后极差,临床尚无有效的治疗手段[1]。随着CRPC进展机制研究的不断深入,包括雄激素受体(androgen receptor,AR)在内的核受体这一类重要的转录因子的作用受到越来越多的关注[2]。
肝细胞核因子4α(hepatocyte nuclear factor 4α,HNF4α)属于没有配体或目前尚未发现配体的孤儿核受体亚家族成员,蛋白结构含有DNA结合结构域(DNA binding domain,DBD)和配体结构域(ligand binding domain,LBD),能够直接进入细胞核调控靶基因转录表达,从而调控机体的各项生理活动。HNF4α通常以二聚体形式与其顺式作用元件相结合,处于转录因子“调控网络”上游,广泛参与人体代谢过程的调节、细胞分化相关基因的表达调控等过程[3],与肿瘤的发生、发展密切相关。
有研究[4-5]发现,HNF4α在肝癌、胃癌、结直肠癌、胰腺癌和鼻咽癌等肿瘤组织中表达上调,表现为癌基因特征。但是HNF4α在前列腺癌中的作用及调控机制尚不清楚,本研究通过基于高通量测序的生物信息学分析HNF4α在不同类型前列腺癌组织中的表达水平,并且阐明这种表达水平的改变与前列腺癌患者总生存率的相关性,初步探讨其通过上调AR表达介导CRPC进展的作用机制。
1 材料和方法
1.1 材料
前列腺癌细胞系LNCaP购自美国模式培养物保藏所(American Type Culture Collection,ATCC),用含有10%胎牛血清(fetal bovine serum,FBS)的RPMI-1640培养基(美国Gibco公司)在37 ℃条件下培养。鼠抗人HNF4α单抗购自英国Abcam公司(货号:ab41898),兔抗人AR单抗购自英国Abcam公司(货号:ab108341),鼠抗人β-actin单抗购自英国Santa Cruz公司(货号:sc-47778),HNF4α基因(序列号:BC137539.1)的表达克隆购自美国亚利桑那州立大学。
1.2 方法
1.2.1 Oncomine数据分析
通过Oncomine(http://www.oncomine.org)分析基于癌症基因组图谱(The Cancer Genome Atlas,TCGA)数据库中前列腺癌临床样本和正常前列腺组织中HNF4α基因的mRNA表达水平[6]。分析参数包括:以HNF4α(NR2A1)为基因名称,以前列腺癌为分析对象,以癌症与正常组织中的表达水平作为分析类型。用于查询微阵列数据阈值:包括癌组织和正常组织之间的表达差异倍数>2,P<0.05。
1.2.2 cBioPortal分析
通过cBioPortal(https://www.cbioportal.org/)综合15个独立的前列腺癌研究的基因组数据、临床资料和患者数据等[6]。分析HNF4α在不同类型前列腺癌样本中的表达变异情况,以及HNF4α表达变异的肿瘤样本和无变异的肿瘤样本的总生存率。
1.2.3 HNF4α过表达载体构建
HNF4α基因通过聚合酶链反应(polymerase chain reaction,PCR)扩增获得全长cDNA,并将其克隆到慢病毒质粒pLenti-puro载体上进行过表达研究。将构建的pLenti-HNF4α质粒转染到HEK-293细胞中进行慢病毒包装制备(实验组),空的pLenti-puro载体包装作为阴性对照(对照组)。包装好的慢病毒经过分离纯化后用来感染LNCaP细胞。分别通过实时荧光定量PCR(real-time fluorescence quantitative PCR,RTFQ-PCR)和蛋白质印迹法(Western blot)检测HNF4α的表达。
1.2.4 RTFQ-PCR实验
采用TRIzol法提取细胞样品总RNA,脱氧核糖核酸酶Ⅰ(deoxyribonuclease Ⅰ,DNaseⅠ)处理后,用PrimeScript RTase和Oligo(dT)[PrimeScript RT Master Mix,宝生物工程(大连)有限公司]的混合物在37 ℃下温育15 min完成反转录cDNA合成,然后在85 ℃下5 s热灭活反转录酶(reverse transcriptase,RTase)。混合25 ng cDNA,100 nmol/L引物对和RTFQ-PCR试剂混合物[(SYBR Premix Ex Taq,ROX Plus,宝生物工程(大连)有限公司)]在实时PCR系统(StepOne,Applied Biosystems,US)中以95 ℃ 20 s进行PCR,随后再以95 ℃ 15 s、60 ℃20 s、72 ℃ 30 s为1个周期进行40次循环。
1.2.5 Western blot检测
采用RAPI 冷裂解缓冲液(含终浓度为1 mmol/L 的苯甲基磺酰氟)提取全细胞蛋白。采用十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecylsulphate polyacrylamide gel electrophoresis,SDS-PAGE)分离和转印到PVDF膜上,脱脂奶粉封闭后进行一级和二级抗体温育,随后用Western blot检测系统(美国Amersham公司)检测蛋白表达水平。
1.2.6 萤光素酶报告基因实验
构建包含HNF4α蛋白潜在结合位点的AR启动子区域PGL-4-AR载体,通过萤光素酶报告基因试剂盒[Renilla(货号:ab228546,英国Abcam公司)]测定萤光素酶活性[7]。
1.3 统计学处理
采用SPSS 13.0和GraphPad Prism 8.0软件对数据进行统计分析。定量资料进行单因素方差分析(One-way ANOVA),两组间差异采用t检验法分析。P<0.05为差异有统计学意义。
2 结果
2.1 HNF4α在前列腺癌组织中表达显著升高
Oncomine数据分析4个独立的基于高通量的测序研究[8-11],提取HNF4α基因mRNA表达的数据,分析发现相较于正常前列腺组织,HNF4α在前列腺癌临床样本中表达显著升高(P<0.05,图1)。
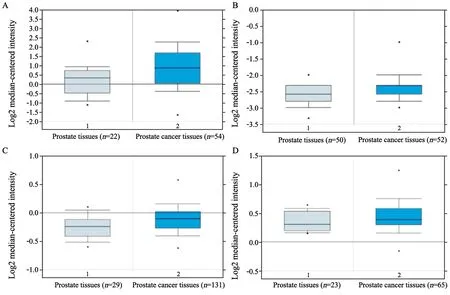
图1 HNF4α在前列腺癌组织中的表达水平分析Fig.1 The expression of HNF4α in prostate cancer tissues
2.2 HNF4α在不同前列腺癌类型中的表达及其对总生存率的影响
通过cBioPortal分析了15个独立研究中的4 153份样本,结果显示,在恶性程度更高的CRPC和神经内分泌前列腺癌(neuroendocrine prostate cancer,NEPC)中,HNF4α表达改变比例显著升高(图2A)。另外,HNF4α表达改变组的患者总生存率显著低于未改变组(图2B,P=0.000 6)。
2.3 HNF4α的外源表达促进了前列腺癌LNCaP细胞中AR的表达
通过构建HNF4α外源表达载体,特异性地上调前列腺癌LNCaP细胞中HNF4α的表达水平(图3A、B),分别通过RTFQ-PCR和Western blot检测AR mRNA表达和蛋白水平,结果显示,AR mRNA和蛋白的表达呈显著上调趋势(图3C、D)。
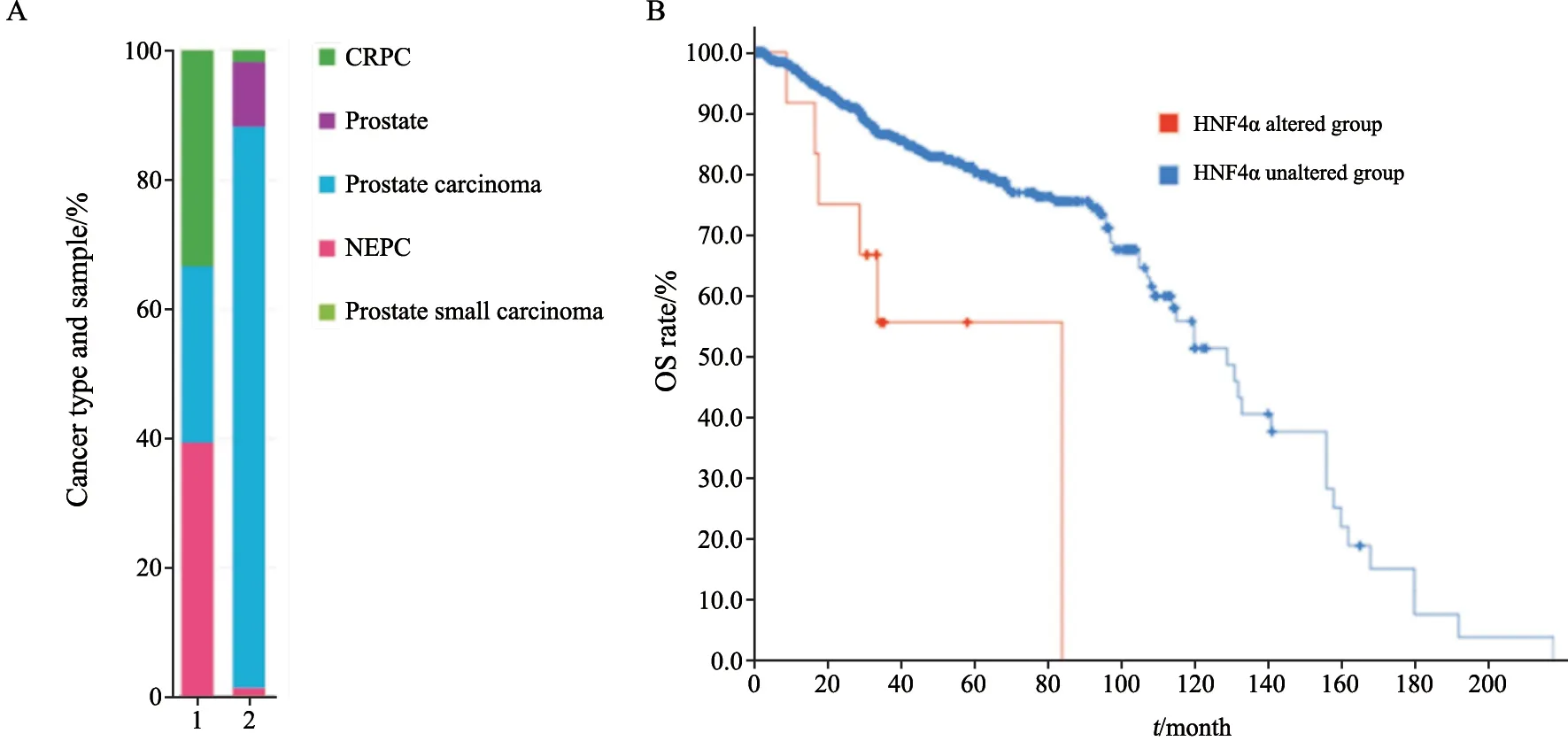
图2 HNF4α在不同前列腺癌类型中的表达及其对总生存率的影响Fig.2 The alteration of HNF4α in subtypes of prostate cancer and its effect on OS
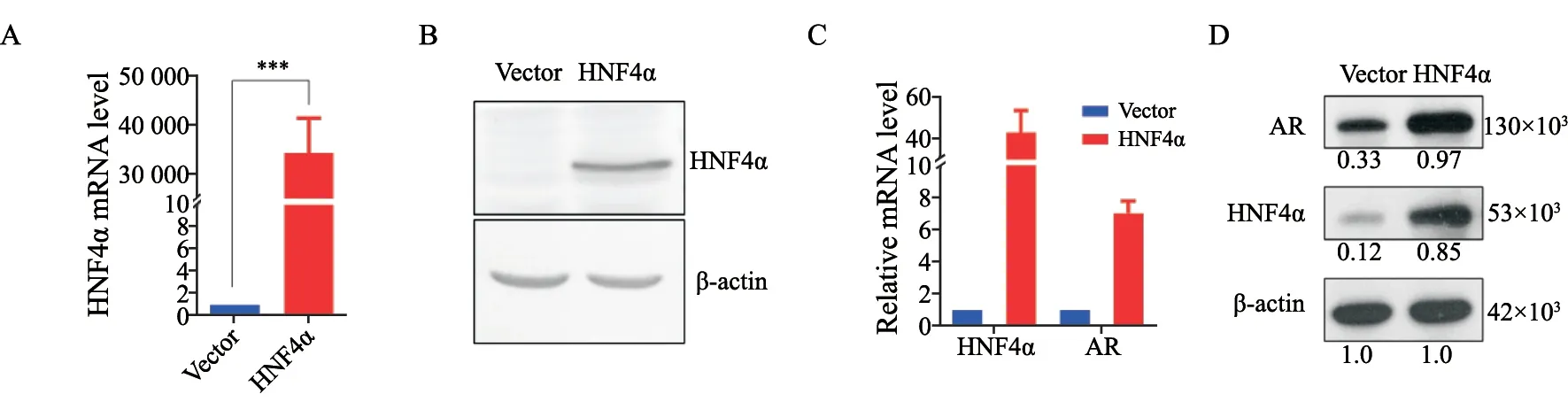
图3 HNF4α的外源表达促进了AR的表达水平Fig.3 Ectopic expression of HNF4α promoted the AR exresspin in LNCaP cells
2.4 HNF4α可能通过直接靶向AR启动子区域从而介导AR表达上调
通过基因序列分析发现,在AR基因的启动子区域存在潜在的HNF4α蛋白结合位点(5’-GGACTTTG-3’,图4A)。通过构建PGL-4萤光素酶报告载体进行分析,发现随着转染HNF4α表达质粒的增加,萤光素酶活性显著升高(图4B),表明HNF4α很可能通过直接靶向AR启动子区域从而介导AR基因表达上调。

图4 HNF4α启动子区域的萤光素酶报告基因分析Fig.4 Luciferase reporter assay of HNF4α promoter
3 讨 论
目前研究认为CRPC进展机制可概括为AR依赖型和AR非依赖型两种[12-13]。在所有的CRPC进展机制中AR信号通路的异常活化仍然在前列腺癌进展中起主导作用,阻断雄激素信号转导通路仍是一个重要的治疗手段[14],但是AR的异常活化机制尚未完全清楚。
本研究结合生物信息学分析阐明了HNF4α在前列腺癌临床样本中呈上调表达的特征,并且在恶性程度更高的CRPC及NEPC样本中,HNF4α表达上调的比例显著升高。因此,HNF4α可能在前列腺癌细胞中发挥着癌基因的功能,并与前列腺癌的恶性进展密切相关,与在肝癌、胃癌及结直肠癌中的发现相似。有研究[15]表明,HNF4α通过直接靶向CYP2B6和GSTK1基因的启动子,调控活性氧(reactive oxygen species,ROS)生成相关基因的表达,从而防止或减少结直肠癌细胞中自发性和5-FU化疗诱导的ROS生成。在鼻咽癌中HNF4α表达显著上调,通过靶向基质金属蛋白酶-14(matrix metalloproteinase-14,MMP-14)基因调控从而可以在体内外促进NB细胞的侵袭、转移和血管生成[16]。本研究在前列腺癌这一激素依赖型肿瘤LNCaP细胞中,发现HNF4α表达上调可促进AR基因的表达,并且很可能是通过直接靶向AR基因启动子区中的HNF4α结合位点(5’-GGACTTTG-3’)而发挥作用。
鉴于AR及AR信号转导通路在前列腺癌发生、发展及临床治疗过程中的重要作用,核受体HNF4α在AR异常表达及其信号激活过程中的作用机制值得深入研究,HNF4α有望成为前列腺癌新的治疗靶点。

