尿酸盐水解酶假基因在子痫前期胎盘组织的表达及其分子机制
李巍巍, 李彦姝
(1. 中国医科大学附属第一医院 产科, 辽宁 沈阳, 110001;2. 中国医科大学 细胞生物学实验室, 辽宁 沈阳, 110013)
子痫前期是一种以高血压、蛋白尿、水肿为特征的妊娠特异性疾病,严重威胁胎儿和孕妇的健康[1]。妊娠期高血压疾病的发病机制复杂[2], 目前观点认为子痫前期患者滋养层细胞增生及侵袭能力降低,进而导致胎盘浅着床,胎儿生长受限、胎盘早剥等不良妊娠结局[3]。长链非编码RNA (LncRNA)长度超过200个核苷酸[4], 参与细胞增殖、发育、运动和死亡等多种生物学过程,且在多种疾病中异常表达,与细胞凋亡、迁移和侵袭密切相关[5-6]。尿酸盐水解酶假基因(URAHP)是一种 LncRNA, 全长1 379 bp, 能够促进增殖并调控子痫前期水解酶的表达。本研究探讨URAHP在子痫前期胎盘组织中的异常表达及其对滋养层细胞增生、侵袭的影响,现报告如下。
1 材料与方法
1.1 临床资料
选取2018年12月—2019年9月中国医科大学附属第一医院产科住院患者6例为研究对象,其中PE组(实验)纳入子痫前期患者3例, Control组(对照)纳入正常妊娠孕妇3例,年龄24~36岁。纳入标准: 既往无高血压、糖尿病史患者。子痫前期诊断标准依据全国高等学校教材第9版《妇产科学》。选取3例子痫前期患者及3例正常妊娠孕妇的胎盘组织。本研究获得中国医科大学附属第一医院伦理委员会批准。
1.2 样本采集及试剂
待胎盘娩出后,于胎盘中央区域取胎盘组织,约1 cm×1 cm(避开钙化区域),置于EP管中,再于-80 ℃冰箱冻存。
胎牛血清、RPMI-1640培养基购自美国Waltham; In-Fusion试剂盒购自美国TakaraBio; 逆转录试剂购自日本Shiga; 荧光实时定量PCR(qRT-PCR)购买自美国Stratagene LaJolla, 特异性初级抗体(KISS1R和等负荷对照β-actin)、过氧化物酶结合的次级抗体购自美国Millipore, Billerica。
1.3 细胞培养
人绒毛膜癌JAR细胞系、JET-3细胞系、人滋养细胞HTR-8/SVneo系[购自美国模式培养物集存库(ATCC)]分别接种于含10%胎牛血清的RPMI-1640培养基,加入100 U/mL青霉素和100 μg/mL链霉素,在37 ℃、5%CO2培养箱中培养。
1.4 siRNA和质粒构建
在RNAi介导的敲除URAHP中, Invitrogen提供了3种不同的抗URAHP的小干扰RNA(siRNA)。其中, si-URA HP-1的转染效率最高, URAHP的靶序列为5′-UUAGUGCCACCAAAG CUGU-3′。 用In-Fusion试剂盒(TakaraBioUSA, Inc)构建了1个表达URAHP全长(1 379 bp)的质粒载体,命名为pCDNA-URAHP。 以1个空载体作为对照,构建了pGM2196-3×URAHP过表达慢病毒载体和pLenti-GFP-si-URAHP已知的慢病毒载体。
1.5 慢病毒制备
分别用pLenti-GFP-si-URAHP慢病毒载体、阴性对照载体瞬时转染HEK-293T细胞。待细胞密度达到80%浓度时,将质粒混合物转染到HEK-293T细胞中。 离心上清液, 48 h后浓缩病毒。 用病毒感染12孔板中的细胞,然后用普罗霉素(1.5 μg/mL)筛选,通过qRT-PCR分析鉴定感染细胞。
1.6 RNA提取与qRT-PCR分析
用TRIzol提取胎盘组织总RNA。根据说明,在6孔培养板中将人immortal line (HTR-8/SVneo)、人绒毛膜癌细胞系(JAR和JET-3)生长到细胞浓度70%。采用总RNA(500 ng)逆转录试剂盒(TaKARa, Shiga, 日本)进行逆转录; 用SYBR绿色染料扩增cDNA。在Mx3 000pTM实时PCR系统上,采用Agilent qRT-PCR法检测URAHP和内标β-actinTM的miRNA水平。这些基因的特异性引物信息,见表1。
1.7 免疫印迹法(western blot)
胎盘组织用冷磷酸盐缓冲液(PBS)洗涤,然后在含有蛋白酶抑制剂(PI)混合物的放射免疫沉淀分析(RIPA)溶解,通过SDS-PAGE分离细胞蛋白,然后将蛋白转移到聚偏氟乙烯(PVDF)膜上。用特异性初级抗体(KISS1R和等负荷对照β-肌动蛋白)和过氧化物酶结合的次级抗体检测细胞膜。用化学发光法对条带进行可视化。用Image J软件对western blot进行了密度分析,并将定量结果与加载对照进行标准化。
1.8 3D群形成
从培养皿中取出完整的培养基,用1×PBS冲洗细胞。 加入1 mL 0.25%胰蛋白酶1~2 min, 细胞移行良好,得到单细胞悬液; 200×g震荡5 min, 在完全培养基中重新培养细胞,然后计数细胞并将细胞浓度调整到30个细胞/mL。 将100 μL(30个细胞/mL)细胞全培养基置于96孔,圆底培养板均匀混合。培养1、3、7 d后,用相差显微镜和荧光显微镜观察细胞形态。
1.9 统计学分析
所有的统计分析均采用SPSS 19.0软件、GraphPad Prism V6.0软件。应用Studentt检验(双尾)评估细胞株中URAHP表达的统计学意义。P<0.05差异具有统计学意义。
2 结 果
2.1 URAHP在子痫前期胎盘中的上调作用
采用Arraystar人类LncRNA V4.0分析了Control组3例正常妊娠孕妇和PE组3例子痫前期患者胎盘中Lnc RNA和mRNA的表达(图1A、B)。 将Control组和PE组胎盘组织样品进行LncRNA分析,共检测到585个lncRNA在胎盘组织中表达(差异倍数≥1.5倍),其中有184个lncRNA高表达和491个lncRNA低表达。其中lncRNA URAHP高表达,通过qRT-PCR分析检测了URAHP(图1C), URAHP在PE胎盘中的水平约为正常Control组的4倍(P<0.01), 在滋养层细胞系HTR-8/SVneo和两个绒毛膜癌细胞系JAR和JET-3也检测到URAHP的表达。假基因URAHP在JAR、JET-3细胞系中的表达高于HTR-8/SVneo细胞系(图1D)。
2.2 基因共表达网络分析鉴定与URAHP相关基因
利用加权基因共表达网络分析(WGCNA)构建共表达网络,结果显示,共表达网络中鉴定了78个基因,并与URAHP的表达高度相关。绘制78个差异表达的基因热图(图2A), 其中上调基因25个,下调基因53个。7个基因(KISS1R、ALPP、DUSP1、RUNX2、TBX15、HBB、ACADVL)与子痫前期进展相关,并绘制基因热图(图2B)GO富集分析分析生物过程、细胞成分结果见图3。


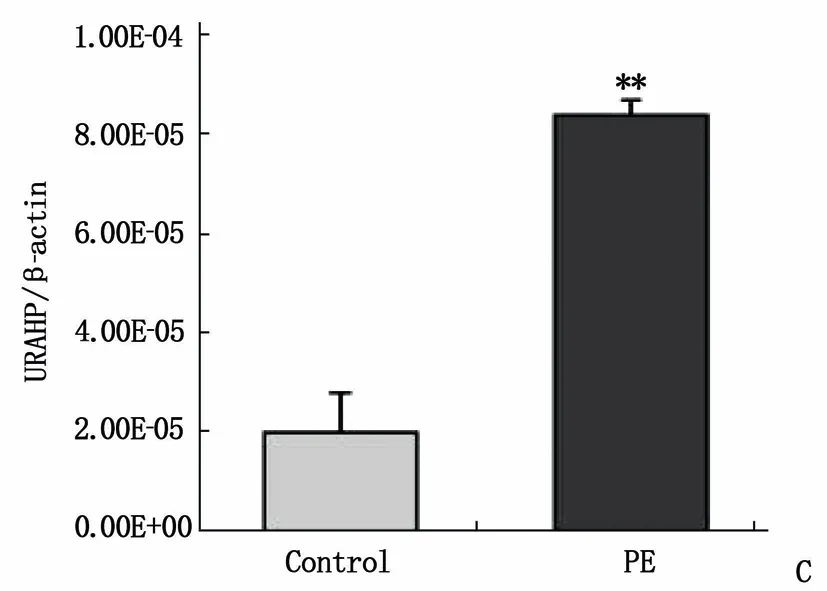

A: 子痫前期胎盘组织差异表达的lncRNA聚类分析图;B: 子痫前期胎盘组织差异表达的mRNA聚类分析图;C: URAHP在子痫前期、正常妊娠胎盘组织中的表达;与Control组比较, **P<0.01。D: URAHP在细胞系HTR-8/SVneo、JAR、JET-3的表达。与HTR-8/SVneo比较, *P<0.05, **P<0.01。
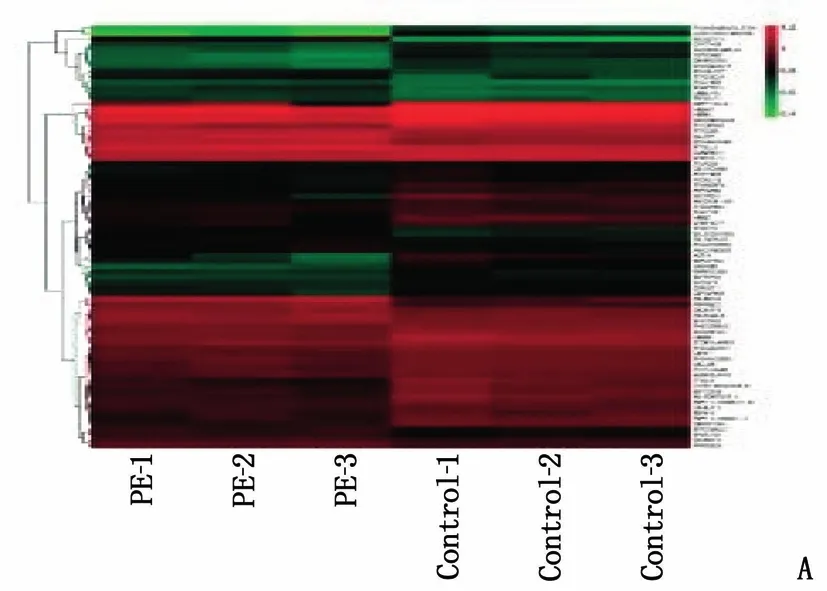

A: 78个差异表达的基因热图; B: 7个PE相关基因热图。

图3 Web基因本体注释图和GO富集分析图
2.3 URAHP促进滋养细胞增殖
以URAHP(SHRNA-URAHP)和URAHP过表达载体(OE-URAHP)为靶点,对其表达进行了调控。用OE-URAHP或空载体(Con)转染HT R-8/SVneo细胞,并用qRT-PCR测定URAHP mRNA的表达。结果表明,与Control组相比,转染OE-URAHP的细胞中URAHP表达显著升高(图4A)。 CCK-8试验表明与Control组比较, URAHP过表达促进了OE-URAHP组的细胞生长 (图4B)。

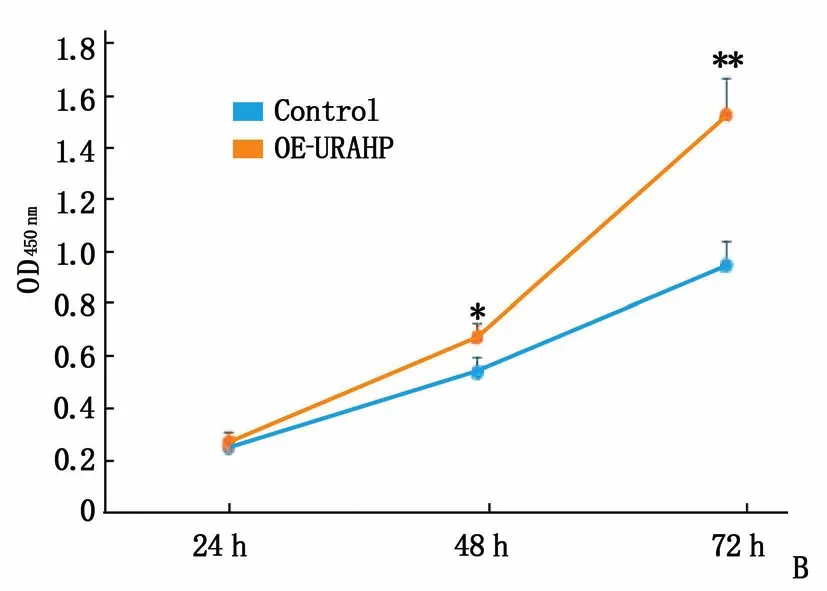
A: 转染OE-URAHP的HT R-8/SVneo细胞中URAHP的表达;与Control比较, **P<0.01。B: URAHP过表达对OE-URAHP组的细胞生长影响。与Control比较, *P<0.05, **P<0.01。
2.4 抑制绒毛膜癌细胞增殖
采用RNA干扰技术降低URAHP的表达水平。将shRNA-URAHP转染到人绒毛癌JAR和JET-3细胞系中。 结果表明,与NC组(阴性对照)相比, shRNA-URAHP对URAHP的表达有显著抑制作用(图5A、B)。 CCK-8检测表明,敲除URAHP显著抑制人绒毛癌JAR和JET-3细胞的增殖能力(图5C、D)。 同时,转染shRNA-URAHP的JAR和JET-3细胞的三维菌落大小显著小于NC组 (图5E、F)。
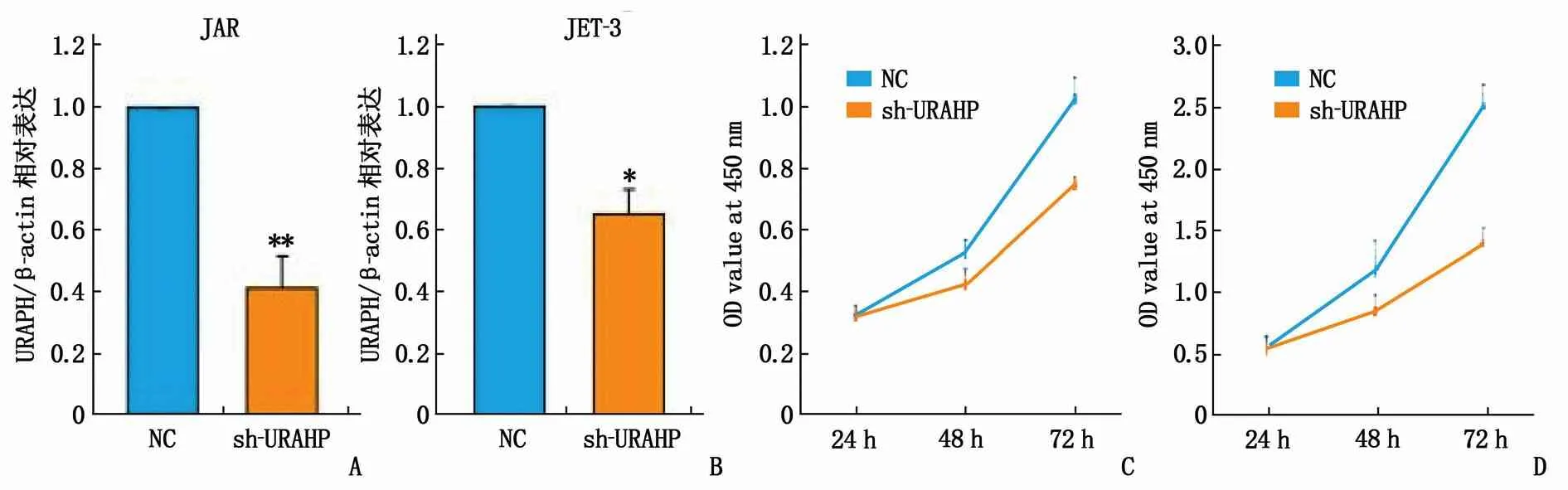

A: shRNA-URAHP转染至JAR细胞系对URAHP的表达的影响;与NC比较, **P<0.01。B: shRNA-URAHP转染至JET-3细胞系中对URAHP的表达的影响;与NC比较, *P<0.05。C: 敲低URAHP对JAR细胞增殖能力的影响; D: 敲低URAHP对JET-3细胞增殖能力的影响;E: 转染shRNA-URAHP对JAR细胞的影响; F: 转染shRNA-URAHP对JET-3细胞的影响。
2.5 KISS1R是URAHP在子痫前期胎盘中的共表达基因
Arraystar人类LncRNA V4.0鉴定出205个差异表达基因(DEGs), 其中56个上调, 149个下调。在共表达基因中, KISS1R、RUNX2、ALPP和PPP5C上调(折叠变化>3,P<0.05)。qRT-PCR和Western blot 检测显示, KISS1R在子痫前期胎盘中高表达(图6A、B)。URAHP过表达显著增加了JAR和JET-3细胞系中KISS1R mRNA和蛋白表达(图6C、D、E、F)。


A: KISS1R在子痫前期胎盘的mRNA表达; B: KISS1R在子痫前期胎盘的蛋白表达;C: URAHP过表达对JAR细胞系中KISS1R mRNA表达的影响;D: URAHP过表达对JET-3细胞系中KISS1R mRNA表达的影响;E: URAHP过表达对JAR细胞系中KISS1R蛋白表达的影响;F: URAHP过表达对JET-3细胞系中KISS1R蛋白表达的影响。与Control比较, *P<0.05, **P<0.01。
3 讨 论
随着测序技术的发展,假基因不断被发现[7]。目前研究[8]发现,许多假基因在基因表达、基因调控以及产生基因多样性等方面可能起到重要作用。假基因可调控基因表达,并且在心血管疾病、肿瘤等的发生发展中发挥重要作用。八聚体结合转录因子4 (OCT4) 作为POU转录因子家族的一员,可维持胚胎干细胞的多能性和自我更新[9]。PTEN基因为第一个具有磷酸酶活性的抑癌基因,参与调控细胞增殖、信号传导通路,在肿瘤发生和转移中发挥重要作用[10]。研究[11]发现,假基因在子痫前期的发生发展中也起着重要作用,如磷酸甘油激酶1、假基因2(PGK1P2)表达与蜕膜异常相关,可能导致子痫前期的发生。然而假基因的异常表达和致病机制在子痫前期中的作用尚未阐明。 因此,发现与子痫前期相关的关键假基因可有助于阐明子痫前期的发病机制。子痫前期、子痫发病源于胎盘。正常妊娠时,细胞滋养层细胞分化为绒毛滋养细胞、绒毛外滋养细胞,子痫前期绒毛外滋养细胞浸润能力受损,造成“胎盘浅着床”、子宫螺旋动脉重铸极其不足,因蜕膜层血管重铸,子宫螺旋动脉的管径仅为正常妊娠的1/2, 血管阻力增大,胎盘灌注减少,进而引发子痫前期、子痫。一些因子可通过调控滋养细胞层生理功能参与子痫前期、子痫的发生发展过程。
本研究通过微阵列发现,正常妊娠胎盘组织和子痫前期胎盘组织存在差异表达的LncRNA。假基因URAHP在子痫前期妇女胎盘组织中的表达显著增加。 通过qRT-PCR分析验证差异表达基因URAHP在体外的功能,发现了LncRNA URAHP在子痫前期胎盘和人绒毛膜癌细胞系(JAR和JET-3)中异常高表达。这些结果预测了URAHP的生物学作用,并表明URAHP与子痫前期的发生密切相关。URAHP可能在子痫前期发生中发挥关键作用,可调控人绒毛膜细胞系的功能,进而影响滋养细胞浸润能力以及影响胎盘着床。功能分析表明, URAHP下调改变了人绒毛膜癌JAR/JET-3细胞的增殖能力, URAHP的过表达促进人滋养细胞HTR-8/SVneo增殖。HTR-8/Svneo是科学研究中最常使用的人绒毛膜滋养层细胞, URAHP对其增殖能力具有影响,可推测URAHP在子痫发病(胎盘浅着床)过程中可能起到一定作用。但URAHP如何调控下游靶基因在子痫前期的作用机制有待进一步研究。
假基因可以与亲本基因或其他基因位点相互作用,导致其序列和/或转录活动的改变[12]。KAPUSTIN R V等[13]研究认为KISS1R在子痫前期胎盘组织表达下调,与子痫前期的发病存在相关性[14]。本研究发现,URAHP基因与KISS1R共表达一致,基因表达下调与子痫前期的发生有关,与KAPUSTIN R V等研究结果一致。作者将进一步研究URAHP调控GAS8的机制及URAHP的下游靶基因。
综上所述,本研究首次证明假基因URAHP可能与子痫前期发病有关,且其上调表达可能是导致滋养细胞生物学功能异常的关键启动子,这可为子痫前期的治疗提供理论依据。

