miR-142-3p靶向Wnt/β-链蛋白通路对结直肠癌细胞增殖的影响
彭俊付,王振彪,彭继升,王 锐,刘 超
结直肠癌(colorectal cancer, CRC)是人类致命的恶性肿瘤之一[1-2]。尽管在过去10年中,癌症筛查和治疗方法的改进使CRC的病死率有所下降,但其依旧是世界上癌症死亡的第3大原因,每年新发病例超100万,死亡病例60万,严重危害了人类的身体健康[3-4]。MicroRNAs(miRNAs)是长度为18~25个核苷酸的非编码小RNA,可直接与靶基因mRNAs的3'-非翻译区(3'-UTR)结合,导致目的基因降解或抑制目的基因编码蛋白的表达,从而调控目的基因的表达[5-6]。大量的研究表明,在CRC患者中,组织相关的miRNAs和循环miRNAs表达下调,其中包括miR-142-3p[7]。最近的证据表明,miR-142-3p在癌症、病毒感染、炎症和免疫耐受中具有重要作用[8]。已有研究表明,CRC患者肿瘤组织中miR-142-3p与健康人相比表达减少,并随肿瘤分化程度升高而降低,提示miR-142-3p在肿瘤的发生和癌症的预防中起着非常关键的作用[9]。Wnt/β-链蛋白(β-catenin)信号通路的过度活化常见于癌症患者,尤其是CRC[10-11]。Wnt/β-catenin信号通路在CRC中具有重要作用[10,12-13]。在乳腺癌的研究中,miR-142-3p可通过调节Wnt/β-catenin等通路调控肿瘤细胞的增殖、细胞周期进程、血管生成、侵袭和转移[14-15]。然而,miR-142-3p是否可调控CRC中Wnt/β-catenin信号通路仍未知。因此,本研究探讨分析miR-142-3p通过调节Wnt/β-catenin通路对CRC疾病进展的影响。
1 材料与方法
1.1一般资料 选取2018年1月—2020年10月首都医科大学附属北京世纪坛医院行根治术的66例CRC患者的肿瘤组织及其相邻正常组织(距离肿瘤组织>5 cm)。男31例,女35例;年龄(58.6±7.2)岁;结肠癌42例,直肠癌24例;TNM分期Ⅰ期14例,Ⅱ期45例,Ⅲ期7例。所有患者术前均没有接受过任何治疗。
1.2材料 正常人结肠上皮细胞NCM460、CRC细胞系HT29、LoVo、HCT116、Caco2、SW480细胞(ATCC,美国)。DMEM培养基(Invitrogen,美国)、FBS(Gibco,美国)、Lipofectamine 2000(Invitrogen,美国)、CCK-8试剂盒(碧云天,中国)、实时荧光定量PCR试剂盒(TaKaRa,日本)、蛋白浓度定量试剂盒(Thermo,美国)、兔抗人β-catenin(Abcam,美国)、兔抗人Cyclin D1(Abcam,美国)、兔抗人c-myc(Abcam,美国)、鼠抗人β-actin(Abcam,美国)、anti-Ki67-PE(Thermo,美国)、双荧光素酶报告系统(Promega,美国)。
1.3方法
1.3.1qRT-PCR:Trizol试剂提取组织和细胞的总RNA。反转录为cDNA,反向转录参数如下:95℃预变性2 min,95℃变性20 s,60℃退火20 s,72℃延伸20 s,共40个循环。以U6作为内参基因,miR-142-3p表达量采用2-ΔΔCt计算。实验重复3次,取平均值。引物序列见表1。

表1 miR-142-3p和U6基因的引物序列
1.3.2免疫蛋白印迹:经RIPA裂解提取总蛋白,经变性处理,10%分离胶进行SDS-PAGE电泳。将目的蛋白转至PVDF膜上,然后封闭1 h;加入一抗4℃孵育过夜,TBST清洗3次;加入二抗孵育1 h,TBST清洗3次;滴加显影液显影,采集图片,ImageJ 1.52v软件进行灰度值分析,以β-actin作为内参,比较灰度值。
1.3.3细胞转染:转染前24 h将Caco2、LoVo和HT29细胞接种于24孔板中,待细胞贴壁密度约80%。设计并合成miR-NC、miR-142-3p mimic的片段,使用opti-MEM分别稀释miR-NC、miR-142-3p mimic为20 μl,加入Lipofectamine 2000 10 μl,5 min内将稀释液混合作用20 min。然后分别将各组混合液加入孔板中混匀,加入无血清DMEM培养6 h,更换加有血清的培养基继续培养18 h,行功能实验。
1.3.4细胞增殖检测:应用CCK-8法进行检测,各组转染后的Caco2、LoVo和HT29细胞,以每孔5×103个细胞接种于96孔板中,分别培养24、48、72 h。每组设置3个复孔。培养结束后,每孔加入10 μl的CCK-8溶液,继续孵育4 h,经酶标仪测定吸光度值。实验重复3次。应用Ki67-流式细胞术检测细胞增殖:培养结束,收集各组细胞,将细胞用anti-Ki67-PE孵育30 min,上机检测。
1.3.5双荧光素酶报告系统:Caco2细胞以1.0×106/cm2铺板至6孔板中,待细胞贴壁密度约80%时,将100 ng WT-CTNNB1(β-catenin编码基因)或MUT-CTNNB1和miR-142-3p经Lipofectamine 2000共转染,检测各组荧光强度。

2 结果
2.1CRC患者组织中miR-142-3p表达水平 结果表明,与肿瘤相邻的正常组织相比,肿瘤组织miR-142-3p相对表达水平显著下降,差异有统计学意义(P<0.05)。见图1。
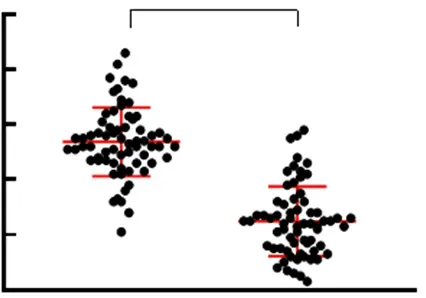
图1 结直肠癌患者正常组织和肿瘤组织中miR-142-3p表达水平
2.2CRC细胞系中miR-142-3表达水平 与正常人结肠上皮细胞NCM460相比,HT29、LoVo、HCT116、Caco2、SW480细胞中miR-142-3p表达水平显著降低,差异均有统计学意义(P<0.05)。见图2。

2.3CRC细胞系中β-catenin表达水平 免疫蛋白印迹检测CRC细胞系中β-catenin表达水平,检测结果显示,与正常人结肠上皮细胞NCM460相比,HT29、LoVo、HCT116、Caco2、SW480细胞中β-catenin表达水平显著升高,差异均有统计学意义(P<0.05)。见图3。
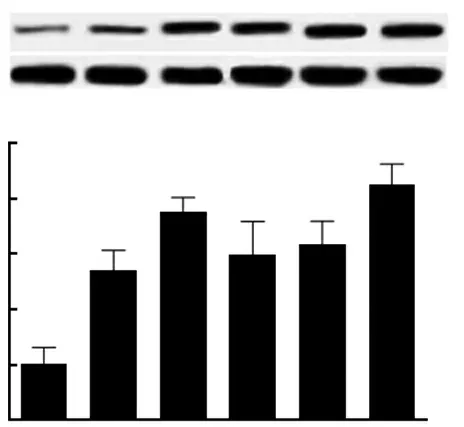
图3 结直肠癌细胞系中β-catenin表达水平
2.4过表达miR-142-3p对细胞增殖的影响 Caco2、LoVo和HT29细胞经转染后,胞内miR-143-3p表达量显著上调,差异有统计学意义(P<0.05)。见图4。并且,过表达miR-143-3p可显著抑制CRC细胞系Caco2、LoVo和HT29细胞的增殖,差异有统计学意义(P<0.05)。见图5。流式细胞术检测结果显示,过表达miR-143-3p可显著抑制CRC细胞系Caco2、LoVo和HT29的Ki67+细胞比例,差异有统计学意义(P<0.05)。见图6。
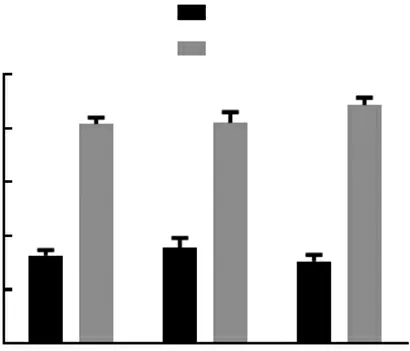
图4 转染miR-142-3p mimic后Caco2、LoVo和HT29细胞内miR-142-3p表达情况
2.5过表达miR-142-3p对Wnt/β-catenin信号通路的影响 与转染miR-NC相比,转染miR-143-3p mimic后,CRC细胞系Caco2、LoVo和HT29细胞内Wnt/β-catenin信号通路中β-catenin、c-myc和Cyclin D1表达量显著降低,差异有统计学意义(P<0.05)。见图7。

图5 CCK-8法检测过表达miR-142-3p对细胞增殖的影响
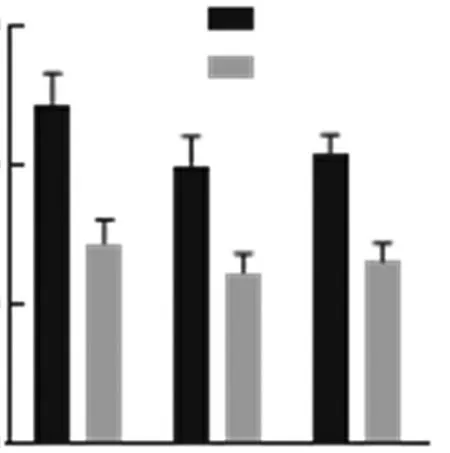
图6 流式细胞术检测过表达miR-142-3p对Ki67+细胞的影响
2.6miR-142-3p靶向调控β-catenin的表达 TargetScan软件预测miR-142-3p与β-catenin编码基因CTNNB1的3'-UTR存在互补位点,预测结果见图8。随后,构建WT-CTNNB1 3'-UTR和MUT-CTNNB1 3'-UTR质粒,分别与miR-NC、miR-142-3p共转染至Caco2细胞中,荧光素酶报告基因显示,只有转染miR-142-3p+WT细胞的荧光素酶活性显著降低(P<0.05)。见图9。
3 讨论
CRC是全世界公认严重危害人类身体健康的恶性肿瘤之一[16]。目前,手术、放化疗及免疫治疗是临床治疗CRC主要的手段。尽管一些治疗手段在一定程度上可延长患者生存期,改善预后,但癌症复发、转移和耐药给治疗策略带来了很大的挑战[17]。新兴的免疫治疗可选择性增强宿主对恶性疾病的免疫反应,是治疗恶性肿瘤重要的方式,但其使用也仅限于几种癌症[18]。
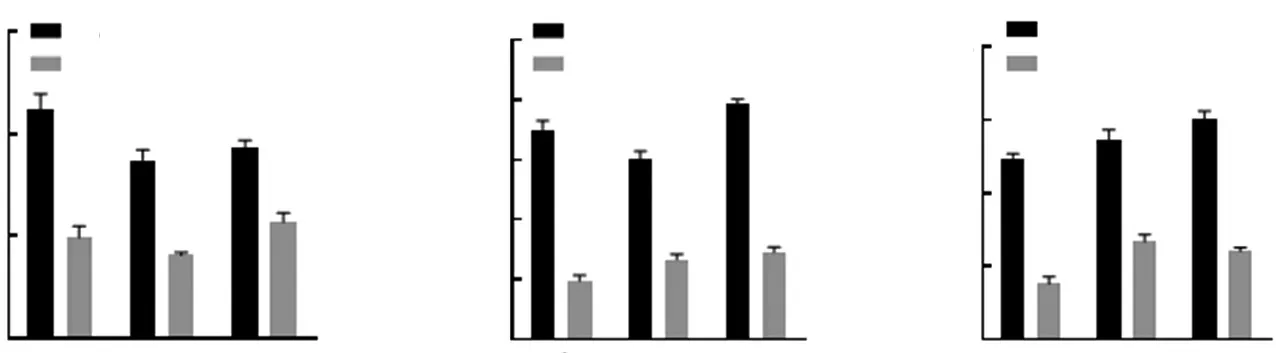
图7 过表达miR-142-3p对Wnt/β-catenin信号通路的影响
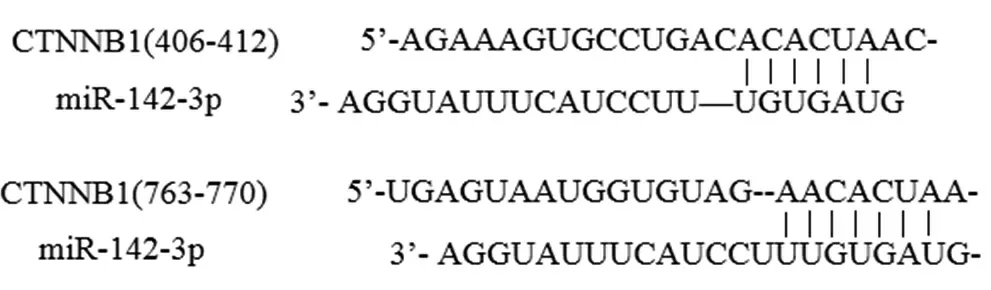
图8 TargetScan软件预测miR-142-3p与CTNNB1的结合位点
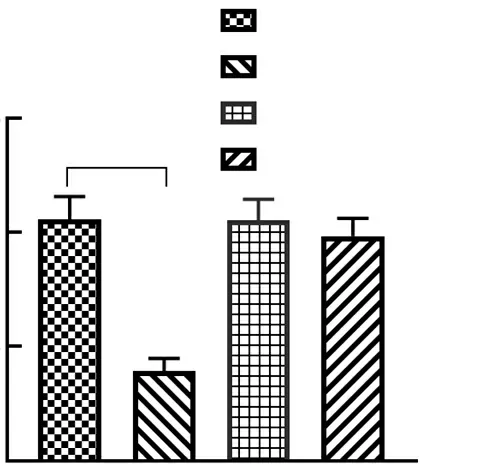
图9 双荧光素酶报告系统检测miR-142-3p靶向结合CTNNB1
越来越多的证据证实,miRNAs作为表观遗传调节因子可通过与靶基因的相互作用,影响不同的信号通路,在肿瘤的发生和癌症的预防中起着非常关键的作用[19-20]。在CRC中,miRNAs处于“失控”状态,其通过与多种癌基因和抑癌基因(APC、KRAS、p53等)相互作用,或通过调节下游信号通路,在CRC的发生和发展中起关键作用[21]。许多miRNAs已经成为治疗干预CRC潜在药物靶点,并可能成为大肠癌替代治疗的候选药物。
有研究发现,miR-142-3p在肿瘤的发生和发展中具有重要作用。如在体外miR-142-3p可靶向CDK4诱导细胞周期停止,降低体外细胞活力和集落形成;并且在裸鼠异种移植肿瘤模型中,miR-142-3p可显著抑制肿瘤的生长,使用其抑制剂后该效应则消失[22]。在另一项研究中发现,miR-142-3p表达降低,结肠癌分化程度低,并且肿瘤体积较大[23-24]。另外,转染miR-142-3p后可抑制CRC中Cyclin D1的表达,提高细胞对5-氟尿嘧啶(5-FU)的敏感性[25]。此外,最新的研究提出,血清中miR-142-3p具有作为CRC临床诊断和预后标志物的潜力[26]。本研究表明,miR-142-3p在CRC患者肿瘤组织和CRC细胞系中表达显著降低;经免疫蛋白印迹法检测CRC细胞系中β-catenin表达发现,HT29、LoVo、HCT116、Caco2、SW480细胞中β-catenin表达水平均显著性升高。而当转染miR-142-3p mimic后,Wnt/β-catenin信号通路中β-catenin、Cyclin D1、c-myc蛋白水平显著降低,CRC细胞系Caco2、LoVo和HT29细胞增殖活力显著降低。本研究结果与Troschel等[14]研究结果一致,提示miR-142-3p可抑制Wnt/β-catenin信号通路,在CRC中发挥抑癌的作用。本研究进一步经TargetScan生物信息学软件预测miR-142-3p与β-catenin编码基因CTNNB1的3'-UTR是否存在互补位点,结果显示,miR-142-3p具有两段能与CTNNB1特异性结合的序列。经进一步验证,miR-142-3p确实可与CTNNB1直接结合。上述结果表明,miR-142-3p可在转录后水平调节β-catenin编码基因CTNNB1的表达。
综上所述,miR-142-3p在CRC肿瘤组织和细胞系中低表达,且miR-142-3p可特异性结合CTNNB1基因,靶向Wnt/β-catenin信号通路,继而调控CRC细胞增殖。因此,miR-142-3p有望成为CRC的诊断标志物和治疗潜在的靶点。

