烟草青枯病菌拮抗细菌的筛选、鉴定和抑菌机制研究
冯印印,李 斌,杨 洋,何佶弦,安 航,闫芳芳,安德荣*
(1.西北农林科技大学植物保护学院/旱区作物逆境生物学国家重点实验室,杨凌 712100;2.中国烟草总公司四川省公司,成都 610000;3.四川省烟草公司宜宾市公司,宜宾 644000;4.四川省烟草公司广元市公司,广元 628000;5.四川省烟草公司攀枝花市公司,攀枝花 617000)
陕西汉中作为我国主要烟区之一,近年来受烟草青枯病影响严重,产量和质量都大幅度降低。烟草青枯病是由青枯雷尔氏菌Ralstoniasolanacearum烟草专化型引起的典型土传细菌性病害[1,2],在我国各大烟区均有不同程度的发生,近年来呈增长趋势。据统计,在2015 年青枯病发病面积达到8.7 万公顷左右,造成的经济损失约为 5.5 亿元[3]。青枯病的防治主要是铜制剂和农用抗生素等化学药剂[4],但化学药剂的持续性使用造成病原菌抗药性,环境污染等问题,严重影响了生态环境的可持续发展。随着农业科技的发展,生物防治成为防治植物病害的研究热门,被越来越多的科研工作者所重视。
芽胞杆菌因其抗逆性强、易于培养,作为生防菌株被广泛研究[5]。芽胞杆菌类生防菌通过竞争、分泌类植物激素、诱导植物抗性等方式抵御植物病害[6]。夏艳等[7]从不同烟田分离获得 3株对烟草青枯病菌有明显抑制作用的拮抗细菌,发现均具有产铁载体和吲哚乙酸(IAA)的能力,且温室促生、防治效果都较为显著。王超等[8]从烟草植株根围土壤及植株根内分离获得3株芽胞杆菌,对烟草青枯病的温室防效可达到80%以上。Lemessa和Zeller[9]筛选出6株对烟草青枯病拮抗效果好的菌株并进行温室植物试验,发现枯草芽胞菌株APF1和B2G显著降低了烟草植株的发病率,提高了植株产量。综上表明,利用拮抗细菌防治烟草青枯病具有良好的应用前景。但是,目前我国利用拮抗细菌防治烟草青枯病研究基础还比较薄弱,特别是高效菌种资源明显缺乏,且抑菌机理不甚明确。课题组通过采集不同生态环境中的土壤,意在发掘抗逆性更强、对植物病害防治效果更好的生防菌株。
本研究以青枯病菌为供试靶标,从运城盐湖湖岸边土壤中分离到一株对烟草青枯病菌有较好拮抗效果的细菌菌株,对该菌株进行了形态学、生理生化和分子生物学鉴定,确定其分类地位。进而对该菌株进行温室促生防病、抑菌谱、功能性代谢抗菌物质分析、无菌滤液稳定性及对青枯病的防治效果等研究,旨在初探拮抗细菌的抑菌机制,丰富青枯病菌拮抗细菌菌种资源,为优良生防菌株的进一步开发利用提供依据。
1 材料与方法
1.1 供试材料
从山西运城盐湖湖岸边共采集土样 38份。供试烟草“本氏”烟由陕西省汉中烟草研究所提供。供试菌株烟草青枯病菌Ralstoniasolanacearum R-2014保存于西北农林科技大学植物病毒与微生物资源实验室。
NA培养基:牛肉浸膏 3.0 g;蛋白胨 5.0 g;葡萄糖 2.5 g;琼脂 17.5 g;pH值 7.0±0.1;无菌水定容到1 L。
1.2 拮抗菌株的分离筛选
1.2.1 菌株的分离纯化 取山西运城盐湖采集的土样,参考陈太春等[10]的方法分离获得纯化细菌菌株。将纯化出来的菌株于NA固体培养基上采用平板划线法培养,36 h后置于4 ℃冰箱中保存备用。
1.2.2 拮抗菌株的初筛 拮抗细菌的初筛参照夏艳等[7]的方法。制备浓度为108CFU/mL的烟草青枯菌菌悬液,取1 mL加入50 ℃左右的LB固体培养基中,摇匀,倒置平板。待培养基凝固后,将1.2.1中的备用菌株点接于含菌平板上,每板测试4种菌,重复3次,置于28 ℃恒温培养箱中培养48 h,选取抑菌圈较大的菌株进行复筛。
1.2.3 拮抗菌株的复筛 将初筛获得的效果较好的拮抗菌接种于LB液体培养基中活化24 h,按照1%的体积移取到 LB液体培养基中在28 ℃、180 r/min振荡培养48 h即为发酵液。取发酵液在4 ℃、12000 r/min离心15 min,取上清液备用。同1.2.2倒制含青枯病菌平板,在水平位置均匀地放置2只无菌牛津杯(8 mm)。同时吸取0.15 mL拮抗菌株发酵上清液加入牛津杯中,每处理重复3次。置于28 ℃恒温培养箱培养48 h,用十字交叉法测量抑菌圈直径,取平均值。选取效果最佳的1株拮抗细菌,进行后续试验。
1.3 拮抗效果最佳菌株对青枯病菌形态的影响
通过初、复筛试验得到一株对青枯病菌拮抗效果最好的菌株FY-C。然后挑取青枯病菌和菌株FY-C分别在LB液体培养基中培养24 h,用LB液体培养基将其稀释至OD600=0.5。将菌株FY-C发酵液12000 r/min离心10 min后取上清,过0.22 μm细菌过滤器制得无菌滤液,按照1%的比例加入到100 mL青枯病菌的发酵液中,在28 ℃、180 r/min振荡培养24 h后取出用于后续试验。以未接种菌株FY-C无菌滤液为对照。参考高克祥等[11]试验方法制样并于透射电镜观察青枯病菌的形态特征变化。
1.4 菌株FY-C无菌滤液抗菌稳定性分析
研究不同温度(4 ℃,10 ℃,25 ℃,33 ℃,50 ℃和80 ℃)、pH(3,5,7,9和11)对菌株FY-C无菌滤液抗菌稳定性的影响。取菌株FY-C发酵液制得无菌滤液,将无菌滤液在不同温度、pH下处理2 h后,备用。制含OD600=0.5的青枯病菌平板,采用牛津杯法测定不同处理后菌株FY-C无菌滤液的活性,设置没有经过处理的无菌滤液为对照。
1.5 拮抗菌株的鉴定
对筛选到的拮抗效果最佳的菌株FY-C进行分类鉴定。参照《伯杰氏细菌系统鉴定手册》[12]与《常见细菌系统鉴定手册》[13]中的革兰氏染色、形态学与部分生理生化鉴定以及16S rDNA、gyrB 基因多基因位点联合分析鉴定目标菌株。采用CTAB法[14]提取菌株FY-C的 DNA,将其作为PCR反应的模板DNA,以通用引物 27 F(5′-AGAGTTTGATCCTGGCTCAG-3′)和 1492 R(5′-GGTTACCTTGTTACGACTT -3′)为上、下游引物,扩增菌株的 16S rDNA 基因,以 F(5′-AACGATTTTGCGGGCTGAG-3′)和 R (5′-GCGTA AACATCACGATTGAAGAC-3′)为上、下游引物,扩增菌株的gyrB基因。PCR 反应体系:模板1 μL、上下游引物各 1 μL、10×Buffer(with MgCl2)2.5 μL、10 mmol/L dNTP 1 μL、Taq酶 0.25 μL,补充 ddH2O至25 μL。PCR 反应条件为:95 ℃预变性5 min;94 ℃变性30 s;60 ℃退火30 s;72 ℃延伸50 s;35个循环;72 ℃延伸5 min;PCR产物经10 g/L琼脂糖凝胶电泳检测后,送上海生工进行序列测定,测序结果用BLAST 软件在GenBank进行同源性比较,并提交,获取注册登录号。采用Clustal X进行多序列比对后,用 MEGA 5.0的邻接法构建16S rDNA基因系统进化树,用最大似然法构建gyrB基因系统进化树,并进行1000次Bootstraps检测。
1.6 菌株FY-C的抑菌谱测定
利用实验室保存的病原真菌进行菌株FY-C的抑菌谱测定。将病原菌接种在PDA培养基上,培养5 d后用灭过菌的打孔器(φ=5 mm)在病原菌边缘打取菌饼,再将菌饼接种到PDA培养基的中心位置,采用平板对峙法在其四个方向等距离(d=3 cm)点接菌株FY-C,于28 ℃的恒温培养箱中进行培养,期间进行观察并及时记录。
1.7 对烟草苗的促生作用
将烟草种子用0.5%的次氯酸钠进行表面消毒30 min,无菌水漂洗3~4次,播种于灭菌过的基质土(基质﹕土=3﹕1)中。待烟草叶片为2叶真叶时进行菌株FY-C接种处理,采用灌根接种法,接种浓度为1×108CFU/mL,接种量为20 mL/株,每处理3盆,灌根LB液体培养基为对照处理。设3个重复,每隔7 d重复一次,共计3次。放置光照培养箱25 ℃,12 h黑白交替培养,观察烟草的生长情况,45 d后分别取处理组和对照组植株,抖去根部土壤,再用清水洗浄根表土壤,并用吸水纸吸干根表水分,分别统计株高,茎粗、整棵植株鲜重、干重。
1.8 菌株FY-C对烟草青枯病的防治效果
选择长势相似的烟草苗(2~3真叶)时,进行盆栽防治试验。设3个处理:1) 液体LB培养基;2) 接种菌株FY-C OD600=0.5;3)青枯灵1500倍。采用灌根法接种菌株′FY-C发酵液20 mL/株,以液体LB培养基为空白对照,以青枯灵1500倍为药剂对照。每处理设3次重复,每重复9株。5 d后,接种青枯病菌菌悬液(1×106CFU/mL),灌根接种5 mL/株,放置于温室28 ℃条件下培养。接种青枯菌一周以后每天观察植株生长、发病状况,计算发病率和病情指数。病情指数=100×∑(各级病株数×各级代表值)/(调查总株数×最高级代表值),防治效果(%)=(对照区病情指数-处理区病情指数)/对照区病情指数×100%。植株病情等级参照Kempe等[15]的方法。
1.9 菌株FY-C功能性代谢抗菌物质分析
1.9.1 产蛋白酶检测 将活化后的菌株FY-C采用点接的方法接种在酪蛋白培养基上,28 ℃恒温倒置培养3 d。用0.5%刚果红染液浸染1 h后去其染液,再用1 mol/L NaCl溶液反复冲洗3~5次,最后再静置30 min,若发现菌株FY-C的周围出现透明圈,则表明菌株具产蛋白酶的能力。
1.9.2 产纤维素酶的测定 将活化后的菌株FY-C采用点接的方法接种在CMC培养基上,其他方法同1.9.1,若在菌落周围有透明圈的出现,表现菌株FY-C具有产纤维素酶的能力。
1.9.3 生物膜检测 将菌株 FY-C接种到 LB液体培养基中,28 ℃、200 r/min,培养至对数期前期(OD600=1.0)。菌液离心后获得的菌体用新鲜的LB培养基洗涤一次,最后将其重悬于等体积的LB培养基中。向48孔细胞培养板的每孔中加入1 mL LB培养基,随后每孔接种0.1 mL上述制备的菌悬液,33 ℃静置培养24 h,观察菌株在LB培养基中的成膜情况。
1.10 数据统计与分析
试验数据统计分析采用 Excel 和SPSS 22.0软件,差异显著性检验法采用 Duncan氏新复极差法。
2 结果与分析
2.1 拮抗菌的分离与筛选
以青枯病菌为靶标,通过对运城盐湖土壤中拮抗菌的初筛和复筛,共分离筛选到6株对病原菌有稳定拮抗效果的拮抗菌株。如表1所示,菌株FY-C拮抗效果最好,牛津杯法测得抑菌圈直径是24.21 mm。综上,确定拮抗菌FY-C作为目的菌株进行下一步的研究。

表1 不同拮抗菌对青枯病菌的拮抗效果Table 1 The antagonistic effects of different antagonistic bacteria on R.solanacearum
2.2 菌株FY-C对青枯病菌形态的影响
用FY-C无菌滤液处理青枯病菌24 h后经透射电镜观察,结果如图1所示,正常生长的青枯病菌呈现长椭圆形,形状饱满且胞壁完整,而经过菌株FY-C无菌滤液处理后的青枯病菌的形态有非常明显的变化,细胞凹陷变形,菌体降解破裂,造成内容物外渗,有些细胞甚至完全降解。
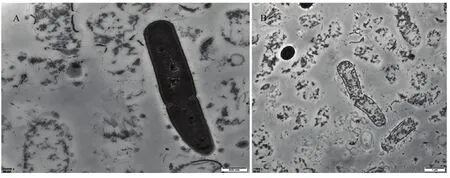
图1 透射电镜观察菌株FY-C对青枯病菌的影响Fig.1 TEM observation on the influence of strain FY-C on R.solanacearum
2.3 菌株FY-C无菌滤液抗菌稳定性研究
FY-C无菌滤液经不同温度处理后均有抗菌活性,当处理温度为25 ℃时,对青枯病菌抑菌活性最大,抑菌圈为19.3 mm;当处理温度为80 ℃ 时,抑制活性明显下降,但下降幅度小于15 %(图2A)。结果表明,菌株 FY-C无菌滤液中的抗菌物质具有很强的热稳定性。
FY-C无菌滤液经不同pH处理后均有抗菌活性,当处理pH为5时,对青枯病菌的抗菌活性最高,抑菌圈为20.1 mm;随着pH 值的升高,抑制活性下降,当处理pH为11时,抑制活性下降到最小,但下降幅度小于20%(图2B)。结果表明,菌株FY-C无菌滤液中的抗菌物质具有很强的酸碱稳定性。
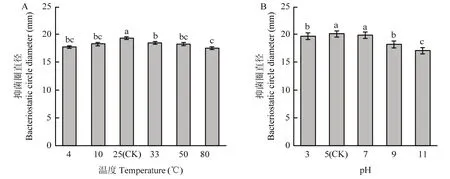
图2 不同处理对FY-C无菌滤液拮抗活性的影响Fig.2 Effect of different treatments on the antagonistic activity of FY-C sterile filtrate
2.4 拮抗菌FY-C的鉴定
2.4.1 形态学观察及生理生化测定 菌株FY-C在LB固体培养基上培养48 h后的形态呈现淡黄色椭圆形菌落,表面略有褶皱,周围无规则生长,革兰氏染色呈阳性;在扫描电镜下的形态:菌体呈杆状、单个或成对排列(图3)。生理生化测定结果显示,菌株FY-C革兰氏染色、甲基红测试、氧化酶反应为阳性,吲哚测试、硫化氢检测为阴性(表2),符合芽胞杆菌的生化代谢特征。
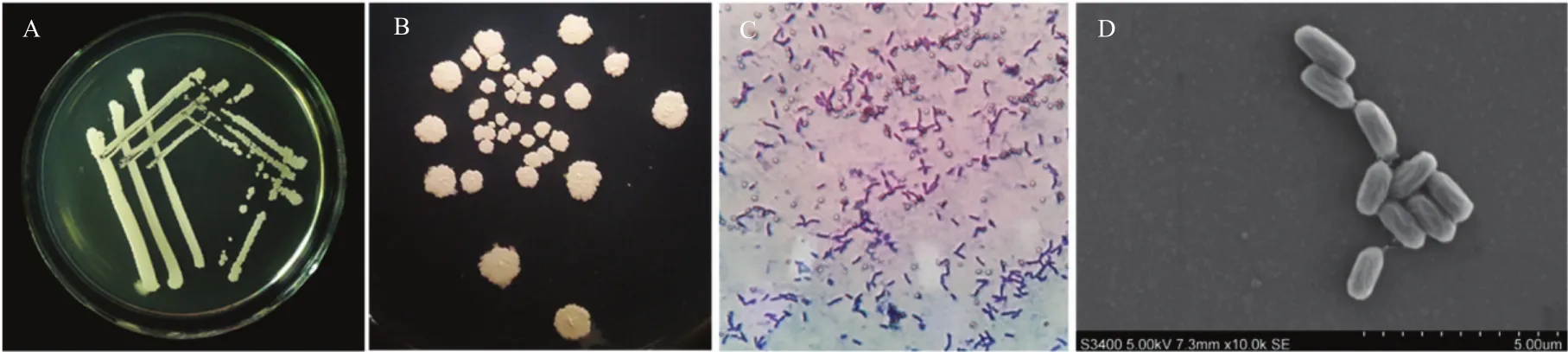
图3 菌株FY-C形态学鉴定Fig.3 Morphological identification of strain FY-C

表2 菌株FY-C部分生理生化特征Table 2 Some physiological and biochemical characteristics of strain FY-C
2.4.2 分子生物学鉴定结果 以拮抗菌株FY-C的基因组DNA为模板扩增16S rDNA、gyrB基因片段,分别得到1484、492 bp的PCR特征性条带。如图4所示,运用邻接法构建该菌株的16S rDNA序列系统发育树发现该菌株与暹罗芽胞杆菌B.siamensisKCTC 13613,和贝莱斯芽胞杆菌B.velezensisCR-502在一个分支上,无法确定该菌株的分类地位。如图5所示,运用最大似然法构建该菌株的gyrB序列系统发育树,发现该菌株与贝莱斯芽胞杆菌BS-37在一个分支上,结合形态学和生理生化特征,最终鉴定菌株FY-C为贝莱斯芽胞杆菌。

图4 基于16S rDNA序列构建的菌株FY-C系统发育树Fig.4 Phylogenetic tree of strain FY-C constructed based on 16S rDNA sequence
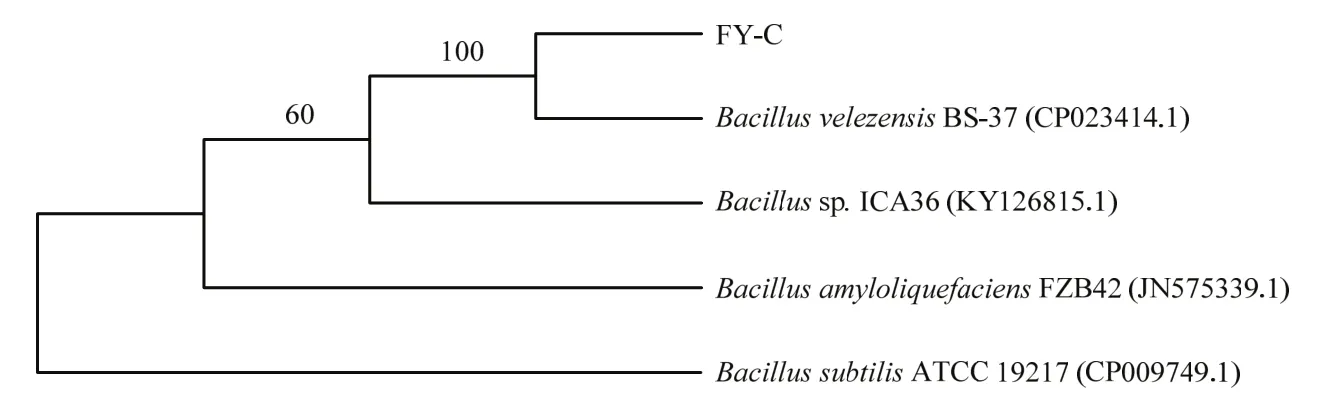
图5 基于gyrB序列构建的菌株FY-C系统发育树Fig.5 Phylogenetic tree of FY-C strain constructed based on gyrB gene sequence
2.5 菌株FY-C的抑菌谱测定
利用实验室保存的多种病原真菌和病原细菌对菌株FY-C进行抑菌谱检测结果表明,菌株FY-C对多种病原真菌具有显著拮抗作用,抑菌率50%~75 %,尤其对灰霉病菌的抑菌效果最佳,抑制率达到72.88%(表3)。但对试验的猕猴桃溃疡病菌无明显效果。
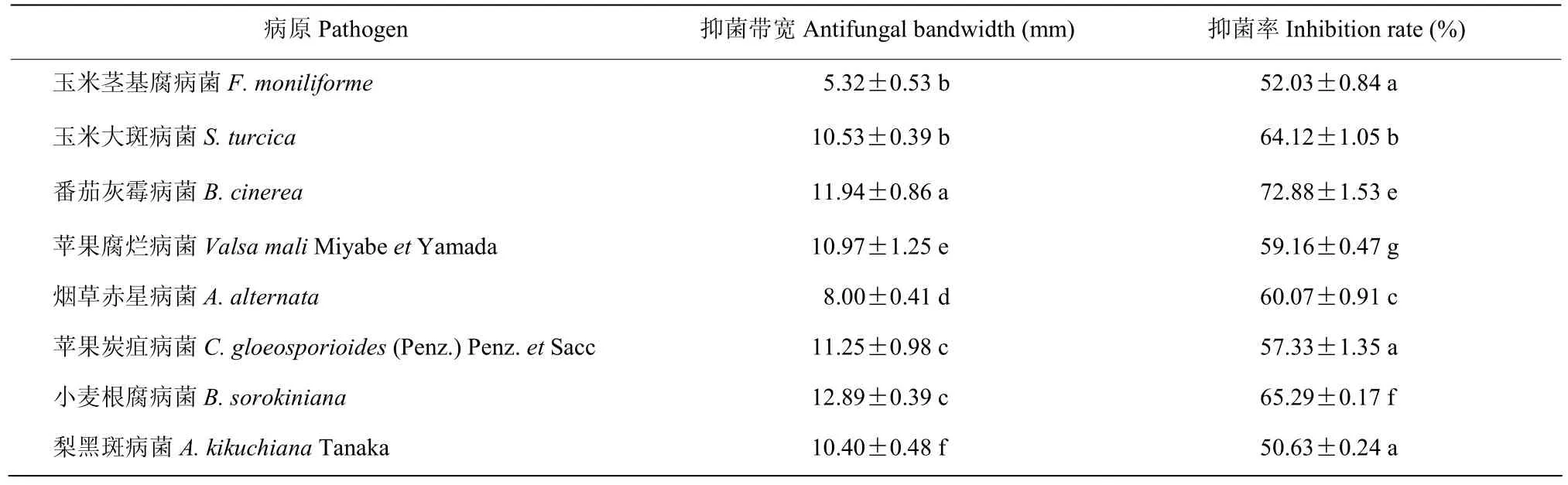
表3 菌株FY-C对供试病原菌的抑菌作用试验结果Table 3 Inhibitory effect against several fungal pathogens of strain FY-C
2.6 FY-C发酵液对烟草的促生效果
通过盆栽试验发现菌株FY-C发酵液对烟草灌根处理具有明显的促生效果,在接种FY-C发酵液处理45 d之后,烟草株高、茎粗、鲜重和干重等各项指标都显著高于CK处理。其中株高和鲜重较对照组增长最为明显,分别增长28.54%、24.90%(表4)。

表4 菌株FY-C发酵液对烟草生物量的影响Table 4 Effect processing of FY-C fermentation broth on tobacco biomass
2.7 菌株FY-C发酵液对烟草青枯病的防治效果
经菌株FY-C发酵液和青枯灵1500倍液分别预处理5 d后,接种青枯病菌的烟草植株上的发病率分别为30.12%和13.59%,对照处理发病率达到90.02%;经FY-C发酵液和青枯灵1500倍液处理后的烟苗病情指数分别为19.21和11.45,防治效果分别为59.74%和76.00%,表明菌株FY-C对烟草青枯病具有一定的防治效果(表5)。

表5 FY-C发酵液对烟草青枯病的防治结果Table 5 Control results of FY-C fermentation broth on tobacco bacterial wilt
2.8 菌株FY-C功能性代谢物
通过皿内培养试验结果(图6)发现,菌株FY-C能够在羧甲基纤维素钠平板和和酪蛋白平板上产生透明圈,说明菌株FY-C具有产纤维素酶和蛋白酶的能力;并且检测发现FY-C菌液能够在48孔板内静置培养24 h后形成结构紧密的生物膜,而研究发现细菌的生物膜形成能力是影响定殖能力的关键因素,这为菌株的定殖及其防治病害提供了理论基础。
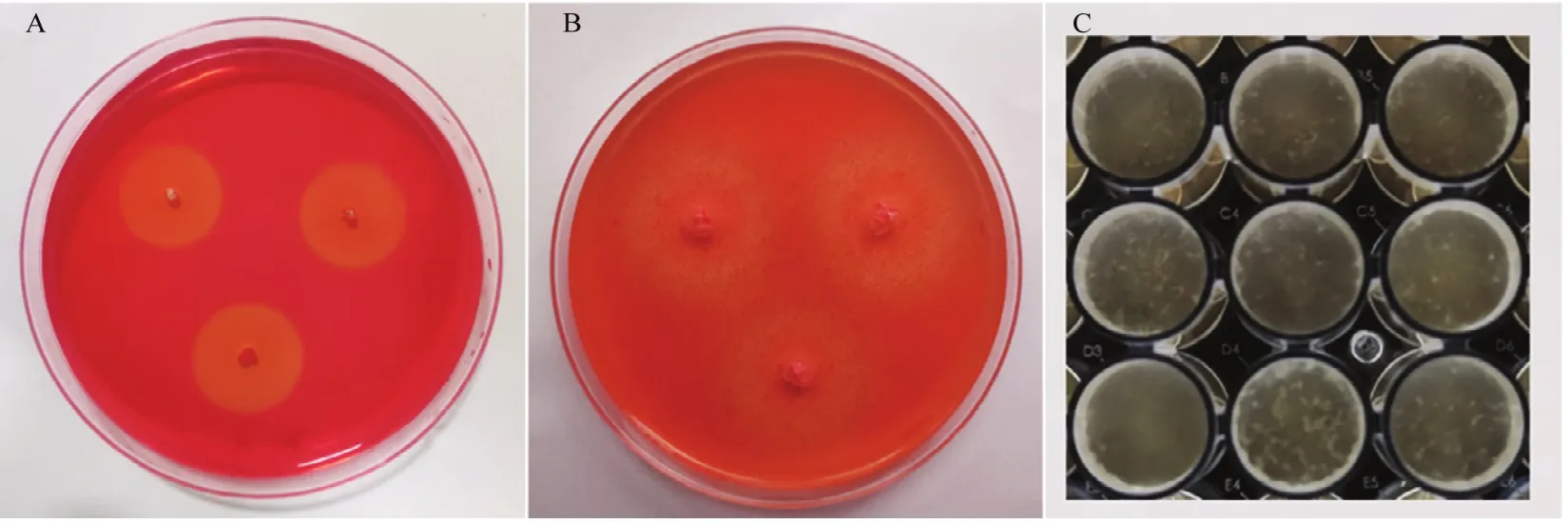
图6 菌株FY-C功能性代谢物检测Fig.6 FY-C strain functional metabolite detection
3 讨论
烟草青枯病作为一种细菌性土传病害,一直是烟草生产的重要病害之一。化学农药的过度使用不仅无法有效的防治青枯病,而且造成的环境污染问题亟需解决[16-18]。生物防治因其安全、无公害的特点,在农业科技发展的同时也在不断进步[19]。本研究筛选的对青枯雷尔氏菌具有较好拮抗作用的菌株FY-C分离自山西运城盐湖湖岸的土壤中,该菌对烟草青枯病原菌的抑菌圈直径可以达到 24.41 mm,高于张欣悦等[20]筛选的拮抗菌GZYCT-9的抑菌圈直径为18.90 mm,夏艳等[7]筛选的拮抗菌H19的抑菌圈直径为17.68 mm等研究效果相比,该菌抑菌效果较好。
关于生防菌株对青枯病菌形态的影响已有相关报道。在已报道的方法上进行改良,本研究通过扫描电镜观察发现贝莱斯芽胞杆菌FY-C无菌滤液处理青枯病菌可使胞质浓缩、胞壁降解、内容物外渗,说明FY-C产生的抗菌物质可直接作用青枯病菌,这与连玲丽等[21]的研究相吻合。通过对FY-C发酵液进行不同温度、pH处理,发现其对青枯病菌的拮抗效果无显著差异,与胡雪芹等[22]分离的拮抗菌的耐高温、耐酸碱性质相一致。
随着测序技术的发展,从先前只用16S rDNA/RNA序列单独构建系统树以确定筛选拮抗细菌菌株的分类地位到现在多基因位点联合分析,更能高效地鉴定菌株的分类地位[23-24]。本研究通过形态学、生理生化、16S rDNA与gyrB基因联合建树将菌株FY-C鉴定为贝莱斯芽胞杆菌。广谱抑菌试验发现,菌株FY-C能够对多种病原真菌菌丝造成不同程度的破坏,使其菌丝膨大畸形,无法正常生长,这为日后的生产应用提供了理论依据。
促生与防治相辅相成,通过温室盆栽试验检验了菌株FY-C能够促进烟草的生长,提高生物量,并且对烟草青枯病的防治也体现了较为不错的效果。芽胞杆菌能够分泌多种具有生物活性的代谢产物,包括脂肽类、蛋白类、多烯类、核酸类等[25-27]。本研究通过特定培养基检测出贝莱斯芽胞杆菌 FY-C能够分泌纤维素酶、蛋白酶等抗菌物质。细菌通过形成生物膜能够更好地在植物表面定殖,生物膜中的细菌通过共享环境中的营养物质和氧气,交流信息并作出相应的反应,具有比单细胞状态下更强的抗逆性[28],本研究在48孔细胞培养板上检测出菌株FY-C能够形成生物膜,这为后续的根际定殖提供了有力的理论基础。
综上,本文通过室内试验发现贝莱斯芽胞杆菌FY-C对烟草具有明显的的促生和防病效果,这说明该菌株具有开发的潜力;并对其抑菌机理进行了初探,为后续的研发与田间应用提供了理论基础。但不足之处是未进行大田试验,未考虑土壤、光照、湿度等综合因素对生防菌株造成的影响,后续试验仍需继续探究。

