真核表达产物Y3诱导烟草对烟草花叶病毒的抗性研究
张志云,边叶雨,黄 航,韩潇潇,吴 兰,吴丽萍
(南昌大学生命科学学院/南昌大学鄱阳湖环境与资源利用教育部重点实验室,南昌 330031)
烟草花叶病毒(Tobacco mosaic virus,TMV)是单链RNA病毒,感染烟草、辣椒等经济作物[1],化学农药作为当前控制病害发生的主要手段,对人体和环境都有很大的危害。目前,天然活性物质因其无公害、无污染、无残留等优点[2],而成为抗TMV药物研究热点,具有广阔的应用前景。
蛋白质是抗病毒生物活性物质之一。例如商陆[3]、多种食用菌(香菇、平菇、茶树菇和毛头鬼伞等)的抽提物[4]有钝化TMV的作用;超敏蛋白[5]、粉红单端孢菌体[6]中的蛋白激发子可使植物体内苯丙氨酸解氨酶(PAL)、过氧化物酶(POD)和多酚氧化酶(PPO)等酶活性增强;激发子Hrip1[7]、PevD1[8]、BDP-30[9]、GP-1[10]、PeaT1[11]都被证明可以诱导植物产生抗病性。由此可见,一些蛋白质在植物防御机制中起着关键作用。但目前商品化的抗病毒蛋白制剂品种少,不能满足农业生产上多品种、大规模的需求,因此有必要寻找更多具有抗病毒活性的蛋白质类制剂。
诱导子或激发子激活植物免疫系统,提高植物防御力,植物组织结构和细胞生理生化发生变化。由细胞壁、细胞间隙的产生木质素和胼胝质可以避免植物水分及营养的流失而抑制了病原的繁殖[12];同时也伴随着活性氧(ROS)、离子通量改变、水杨酸(salicylic acid,SA)积累、植物防御酶、防御基因激活等改变[13]。POD参与木质素的合成;PPO参与与酚类物质的氧化过程;PAL与SA的生物合成有关[14]。在SA信号转导途径中,NPR1编码的氧化还原敏感蛋白调控病程相关蛋白(pathogenesis-related protein,PR)的表达,β-1,3葡聚糖酶是PR家族的一员[15],最终激发系统获得性抗性(systemic acquired,SAR),也是SAR重要调控因子[16]。
Y3蛋白分离于毛头鬼伞Coprinuscomatus,分子量约为14.4 kD[16],浓度为2.0 μg/mL时,对TMV的抑制率为50%[18,19],其后获得了Y3cDNA序列及转基因烟草,转基因烟草也表现出一定的抗病毒活性[20]。且Y3能与TMV外壳蛋白(CP)互作[21]。前期研究表明Y3具有抗病毒活性,但在植物体内的抗病毒活性及其在植物系统抗性中的潜在作用却鲜有报道。
为了明确 Y3蛋白是否可诱导烟草产生抗病性及可能的作用机制,本研究利用毕赤酵母表达重组蛋白Y3,通过测定植物防御酶(PAL,POD,PPO,β-1,3葡聚糖酶)活性、防御基因(PR1-a,PR1-b,NPR1,PAL)表达水平,以探讨该蛋白处理后烟草对TMV的抗性,为后续Y3诱导烟草产生抗性的机制研究奠定基础。
1 材料与方法
1.1 试验材料
质粒pPIC-9k,毕赤酵母PichiapastorisGS115,大肠杆菌EscherichiacoliDH5α,普通烟Nicotiana tabacumK326种子均保存于本实验室,TMV保存于普通烟K326叶片,毛头鬼伞新鲜子实体购自福建农林大学菌草研究所。
限制性内切酶Not I、Bg1 Ⅱ、EcoR I、PrimerSTAR Max Premix购自TaKaRa公司;Gel Extraction Kit、Ultrapure RNA Kit、HiFiScript cDNA Synthesis Kit、DNA Purification Kit、pClone007 Versatile Simple Vertor Kit、PurePlasmid Maxi Kit均购自康为世纪有限公司;E.coli Ploly (A) Polymerase购于New England Biolabs,引物合成及测序由上海生工完成。无氨基氮源(YNB),生物素,遗传霉素(G418)购自索莱宝生物。
培养基配方。LB培养基:胰蛋白胨10 g/L、酵母浸粉5 g/L、NaCl 10 g/L;YPD培养基:酵母提取物10 g/L、蛋白胨20 g/L、葡萄糖20 g/L、琼脂20 g/L;MD培养基:YNB 13.4 g/L、葡萄糖20 g/L、生物素0.4 mg/L、琼脂15 g/L;MM培养基:YNB 13.4 g/L、甲醇5 mL/L、生物素0.4 mg/L、琼脂15 g/L。BMGY培养基:酵母提取物10 g/L、胰蛋白胨20 g/L、1.0%甘油、YNB 13.4 g/L、磷酸钾缓冲液100 mL、生物素0.4 mg/L;BMMY培养基:酵母提取物10 g/L、胰蛋白胨20 g/L、1.0%甲醇、YNB 13.4 g/L、磷酸钾缓冲液100 mL、生物素0.4 mg/L。
1.2 Y3 cDNA基因扩增
根据Y3cDNA (Accession:GQ859168)序列及pPIC-9K载体序列,设计特异性引物并加入酶切位点。Y3正向引物序列加入 EcoR I位点(用下划线表示):5′-CCGGAATTC ATGCATCATCACCATCAC CATATGATCTCCACCAAGATTTTCACC-3′,反向引物序列加入 Not I位点:5′-CCGGCGGCCGCTTAGAA GTCGGTGCTACAATCACCAT-3′。按照 Ultrapure RNA Kit说明书提取毛头鬼伞总 RNA,用 HiFiScript cDNA Synthesis Kit逆转录合成 cDNA 的第一条链,反应体系:6 μL RNA、2 μL Primer Mix、4 μL dNTP Mix、2 μL DTT、4 μL 5×RT Buffer、1 μL HiFi Script、1 μL RNase-Free Water,42 ℃ 40 min,85 ℃ 5 min。随后扩增Y3cDNA,PCR 反应体系:Primer STAR Max Premix (2×) 12.5 μL,10 μmol/L上下游引物各1 μL,cDNA 1 μL,ddH2O 9.5 μL。PCR 反应程序为 95 ℃ 3 min;95 ℃ 30 s,60 ℃ 30 s,72 ℃ 1 min,35个循环;72 ℃ 10 min。根据Gel Extraction Kit说明书将PCR产物胶回收,随后用DNA Purification Kit将胶回收产物进行纯化,根据大肠杆菌Ploly (A) Polymerase说明书加A尾,与pUC-T载体连接后形成载体pUC-T-Y3转化大肠杆菌DH5α感受态细胞,用氨苄青霉素(ampicillin,Amp,50 mg/mL)进行筛选,菌液经PCR鉴定后送上海生工测序。
1.3 重组表达载体pPIC-9k-Y3的构建及毕赤酵母GS115的转化
根据PurePlasmid Maxi Kit说明书提取质粒pUC-T-Y3,用EcoR I和Not I将pUC-T-Y3质粒进行酶切,获得携带酶切位点的基因Y3后,用T4 DNA连接酶将Y3cDNA与相同酶切处理的pPIC-9k载体连接后转入大肠杆菌DH5α感受态细胞中,对生长在LB固体培养基(含氨苄青霉素100 mg/mL,卡那霉素Kana 50 mg/mL)上的菌落进行双酶切鉴定和测序,用以验证重组质粒pPIC-9k-Y3构建是否成功。
用Bg1 Ⅱ线性化处理重组质粒pPIC-9k-Y3后将其电转化入酵母GS115感受态细胞中(1.5 KV,25 μF,200 Ω),同时电转同样酶切处理的空载体pPIC-9k为阴性对照。细胞培养1 h (28 ℃、150 r/min) 后,涂布于 MD固体培养基上,28 ℃ 培养 2~3 d,挑取单菌落接种到 MM、MD 以及含遗传霉素 G418(Geneticin)浓度为1、2、3和4 mg/mL的 YPD平板上,筛选甲醇利用高拷贝型转化子。在 4 mg/mL G418-YPD平板上生长良好的菌株为高拷贝型。挑取高拷贝型单菌落接种到含的300 μL YPD液体培养基(氨苄青霉素100 mg/mL,卡那霉素50 mg/mL)的1.5 mL离心管中,28 ℃、150 r/min振荡培养1 h,13000 r/min离心3 min,收集菌体,用0.01 mol/L PBS和蒸馏水洗涤菌体,13000 r/min离心3 min后重悬于0.02 mol/L NaOH,沸水浴5 min,液氮速冻30 s,反复煮冻3次,最后一次用沸水煮5 min以裂解酵母。以裂解的菌体为PCR反应的模板,进行PCR鉴定以筛选阳性转化子。
1.4 Y3重组蛋白诱导表达与鉴定
挑取上述阳性转化子于5 mL YPD培养基中,28 ℃、250 r/min摇床培养12~14 h取1 mL接种于50 mL BMGY液体培养基中,28 ℃、250 r/min条件下培养16~18 h,至OD600为2.0~6.0;4000 r/min离心10 min收集菌体,重悬于10 mL的BMMY液体培养基,转至300 mL BMMY液体培养基中28 ℃、250 r/min摇床培养 5~7 d,每隔 24 h添加 1%甲醇[22]。培养 7 d后收集菌液,取 10 μL上清进行SDS-PAGE。抗His标签兔多克隆抗体为一抗,山羊抗兔IgG (H+L)为二抗,进行Western-blot分析检测蛋白的表达情况。
1.5 表达产物Y3对烟草的诱导抗病性效果检测
1.5.1 Y3诱导烟草防御相关酶活性测定 普通烟K326播种于营养土中,在温室(25 ℃~30 ℃)中光照16 h,黑暗8 h培养,至8~9叶期时进行试验。对照组(H2O+TMV):喷洒清水;实验组(EP+TMV):喷洒浓度为300 μg/mL空质粒(pPIC-9k)菌株诱导上清1 mL于烟草叶片;实验组(EY3+TMV):喷洒1 mL 300 μg/mL Y3蛋白诱导上清。处理叶片为每株烟草的下位两片烟叶,在24 h后在处理烟叶上摩擦接种TMV[23],1 g带TMV的普通烟K326病叶于10 mL 0.01 moL/L PBS (pH=7.2) 缓冲液中研磨,四层纱布过滤。各处理5株,重复3次。分别在试验处理后1、3、5、7、9 d[24],采集处理叶上位叶,液氮速冻后于-80 ℃冷冻保存。
采用BCA (bicinchoninic acid)法测定总蛋白;分别用PPO、PAL、POD试剂盒根据说明书测定各时期酶活性变化(BCA,酶活试剂盒均购于南京建成生物工程研究所);PAL在OD290以每毫克蛋白每分钟变化0.1为一个酶活力单位,PPO在OD420每毫克蛋白变化0.01为一个酶活力单位,POD以每毫克蛋白催化1 μg底物为一个酶活力单位。β-1,3葡聚糖酶活性测定采用赵凯等[25]的方法。每处理3次重复。
1.5.2 烟草病情调查 1.5.1相同处理后第 20 d进行烟草花叶病调查,并参照烟草病害分级标准(GB/T23222)对其病情进行分级[26]。
1.5.3 Y3诱导烟草抗病相关基因分析 按Ultrapure RNA Kit说明书提取烟草总RNA,用HiFiScript cDNA Synthesis Kit逆转录合成cDNA第一条链,以β-actin为内参基因,分别以PR1a、PR1b、NPR1、PAL抗病相关基因特异引物进行PCR。PCR反应体系:cDNA 2 μL,10 μmol/L上下游引物各0.4 μL,SYBR Premix ExTaq10 μL,用ddH2O补足至20 μL;PCR反应程序:95 ℃ 3 min ;95 ℃ 30 s,60 ℃ 30 s,72 ℃ 1 min,40个循环。每处理3重复。
表1 qRT-PCR引物Table 1 The primers in qRT-PCR
1.6 数据统计与分析
利用SPSS25.0单因素ANOVA检验方差分析,显著性分析使用最小显著性差异LSD和沃勒-邓肯(W)法,用Origin软件作图。荧光定量数据根据Ct值计算出相对表达量,计算公式如下:目的基因相对表达量=2-△△Ct,△△Ct=[(Ct目的基因-Ct内参基因)处理组-(Ct目的基因-Ct内参基因)对照组]。
2 结果与分析
2.1 Y3 cDNA克隆与重组表达载体pPIC-9k-Y3的双酶切验证
经1.0%琼脂糖凝胶电泳,PCR扩增获得Y3cDNA约400 bp (图1A);重组质粒pUC-T-Y3的菌液PCR约400 bp (图1B)。测序结果与NCBI上已提交的Y3蛋白序列(Accession:AEE87275)进行BLAST比对,同源性为96%,表明Y3cDNA已成功插入pUC-T载体中,pUC-T-Y3与pPIC-9K质粒分别经EcoRⅠ、NotⅠ双酶切,获得2个片段分别为400和9300 bp,其中400 bp为Y3cDNA,9300 bp与pPIC9K质粒大小一致(图2),表明成功构建重组质粒 pPIC-9k-Y3。
图1 Y3基因扩增与鉴定Fig.1 Amplification and identification of Y3 gene
图2 重组质粒pPIC-9k-Y3双酶切Fig.2 Double digestion of recombinant plasmid pPIC-9k-Y3
2.2 重组蛋白的诱导表达及Western-blot检测
取诱导5、6、7 d的空质粒pPIC9K和重组蛋白菌液进行SDS-PAGE电泳(图3A)。泳道1~3在约16 kD处均有单一条带,且第6 d时效果较好。取甲醇诱导第6 d培养液上清,经SDS-PAGE后进行Western-blot检测,在16 kD处有单一条带(图3B)表明Y3重组蛋白已经成功表达。
图3 重组蛋白表达产物SDS-PAGE及Western-blot分析Fig.3 SDS-PAGE and Western-blot analysis of recombinant protein expression product
2.3 重组蛋白Y3抗TMV效果分析
2.3.1 Y3诱导烟草抗性相关酶活性 重组蛋白Y3对烟草抗病相关酶的影响表明,β-1,3葡聚糖酶活性逐渐下降,在1~5 d内Y3处理组始终显著低于清水处理组(P<0.05);对PPO、PAL有升高作用,但差异不显著(P>0.05)。喷施重组蛋白Y3 1 d后接种TMV,PPO和PAL活性分别在24 h、3 d达到最大,随后保持相对稳定;POD酶活性在1 d内达到最大(图4)。
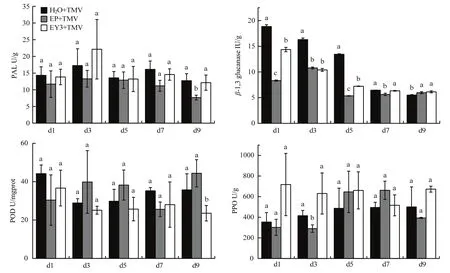
图4 Y3诱导烟草抗性相关酶活性结果Fig.4 Activity changes of resistance-related enzyme in tobacco treated with Y3
2.3.2 Y3提高烟草抗性相关基因转录水平 对5个基因进行PCR扩增,经琼脂糖凝胶电泳检测,条带单一且与预期相符(图5),符合qRT-PCR扩增标准。
图5 琼脂糖凝胶电泳检测引物特异性Fig.5 Gel-lectrophoresis of primers
蛋白Y3诱导烟草叶片抗性相关基因表达qRT-PCR结果显示,NPR1表达量总体下降,但高于对照组的表达量。PAL基因在第3 d时骤增,PAL基因与SA的合成相关,表明SA合成。PR1-a在Y3处理1 d后诱导表达,但表达量与对照组相差不大。对照组中PR1-b表达量逐渐降低,而喷施蛋白Y3后第1 d时,表达量达到最高,同时含空质粒 pPIC-9k酵母菌也会诱导PR1-a、PR1-b基因的表达量升高。Y3处理后与对照相比,PAL和NPR1表达量差异显著(P<0.05),PR1-b除第3 d外,表达量始终显著高于清水处理组(P<0.05),而PR1-a差异不显著(P>0.05)。Y3对PR1-a的诱导升高作用不明显,但能显著诱导NPR1、PAL、PR1-b表达量升高(图6)。
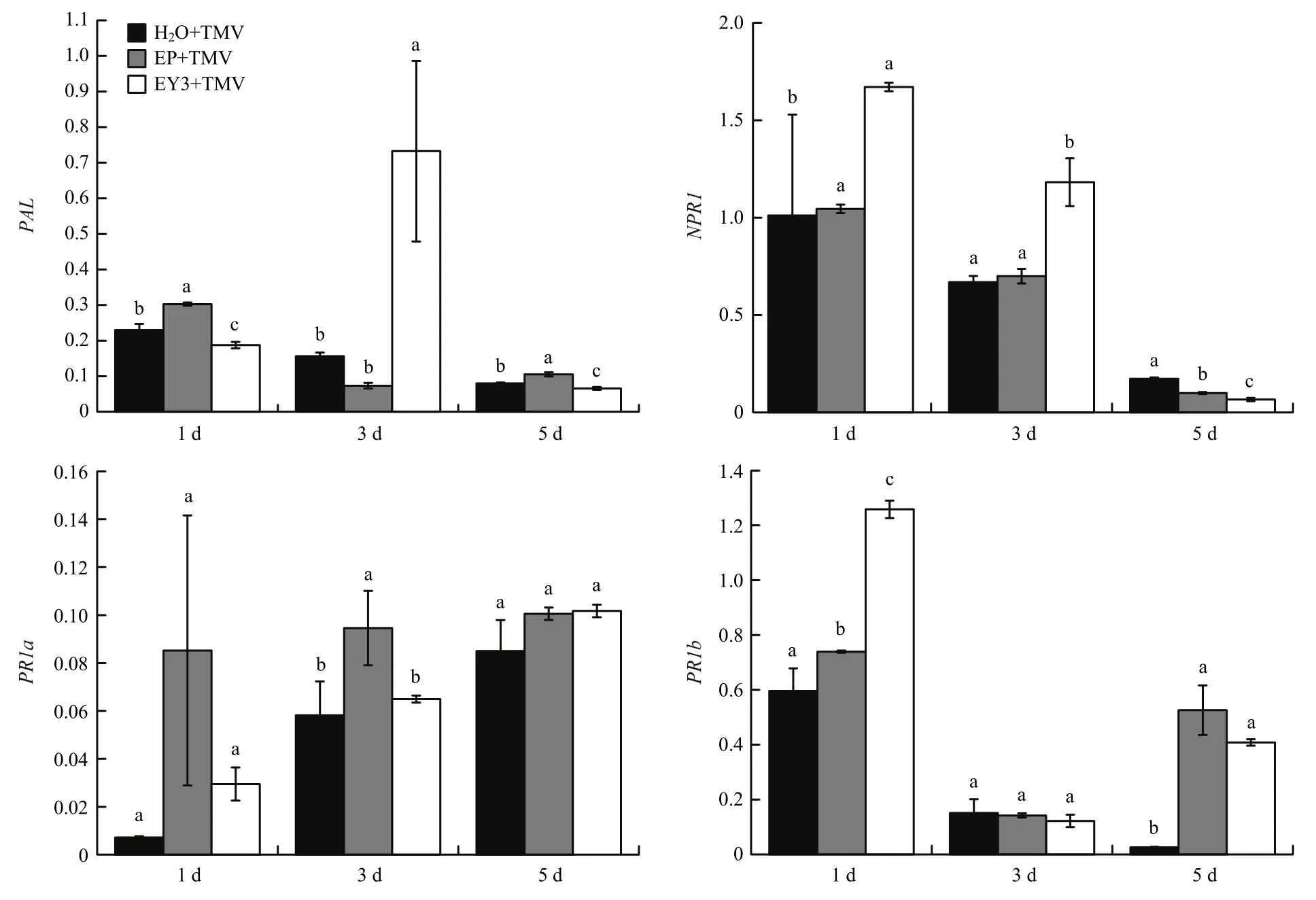
图6 Y3诱导烟草抗性相关基因qRT-PCR结果Fig.6 The result of resistance-releated genes induced Y3 in tobacco
2.3.3 重组蛋白Y3对 TMV的防治效果 重组蛋白Y3喷施烟草叶片1 d后,摩擦接种TMV。各处理组在第20 d时进行病情调查(图7),清水处理组花叶症状明显,EP处理组还出现叶片黄化,Y3蛋白处理组症状明显减轻,表明Y3可以作为防治TMV的候选肽。

图7 烟草感染TMV后症状Fig.7 The symptom of tobacco after infect with TMV
3 讨论
化学农药的长期使用严重地破坏生态环境,而植物源农药与环境相容性好,易降解,且植物病原不易对其产生抗性[27],为研制抗病毒制剂开辟了新的方向。植物抗病毒蛋白一般与靶蛋白结合[28],触发植物免疫反应。PevD1通过与Nbnrp1蛋白互作,引起烟草体内PPO、PAL等酶活性增强,植物产生抗病性[29];PeaT1可上调PR-1a和PR-1b的转录,同时识别位于烟草质膜上的DREPP蛋白[11];苦瓜素α-MMC可激活烟草的抗氧化系统,并使POD酶活性增强[23]。通过RT-PCR克隆了Y3cDNA,并构建重组表达载体pPIC-9k-Y3,在毕赤酵母GS115中以28 ℃、250 r/min、1.0%甲醇诱导6 d表达量最佳。Y3重组蛋白诱导抗性试验结果表明 PPO、PAL的酶活性升高,其中 PAL是水杨酸合成的关键酶[30]。另外,PR1b、NPR1基因的表达量在1 d内显著上调。在植物抗病毒过程中,SA积累诱导SAR的发生,同时细胞内外氧化还原状态改变,NPR1蛋白磷酸化并与TGA转录因子的互作促进PR基因转录[31],因此NPR1基因在SAR中起关键作用。有研究表明,烟草感染TMV后,SA积累和病程相关蛋白(PRs)表达[32],表明Y3蛋白可能通过SA介导的信号转导途径激发SAR,提高烟草的抗病毒活性。激发子PevD1对PAL的影响在第6 d达到峰值,PPO和POD在第5 d达到峰值[8];Hrip1处理烟草3 d后PR1基因显著表达[7],而Y3处理1 d后PR1b基因表达,表明Y3可以更有效地激活烟草的防御系统。GP-1处理烟草后TMV CP积累减少,且破坏TMV粒子结构,表明GP-1可与TMV直接互作,同时也可诱导植物产生抗病性[10]。前期研究表明Y3蛋白与TMV衣壳蛋白结合,阻止了TMV的复制[21]。由此可见,Y3可通过直接与TMV作用和激活SAR两个方面提高烟草的抗病性。
本研究喷施重组蛋白Y3后烟草花叶病症状明显减轻,表明Y3可以诱导寄主产生抗病性。吴丽萍等[17]的研究表明Y3浓度为12.5 μg/mL时对TMV的侵染率达83.0%,另外有学者将Y3 cDNA转化入烟草NC89,感病后症状出现时间晚且较轻[20]。本研究为Y3在烟草抗TMV的功能进一步奠定基础。
蛋白Y3在烟草抗TMV的过程中,可诱导防御相关酶活性和抗性相关基因转录水平发生变化。然而,是否还有其他信号分子参与了Y3诱导烟草产生系统性抗性,以及Y3的纯化条件还需要进一步的研究。本研究为探讨Y3在植物对TMV感染的系统抗性反应中的作用提供了依据。

