本交笼养模式中与公鸡遗传贡献率相关指标的特性及公母配比研究
林兴涛,蓝芳仁,孙从佼,杨 宁,李俊英
(中国农业大学动物科学技术学院,北京 100193)
禽肉、禽蛋等家禽产品具有丰富的营养物质,可为人类提供不可或缺的动物蛋白,与肉、奶素有国民营养“金三角”之称。但当前我国养殖业因场址布局偏远、生产环境封闭等因素而出现劳动力紧缺或人工成本昂贵的现象[1-2];对种鸡繁殖采用人工输精,尤其是大型父母代种鸡场,不仅在很大程度上增加人力成本,而且会对母鸡生殖道造成一定的机械损伤损害,甚至发生疫病的交叉感染,对生物安全十分不利;此外,环保问题与动物福利问题也给养殖业施加重压[3],促进蛋鸡养殖模式转变。在此背景下,蛋种鸡本交笼养模式作为一种新的养殖模式,迎来巨大的发展契机。相比于人工输精模式,蛋种鸡本交笼养模式更利于节约人工成本及蛋种鸡饲养管理自动化、标准化和福利化的实现。
目前,在本交笼养中种鸡死淘率较高、公母配比不当等问题普遍存在,而公鸡遗传贡献率与公母配比是影响本交笼养种鸡饲养效益的重要因素。因此,本实验通过基于28 个微卫星位点的亲缘鉴定技术来度量本交笼中种公鸡的遗传贡献率并对公母配比进行研究,同时检测公鸡血清激素水平及精液品质,进一步探究这些指标与公鸡遗传贡献率的相关性,对提高种公鸡利用率、种蛋受精率以及降低饲养成本等具有重要意义。
1 材料与方法
1.1 实验群体 实验所选2 种本交笼养种鸡群体分别来自江西华裕家禽育种有限公司与四川正鑫农业科技有限公司。其中,前者所选200 只281 日龄海兰褐父母代种鸡,饲养在2 组星海泰本交笼(I 型)中,单组笼型规格:长×宽×高为4.80 m×1.20 m×1.20 m,每组养100只种鸡,公母配比为1:9,公鸡编号分别为HA-F01 至HA-F10,HB-F01 至HB-F10;后者所选200 只241 日龄罗曼粉父母代种鸡,饲养在4 组大牧人本交笼(II 型)中,单组笼型规格:长×宽×高为2.40 m×1.20 m×1.20 m,每组养50 只种鸡,公母配比为1:9,公鸡编号分别为LA-F1 至LA-F5,LB-F1 至LB-F5,LC-F1 至LC-F5及LD-F1 至LD-F5。
1.2 实验方法
1.2.1 实验样本采集 连续5 d 每天分别收集实验组每组本交笼里所产的种蛋,孵化至5 胚龄将其逐个打破并收集胚胎,收集的每个胚胎分别置于盛有400 μL PBS的1.5 mL 离心管中。
使用一次性2 mL 采血针于实验组每只鸡右翅下进行静脉采血,每只母鸡采集血液约1.5 mL 置于2 mL抗凝管中,每只公鸡采集血液约2 mL,分装0.5 mL 于2 mL 抗凝管中,余下1.5 mL 置于2 mL 离心管中,并呈45~60°角于室温下放置1 h 后,8 000 r/min 离心20 min,吸取上层血清于1.5 mL 离心管。所有样品-20℃条件下保存备用。
1.2.2 DNA 提取与PCR 反应 采用北京天根生化科技有限公司的组织及血液DNA 提取试剂盒提取样品基因组DNA,并统一稀释至80~100 ng/μL。依据文献[4-5]中的28 个微卫星位点确定引物,送往北京擎科新业生物技术有限公司合成,并在引物上游序列5'端添加相应的荧光标记(表1)。采用温度梯度PCR 技术在引物退火温度±5℃范围内确定最佳退火温度,对所有DNA 样本在每对引物最佳退火温度下进行PCR 反应。反应体系15 μL:DNA 模板1 μL(浓度为80~100 ng/μL)、上下游 引物各0.6 μL(终浓度 为0.2 μmol/L)及2×EasyTaq®PCR SuperMix 7.5 μL,ddH2O 定容至15 μL。将PCR 产物按引物序号顺序每3 对进行混匀,置于96孔板中,其中第19、20 号2 对引物混合,27 号与28号2 对引物混合。将混匀的PCR 产物送往北京擎科新业生物技术有限公司进行毛细管电泳。
1.2.3 公鸡血清激素水平检测 为探究公鸡血清中的甲状腺激素及生殖激素对公鸡遗传贡献率的影响,本实验对公鸡血清进行采集,并送往北京华英生物技术研究所,采用放免试剂盒法测定血清中的三碘甲状腺原氨酸(T3)、促甲状腺激素释放激素(Thyrotropin Releasing Hormone,TRH)、促卵泡素(Follicle Stimulating Hormone,FSH)、促黄体素(Luteinizing Hormone,LH)、促甲状腺素受体(Thyrotmpin Receptor,TSHR)及睾酮(TESTO,T)含量。

表1 文献中28 个微卫星位点信息[4-5]
1.2.4 公鸡精液品质检测 公鸡的精液品质主要包括采精量、精子密度及精子活力3 项指标。公鸡精子活力依据显微镜视野中呈直线前进运动的精子数所占精子总数的百分比进行评价,采用十级评定方法;精子密度测定采用血球计数板计数法。将采精量、精子密度与精子活力3 项指标折算成有效精子数,作为综合指标来评价公鸡精液品质。
2.1 统计分析 使用软件GeneMarker v2.2.0 对毛细管电泳峰图进行基因型数据整理;使用软件Cervus v3.0 进行遗传多样性分析及亲缘鉴定。所有数据通过Excel 2016进行初步处理后利用R 软件进行数据分析及可视化。
2 结果与分析
2.1 本交笼群体遗传多样性及微卫星亲缘鉴定效率 在I 型本交笼中,28 个位点中有2 个纯合位点,26 个杂合位点,共检测到104 个等位基因,平均等位基因数为3.71;平均多态信息含量与期望杂合度分别为0.46、0.52;无效等位基因数介于-0.09~0.07。在II 型本交笼中,28 个位点均为杂合位点,共检测到158 个等位基因,平均等位基因数为4.16;平均多态性信息含量与期望杂合度分别为0.51、0.54;无效等位基因数介于-0.07~0.08。结果表明每个微卫星位点在2 类本交笼群体遗传上均有不同程度的变异,可用于遗传学相关的分析。使用软件Cervus v3.0 进行亲子鉴定,置信度设为95%,I 型本交笼群体中,累计排除概率(NE-1P)达到99.63%,HA、HB 组鉴定成功率分别为96.75%、98.18%。II 型本交笼群体中,累计排除概率几乎达到100%,鉴定成功率均为100%。
2.2 本交笼中公鸡遗传贡献率 从图1 可以看出,在I型本交笼HA、HB 组中,各公鸡在后代数量上存在一个明显排序,累计遗传贡献率曲线呈上凸弧形,表明边际遗传贡献率逐渐减小,即每增加1 只公鸡,所带来的遗传贡献率增量逐渐减小。

图1 2 组I 型本交笼公鸡遗传贡献率
在II 型本交笼中,如图2 所示,4 组公鸡在遗传贡献率上均存在一个明显的排序,在LA 组中,编号为LA-F3 的公鸡其遗传贡献为0,而在LB、LC、LD 3 组中,前4 只高遗传贡献的公鸡对遗传总量的贡献和达到90% 左右。2 类本交笼中,各组内公鸡在遗传贡献上均存在较大变异,尤其是在高遗传贡献率的公鸡与低遗传贡献率的公鸡之间差异极显著,高者比低者高出150%~400%。

图2 4 组II 型本交笼公鸡遗传贡献率
2.3 公鸡遗传贡献率相关指标特性 运用Spearman 法对II 型本交笼中公鸡遗传贡献率与其有效精子数、血清激素水平进行相关性分析,结果如图3 所示。公鸡遗传贡献率与公鸡有效精子数及血清中的FSH、T3水平相关性较高,相关系数分别为0.79、0.8 与-0.8(P值均小于0.05)。因此,在生产实践中,可以将公鸡精液品质与血清中FSH 及T3含量相结合,来评价公鸡遗传贡献率,据此对低遗传贡献率的公鸡予以淘汰。

图3 II 型本交笼公鸡遗传贡献率与有效精子数及血清激素水平相关系数矩阵
2.4 本交笼公母鸡配比 为探究本交笼中不同公母配比对种蛋受精率的影响,实验根据II 型本交笼中各组公鸡遗传贡献率排序结果,在LA、LD 2 组各剔除2 只低遗传贡献率的公鸡,LB、LC 2 组各剔除1 只低遗传贡献率的公鸡。如图4 所示,在各组剔除公鸡之前每组各收蛋2 d(垂线左边),剔除公鸡之后每组本交笼各收蛋10 d(垂线右边),在剔除公鸡之后,每组种蛋受精率均有所波动,在第6 天之后逐渐趋于平稳。
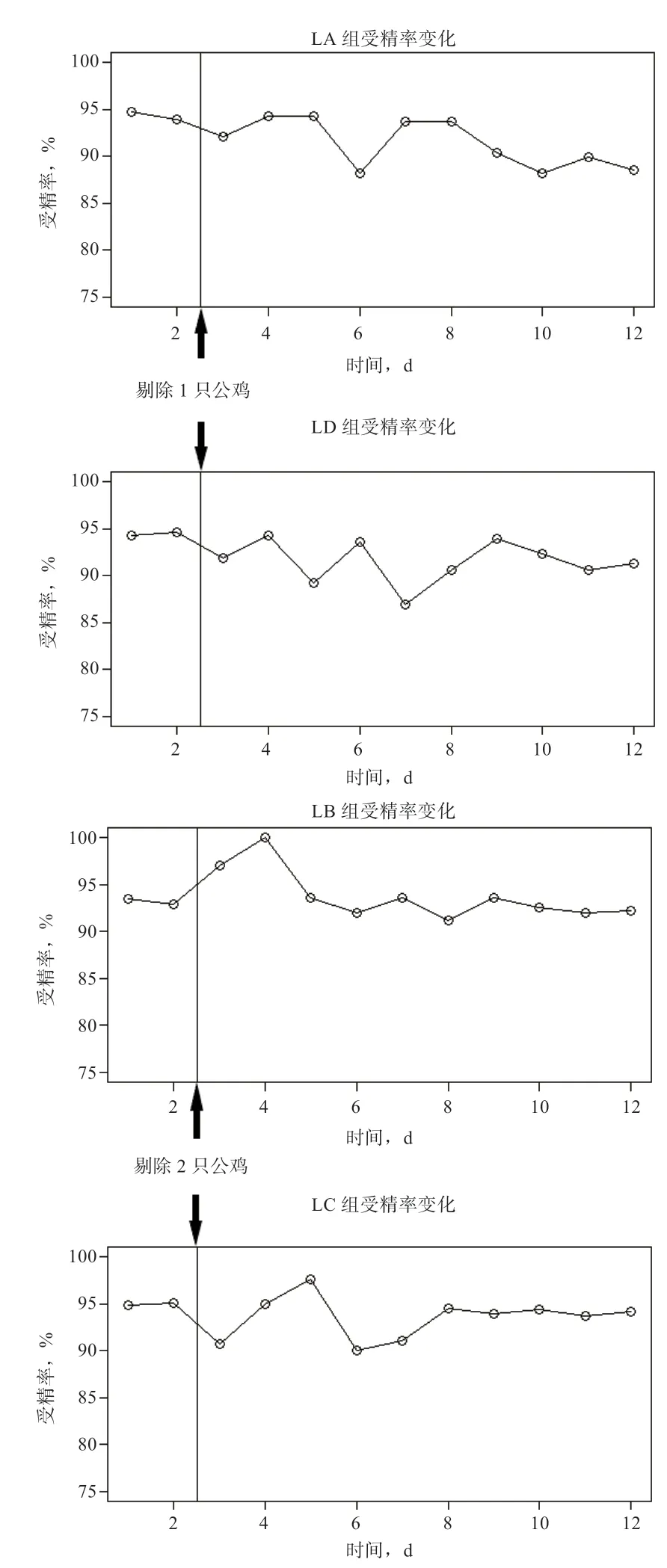
图4 4 组II 型本交笼种蛋受精率变化
将4 组本交笼剔除公鸡前的2 d 种蛋受精率作为5 只公鸡组,将LB、LC 2 组中后5 d 种蛋受精率作为4 只公鸡组,并将LA、LD 2 组中后5 d 种蛋受精率作为3 只公鸡组,方差分析各组种蛋受精率差异并使用TukeyHSD 方法进行多重比较,结果如图5 所示。公鸡数为3 的组与公鸡数为4 或5 的组间P值分别为0.003 7与0.000 12,而公鸡数为4 的组与公鸡数为5 的组组间P值为0.289。结果表明,在II 型本交笼中剔除最低遗传贡献率的1 只公鸡后,公母配比由1:9 提高到1:11,种蛋受精率略有下降,但在统计学上并不具有显著性;剔除2 只低遗传贡献率的公鸡后,公母配比提高到1:15,种蛋受精率下降极显著(P<0.001),但仍能维持在90%左右。

图5 II 型本交笼中不同公母配比下种蛋受精率比较
3 讨 论
3.1 微卫星应用于亲缘关系鉴定效率分析 使用一组微卫星遗传标记在封闭小群体中进行亲子鉴定时,随着代数的变化鉴定效率会有所下降[6],尽管本实验所选鸡群样本均被单组本交笼分成若干封闭小群体,但所选后代均为子一代,对鉴定效率影响不大,而且在亲本基因多样性较低时可通过增加适量的微卫星位点来提高亲子鉴定的准确性[7]。本实验选择28 个微卫星位点,在2 类本交笼群体中鉴定效率较好。2 组I 型本交笼群体鉴定成功率分别为96.75% 与98.18%;4 组II型本交笼群体鉴定成功率均为100%,均高于I 型本交笼,可能是因为品种差异,微卫星标记在近缘品种间具有很好的迁移性,同时也会表现出不同程度的变异[8]。微卫星位点的多态性决定亲缘关系鉴定效率[9],28 个微卫星位点在II 型本交笼群体中均为杂合状态,而在I 型本交笼群体中有2 个位点为纯合状态,多态性有所下降。使用似然值作为亲子鉴定依据时,其中一个假设前提就是所选标记位点应相互不连锁,遵循哈代温伯格平衡。在2 类本交笼群体中,均有一些微卫星位点显著偏离哈代温伯格平衡,但这并不代表所选位点不适用于基于最大似然法的亲子鉴定分析,这是因为所选样本均是闭锁繁育群体,长期育种选择导致纯系鸡遗传多样性下降。因此,本实验所选的28 个微卫星位点具有较好的鉴定效率,为后续对公鸡遗传贡献率的准确分析奠定基础。
3.2 公鸡遗传贡献率与相关指标特性分析 本实验发现II 型本交笼中公鸡遗传贡献率与血清中FSH 与T3含量分别呈高度正相关与高度负相关,相关系数分别为0.8与-0.8。“下丘脑-垂体-性腺”轴在调节公鸡性激素分泌方面具有重要作用,FSH 由垂体神经分泌细胞所分泌,作用于支持细胞,对睾丸的内分泌功能具有直接的调节作用[10]。刘立文等[11]在研究蜂花粉对公鸡血浆中促性腺激素的影响时发现,蜂花粉能够提高血浆中FSH浓度,从而促进睾酮分泌,可见正常的高水平FSH 能够促进公鸡精子的生成;在本实验中,血清中FSH 水平与T 水平相关系数为0.2,公鸡遗传贡献率与FSH 相关系数为0.8,本实验结果与刘立文等[11]的研究结果相一致。血清FSH 水平可能通过调节公鸡精子的生成来影响公鸡遗传贡献率,FSH 经垂体分泌后,通过体液运输作用于支持细胞,能够促进生精上皮细胞的分裂,从而刺激精原细胞增殖,并促进机体合成雄激素结合蛋白,该蛋白是精子生成过程中的必须物质,可影响血液中T浓度。可见,血清FSH 水平可以作为衡量公鸡遗传贡献率的重要指标。秦绪光[12]研究发现公鸡精液品质与血浆T、LH、FSH 浓度显著正相关,并认为这些激素可直接用于公鸡繁殖能力的判别,该结论与本实验结果基本一致。
T3是甲状腺激素(TH)的主要形式之一,在血液中呈游离状态,作用于机体各处组织,可促进机体新陈代谢,提高中枢神经系统的兴奋性。临床研究表明,甲状腺激素水平偏高会伴随易激惹等情绪问题,继而出现冲动控制障碍[13]。精神分裂症患者的攻击行为与血清中的T3及睾酮含量有关[14],而T3可能参与了情感反应的激活[15]。本实验中,具有较强斗性的公鸡其后代却不是最多的,斗性最弱的公鸡的后代却是最少的,因此,血清T3水平可能通过调控公鸡的斗性行为而影响公鸡的遗传贡献率,其详细机制还需进一步探究。公鸡遗传贡献率与公鸡精液品质相关系数为0.79,可见公鸡遗传贡献率受血清激素水平及精液品质的双重影响。在生产实践中,可根据公鸡血清中FSH、T3水平及精液品质来综合判别公鸡的遗传贡献率,从而剔除生产性能较低的公鸡,降低公鸡饲养数量。
4 结 论
本实验结果显示,在本交笼养模式中,同一笼内不同公鸡的遗传贡献率差异显著;可根据公鸡精液品质、血清中FSH 及T3水平综合判定,剔除低遗传贡献率的公鸡,选留高繁殖性能的公鸡,从而提高本交笼中公母配比到1:10 以上,降低饲养成本。

