四翅滨藜AcDREB2 转录因子编码基因的克隆及其表达
苟艳丽,高丽莉,吴欣欣,郭 欢,包爱科
(1. 兰州大学草地农业科技学院,甘肃 兰州 730020;2. 甘肃农业职业技术学院园林工程系,甘肃 兰州 730020)
盐和干旱是范围最大、影响最广的非生物逆境胁迫,也是限制全球农业生产的两大主要因素。盐和干旱胁迫都会引起细胞失水,破坏细胞内稳态平衡,致使细胞内生理生化代谢紊乱,严重影响植物的正常生长发育。为了在日趋恶劣的环境中生存和繁殖,陆地植物进化出复杂的调控系统来响应胁迫信号以提高植物的适应能力。在盐和干旱胁迫下,很多抗逆相关基因被大量诱导表达,其中脱水应答元件结合蛋白(DREB)就在这个过程中发挥重要作用。1997 年,Stockinger 等[1]通过酵母单杂交方法首次从拟南芥(Arabidopsis thaliana)中克隆出能够与DRE 顺式作用元件结合的蛋白编码基因CBF1 (Crepeat/DRE Binding Factor 1)。Liu 等[2]从拟南芥中分离出DREB1A 和DREB2A 两个基因,通过凝胶移位分析与反式激活实验证明,DREB1A 与DREB2A 均能与DRE 顺式作用元件高度特异性结合,DREB1A能够被冷胁迫快速诱导表达,DREB2A 能够被干旱和高盐快速诱导表达。
目前对于 DREB 功能的研究大多集中在模式植物拟南芥与抗逆能力有限的作物中,大量研究已证实将 DREB 基因在拟南芥或作物中超表达,能够显著提高转基因植物对干旱、盐碱、低温等各种非生物胁迫的抗性。但是关于 DREB 在旱生、盐生植物中的功能研究目前尚少。四翅滨藜(Atriplex canescens)是一种多年生 C4半常绿灌木,具有速生、耐干旱、耐贫瘠、抗盐碱等优良特性,由于其粗蛋白含量高,适口性好,是改良牧场和水土保持的优良树种[3]。Pan 等[4]研 究 表 明,100 mmol·L−1NaCl 可 以 促 进 四翅滨藜的生长,且当 NaCl 浓度达到 400 mmol·L−1时,四翅滨藜的生长并没有受到显著抑制。四翅滨藜也具有一定的抗旱能力,在重度干旱胁迫下,四翅滨藜合成的干物质的量是花棒(Hedysarum scoparium)、柠条(Caragana korshinskii)、杨柴(Hedysarum mongolicum)等6 种旱生灌木中最大的[5]。前期关于四翅滨藜抗逆机理的研究主要集中在生态恢复、种子萌发、生理适应和离子转运等方面[4,6-8],转录因子在其抗逆过程中的功能尚鲜见报道。
鉴于此,本研究克隆了四翅滨藜脱水响应元件结合蛋白编码基因AcDREB2 全长cDNA,并对其序列进行分析,有望揭示AcDREB2 在四翅滨藜抗逆过程中的作用,从而为挖掘四翅滨藜中蕴含的抗逆基因资源、并将其应用于作物和牧草抗逆性的遗传改良奠定重要基础[9]。
1 材料与方法
1.1 植物材料
本研究所用四翅滨藜种子采自宁夏回族自治区灵武县。根据Pan 等[4]的种子处理和发芽方法将四翅滨藜发芽苗移栽至含有蛭石的穴盘中,用1/2 Hoagland 营养液培养4 周。培养室温度为25~28 ℃,光照条件为800 μmol·(m2·s)−1、16 h (昼)/8 h (夜)。
1.2 总RNA 提取及其反转录
剪取4 周龄四翅滨藜的叶片,放入液氮迅速冷冻后,参照北京天根RNA prep Pure Plant Kit 操作说明书提取总RNA,通过NanoDrop1000 核酸蛋白检测仪检测RNA 质量及浓度,利用凝胶电泳检测其完 整 性。随 后 用TAKARA PrimeScript Ⅱ 1st strand cDNA 合成试剂盒将RNA 反转录得到cDNA 第一链。
1.3 AcDREB 基因全长克隆
利用DNAMAN 6.0 软件,根据NCBI 上其他植物AcDREB 同源基因的保守氨基酸序列设计一对简并引物(上游引物:TGGGGKAARTGGGTYGCHGARATYCG;下游引物:ACDGADGARTGNAGWGGYTTRTA),预测其核心片段长度为215 bp。用Phusion High-Fidelity DNA Polymerase 试剂盒(Thermo,北京)进行PCR 扩增,反应体系为20 μL,反应条件:95 ℃预变性30 min,94 ℃变性45 s,55 ℃退火45 s,72 ℃延伸1 min,35 个循环,最后72 ℃延伸10 min。1%琼脂糖凝胶电泳检测PCR 产物后,按照StarPrep Gel Extraction Kit (GenStar)说明书回收和纯化目的片断,送苏州金唯智(GENEWIZ)测序。
根据已获得的四翅滨藜AcDREB2 基因核心片段序列,采用RACE 法分别克隆该基因的5′-和3′-序列。最后用MEGA5 软件将核心片段、3′-及5′-序列进行拼接后获得全长cDNA 序列。5′-克隆步骤如下:根据得到的核心片段序列,用DNAMAN 6.0 和Primer 5.0 软件设计5′-特异性巢式引物外侧P1 和内侧P2 (表1),RACE 试剂盒自带巢式引物分别为外侧P3 和内侧P4 (表1)。扩增时首先以5′-RACE cDNA 为模板,用引物P1 与P3 进行扩增得到外侧PCR 产物,然后以此为模板,再用引物P2 与P4 进行扩增得到内侧PCR 产物。外侧PCR 扩增反应程序:98 ℃ 30 s;98 ℃ 10 s,55 ℃ 30 s,72 ℃20 s,30 个循环,最后72 ℃延伸10 min。内侧PCR 扩增反应程序:98 ℃ 30 s;98 ℃ 10 s,55 ℃ 30 s,72 ℃ 15 s,30 个循环;最后72 ℃延伸10 min。3′-克隆步骤如下:同样根据核心片段设计3′-特异性巢式引物外侧P5 和内侧P6。扩增时首先以3′-RACE cDNA为模板,用引物P5 与P3 扩增得到外侧PCR 产物,然后以此为模板,再用引物P6 与P4 扩增得到内侧PCR 产物。外侧PCR 扩增反应程序:98 ℃ 30 s;98 ℃10 s,54 ℃ 30 s,72 ℃ 23 s,30 个循环;最后72 ℃延伸10 min。内侧PCR 扩增反应程序:98 ℃ 30 s;98 ℃10 s,56 ℃ 30 s,72 ℃ 20 s,30 个循环;最后72 ℃延伸10 min。

表1 5′ -和3′ -RACE 所用引物Table 1 Primers for the 5′ - and 3′ - RACE analysis
1.4 序列分析
在GenBank 中进行序列BLAST 比对,用DNAMAN 6.0 进行序列同源性分析、翻译、氨基酸序列比对以及系统进化树制作,在NCBI SMART 中进行蛋白质结构预测。
1.5 基因表达模式分析
依据AcDREB2 全长CDS 序列,设计一对引物(上游引物:TCACTGGGGTAAATGGGTCG;下游引物:TGTAAGCCGCCTTGTCGTAA),通过Real-time PCR 对1/2 Hoagland 营养液培养4 周的四翅滨藜幼苗根、茎、叶中AcDREB2 表达量进行分析。随后,将4 周的四翅滨藜幼苗分别用100 和300 mmol·L−1NaCl 处理以及−0.27 和−0.54 MPa 的渗透胁迫(渗透胁迫试剂为山梨醇)处理0、0.5、1、3、6、12、24 h后取叶样,进行AcDREB2 的表达模式分析。各样品重复3 次,以四翅滨藜AcActin 基因为内参(上游引物:AAGAACTACGAGCTACCTGACGG;下游引物:GATACCAGAAGATTCCATTCCAAC),Real-time PCR参照SYBR Premix Ex TaqTM II (TAKARA)试剂盒说明进行,以反转录好并用ddH2O 稀释10 倍后的cDNA为模板,进行Real-time PCR 反应。按照2−∆∆Ct相对定量法计算表达量,采用独立样本T 检验分析对照和处理条件下表达量的差异显著性。
2 结果与分析
2.1 四翅滨藜AcDREB2 基因全长cDNA 克隆及序列分析
通过简并引物扩增得到核心序列长度为215 的条带(图1a),与预测长度一致。以此序列为基础利用RACE 法获得5′-和3′-序列,分别为234 和509 bp 的cDNA (图1b, c)。

图1 AcDREB2 基因核心片段(a)、5′-RACE (b)和3′-RACE (c)克隆Figure 1 The core fragment, 5′- and 3′- end fragments of AcDREB2
将以上3 段序列进行拼接后得到总长度为867 bp,且3′-具有完整的Poly (A)尾巴的cDNA 序列(图2)。将此全长序列在NCBI 中BLAST 比对发现,该基因与其他植物DREB2 基因具有较高的同源性,故命名为AcDREB2。将全长序列进行氨基酸翻译后,发现该基因包含19 bp 的5′-非翻译区(untranslated region:UTR),119 bp 的3′-非翻译区及729 bp 的开放阅读框(open reading frame: ORF),共编码242 个氨基酸(图2)。

图2 AcDREB2 基因的核苷酸序列及其编码氨基酸序列Figure 2 Nucleotide sequence and predicted amino acid sequence of AcDREB2
2.2 AcDREB2 氨基酸序列的同源性比较与结构域分析
将AcDREB2 与其他植物DREB 氨基酸序列进行多重比较分析,发现该蛋白具有高度保守的典型AP2/EREBP 结构域,该结构域中包含3 个β 折叠和1 个α 螺旋,其中第14 位是保守的缬氨酸残基(V),19 位为亮氨酸残基(L),与其他植物DREB 的保守氨基酸位点相一致(图3)。利用在线软件NCBI SMART 预测AcDREB2 蛋白结构域,显示起始密码子之后第41-104 区域中含有一个典型的AP2 保守结构域,并存在两个低复杂区(low-complexity region)(图4)。
2.3 系统进化树分析
利用DNAMAN 软件进行系统进化树分析,发现AcDREB2 与同科植物地中海滨藜AhDREB2 和榆钱菠菜AhoDREB2 同源性最高,分别高达96%和93%;与同为盐生植物的盐地碱蓬SsDREB2 的相似度也较高,达到72%;与其他荒漠植物如野菊CiDREB1-2 和柠条CkDREB2 等的相似度再38%以上;此外,与大豆GmDREB2、小麦TaDREB2 和玉米ZmDREB2b 等作物和模式植物拟南芥AtDREB2A的同源性都较低(图5)。
2.4 AcDREB2 表达的组织特异性分析
用Real-time PCR 的方法分析AcDREB2 基因在4 周龄四翅滨藜幼苗根、茎、叶各组织中的表达情况。结果表明,AcDREB2 在四翅滨藜各组织中均有表达,其中在叶中的表达量最高,茎中最低(图6)。因此,后续选取表达丰度最高的叶组织样进行各胁迫处理下AcDREB2 的表达模式分析。
2.5 NaCl 和渗透胁迫处理下AcDREB2 在四翅滨藜叶中的表达模式
100 和300 mmol·L−1NaCl 处理不同时间(0、0.5、1、3、6、12 和24 h)后,AcDREB2 在四翅滨藜叶中的表达模式如图7 所示。低盐(100 mmol·L−1NaCl)和高盐(300 mmol·L−1NaCl)处理后,AcDREB2的表达模式类似,表达量均随处理时间的延长逐渐增高,直至处理3 h 时达到峰值,为处理前表达量的2 倍以上(图8)。由此可见,叶中AcDREB2 的表达受NaCl处理的显著诱导。

图3 AcDREB2 与其他植物DREB 氨基酸序列多重比较Figure 3 Amino acid sequence alignment of AcDREB2 with DREBs from other plants

图4 AcDREB2 功能域分析Figure 4 Functional domain analysis of AcDREB2
渗透胁迫处理下,随着处理时间的延长,AcDREB2在四翅滨藜叶中的相对表达量总体上呈先上升后下降的趋势,但其表达量峰值因渗透胁迫程度不同而有所差异;−0.27 MPa 轻度渗透胁迫下,AcDREB2的表达量在处理3 和6 h 时均大幅增加,其中处理6 h时达到峰值且比处理前高出2.8 倍;而−0.54 MPa重度渗透胁迫下,AcDREB2表达量在处理3 h 时达到最高(图8)。由此可见,AcDREB2 的表达受渗透胁迫处理(尤其是轻度渗透胁迫)的强烈诱导。
3 讨论与结论
已有研究表明,植物在遭遇干旱、低温、高盐等逆境胁迫时会产生一系列应答反应,这些反应受植物体内多种因素的调节,其中转录因子可以激活很多靶基因的转录和表达,进而使下游靶基因发挥作用[10-12]。目前从各种植物中已克隆出许多抗逆基因,这些抗逆基因可以一定程度的提高植物的某些抗性,但是对其上游转录激活区的研究较少,从而不能全面的分析植物的抗逆机制。植物中DREB 转录因 子(dehydration reesponsive element binding protein)在调控功能基因表达与非生物胁迫信号转导中具有非常重要的作用,当其受到逆境胁迫时,该蛋白编码基因会与DRE/CRT 顺式作用元件结合,并激活下游相应功能基因的表达[13]。因此,转录因子在植物抗逆机制中发挥的作用不容忽视。

图5 AcDREB2 的系统进化树分析Figure 5 Phylogenetic tree analysis of AcDREB2

图6 AcDREB2 在4 周龄四翅滨藜根、茎、叶中的相对表达量Figure 6 Relative expression levels of AcDREB2 in roots,stems, and leaves of four-week-old Atriplex canescens seedlings
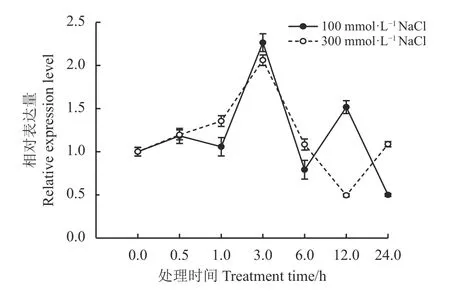
图7 NaCl 处理下AcDREB2 在四翅滨藜叶中的表达模式Figure 7 Expression pattern of AcDREB2 in Atriplex canescens leaves under NaCl treatments

图8 渗透胁迫下AcDREB2 在四翅滨藜叶中的表达模式Figure 8 Expression pattern of AcDREB2 in A. canescens leaves under osmotic stress
本研究从盐生植物四翅滨藜中克隆到一个DREB类转录因子家族成员的编码基因 AcDREB2,在丰富了基因资源信息库的同时,以期为深入探究该类植物的抗逆机制奠定基础。该基因编码氨基酸序列的全长为867 bp,共编码242 个氨基酸。进一步对其氨基酸序列进行同源性比对分析和结构域预测,发现其含有该类基因特有的AP2/EREBP 保守结构域和两个低复杂区(low complexity region),这种低复杂区普遍存在于该类蛋白中,能促进蛋白质结构稳定,有时也会呈现出弹性结构以便与其他多种蛋白质结合共同发挥功能。而AP2 保守结构域中包含1 个α 螺旋和3 个β 折叠结构,整个结构域中由64 个氨基酸残基组成,这与已经报道的其他同科植物和抗逆性强的荒漠植物中DREB 蛋白保守结构域特征相符合[14-16]。研究表明,DREB 的AP2/EREBP 保守结构域中第14 位是保守的缬氨酸残基(V),第19 位是保守的谷氨酸残基(G),在该蛋白与特异性的顺式元件结合过程中起关键作用[17]。在本研究结果中,AcDREB2 的AP2 保守结构域第14 位同样是缬氨酸残基(V14),而第19 位是亮氨酸残基(L19)。研究发现,将拟南芥AP2/ERF 结构域中第14 位的缬氨酸替换为丙氨酸后,DREB 不会与DRE 顺式元件序列结合,导致DREB 转录因子功能丧失,而将第19 位的谷氨酸替换为天冬氨酸,DREB 仍可与DRE顺式元件相结合,正常发挥功能[18]。因此,AcDREB2 AP2 保守结构域中第14 位保守的缬氨酸残基是决定其功能的关键氨基酸,在与对应元件特异性结合中发挥重要作用,而第19 位的亮氨酸很可能并不会影响到该蛋白与DRE 顺式元件的结合。因此,推测AcDREB2 可以正常激活转录,参与调控下游相关报告基因的表达。
同源性比对及进行系统进化树分析结果表明,四翅滨藜AcDREB2 与同属植物地中海滨藜AhDREB2和榆钱菠菜AhoDREB2 的同源关系最近,分别高达96%和93%以上;与同科植物盐地碱蓬SsDREB2的同源性达到72%;此外,与其他荒漠植物柠条等的同源性也较高。这表明AcDREB2 很可能与亲缘关系相近的植物中的同源基因具有相似功能。研究发现,盐地碱蓬SsDREB2 能特异性结合DRE 顺式元件,发挥转录激活功能,且在烟草中超表达SsDREB2显著提高了植株的耐盐抗旱性,同时发现转基因植株中与非生物胁迫响应相关的6 个功能基因的表达量显著高于野生型[19-20]。这表明DREB 转录因子可以通过调控干旱和高盐等胁迫响应相关基因的表达,提高植物对逆境环境的适应能力。因此推断四翅滨藜AcDREB2 在其响应高盐干旱环境的过程中发挥重要作用。
通过实时荧光定量PCR 方法分析了AcDREB2在四翅滨藜响应盐和渗透胁迫中的表达模式。结果发现,AcDREB2 主要在四翅滨藜叶中发挥作用(图8),这可能与四翅滨藜在盐和干旱条件下能通过叶片表面盐囊泡将多余Na+排出体外以提高植株在胁迫环境中的保水能力和光合能力,从而提高其抗逆性有关[4,21]。此外,在盐和渗透胁迫处理3 h 后,AcDREB2的表达丰度就迅速上调,这说明其能快速响应盐和干旱缺水环境,及时调控叶中胁迫相关基因的表达。上述结果表明,AcDREB2 与四翅滨藜对盐和渗透胁迫环境的响应密切相关。

