前哨淋巴结绘图联合病理超分期在子宫内膜癌中的临床研究*
朱诚程,汪向明,倪观太,孙 青,施素华,丁华峰
(皖南医学院弋矶山医院妇产科,芜湖 241000)
子宫内膜癌是最常见的妇科恶性肿瘤之一,占女性生殖道恶性肿瘤的20%~30%[1],近年其患病率呈上升趋势。早期子宫内膜癌发生淋巴转移的几率低于10%,而系统性淋巴结切除手术并发症多。前哨淋巴结(sentinel lymph node,SLN)是原发性肿瘤淋巴引流第一站,可能是最早发生转移的淋巴。SLN在宫颈癌、外阴癌中的研究较为深入,将逐步取代系统性淋巴结切除术[2]。但SLN在子宫内膜癌中的研究起步较晚,1996年Burke等[3]首次将前哨淋巴结活检引入到子宫内膜癌手术中,近年此领域研究逐渐增多[4-6],认为将蓝色示踪剂用于子宫内膜癌前哨淋巴结检测是安全可行的。2016年美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)指南提出,将SLN检测作为早期子宫内膜癌的手术方式,宫颈是主要注射部位。
0.2~2mm的淋巴结转移称为淋巴结微转移,可能常被病理医生忽略,病理超分期可检测到0.2mm的单个肿瘤细胞的淋巴结,识别以往不能发现的Ⅲ期病例,为子宫内膜癌患者提供更精准的治疗方案。病理超分期可提高SLNB阴性预测价值,但淋巴结微转移是否与患者的总生存率及无复发生存率有关目前仍存争议[5]。Bezu等[7]研究中常规病理检查显示盆腔淋巴结无转移的早期子宫内膜癌患者,随访盆腔复发比例超过15%。本文通过研究前哨淋巴结绘图联合病理超分期在子宫内膜癌中的临床应用情况,旨在探讨宫颈注射亚甲蓝显示子宫内膜癌前哨淋巴结,联合病理超分期提高淋巴结微转移检出率的可行性及敏感性,为子宫内膜癌的治疗提供更精准的方案。
1 资料与方法
1.1 一般资料 选取2018年5月至2019年2月皖南医学院弋矶山医院妇科收治的子宫内膜癌患者34例,患者年龄34~75岁,平均56岁。采用腹腔镜下全子宫双附件切除+盆腔淋巴结/腹主动脉旁淋巴结清扫术(清扫至肾静脉水平)。本研究获得医院伦理委员会批准。纳入标准:患者知情同意,术前分段诊刮、盆腹腔MRI等评估未发现肿大淋巴结,且术前均未行放疗、化疗或激素等治疗。
1.2 药品与方法 在气腹建立、腹腔镜器械进腹后(即术前10min),于宫颈3、9点钟位置注射亚甲蓝(2ml/支,批号H32024827,济州药业),先浅注射2mm,后深注射1cm,总量2ml,注射时间不少于1min。缓慢推注负压拔针,注射针头要求细长针(1ml一次性无菌注射器),减少拔针后药物外漏、利于操作。注射后10min内观察显影并打开盆腔腹膜,手术均由同一组手术医生实施,腹腔镜下寻找最先蓝染的淋巴结即SLN,切取后单独装袋送检,再行系统性盆腔淋巴结/腹主动脉旁淋巴结清扫,记录SLN数量和部位。
1.3 病理超分期 SLN采用常规HE染色,SLN阴性时再行病理超分期连续切片[4-5],每枚间隔200μm切块直至切完,每块连续切3个切片,每片厚5μm,1片行HE染色,另2片行AE1/AE3免疫组化法(immunohistochemistry,IHC),淋巴结微转移即IHC阳性。非前哨淋巴结采用常规HE染色,每枚间隔50μm切片,切两片,每片厚5μm。病理检查均由相同2名高年资病理科医师完成。
1.4 SLN绘图评价标准 参照美国Louisville大学SLNB评价标准[11]:PLN(pelvic lymph node)定义为包括前哨淋巴结在内的所有清扫的盆腹腔淋巴结。SLN真阳性:SLN有转移;SLN真阴性:SLN无转移,且PLN无转移;SLN假阴性:SLN无转移,而PLN有转移;SLN总检出率=(SLN病例数/总病例数)×100%;SLN双侧检出率=(双侧SLN病例数/总病例数)×100%;SLN单侧检出率=(一侧SLN病例数/总病例数)×100%;灵敏度=(SLN真阳性病例数/PLN转移病例数)×100%;特异度=(SLN真阴性病例数/PLN无转移病例数)×100%;准确性=[(SLN真阳性病例数+SLN真阴性病例数)/SLN识别病例数×100%;假阴性率=SLN假阴性病例数/PLN转移病例数×100%;阴性预测值=[SLN真阴性病例数/(SLN假阴性+SLN真阴性病例数)]×100%;阳性预测值=[SLN真阳性病例数/(SLN假阳性+SLN真阳性病例数)]×100%。
2 结 果
2.1 SLN检出率 34例子宫内膜癌患者成功检出SLN 27例,SLN总检出率79.4%(27/34),SLN双侧检出率55.9%(19/34),SLN单侧检出率23.5%(8/34),其中SLN左侧检出率5.9%(2/34),SLN右侧检出率17.6%(6/34)。
2.2 SLN分布 34例子宫内膜癌患者中,前哨淋巴结显影位于盆腔者共占98.6%(128/140),位于髂总区5.7%(8/140),髂外区62.9%(88/140),髂内区15.7%(22/140),闭孔区14.2%(20/140),腹主动脉旁区1.5%(2/140),骶前区0%。见表1、图1。
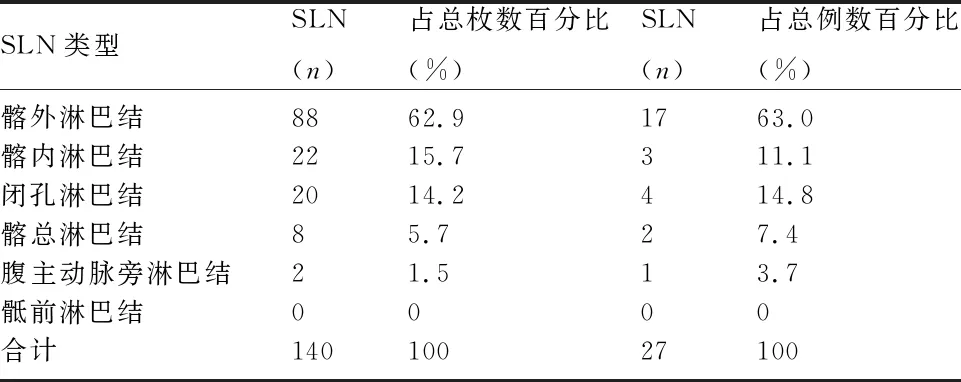
表1 SLN分布特征
图1 肿大的前哨淋巴结(黑色箭头)
2.3 病理结果 34例子宫内膜癌患者病理以中分化子宫内膜腺癌者居多,其中2例脉管间隙受侵(lymphatic and vascular space invasion,LVSI),6例肌层浸润(Depth of muscular penetration,DMI)超过1/2,SLN微转移1例,该患者仅有一项危险因素(病灶直径2cm)。子宫肌层浸润、病理分级可能是子宫内膜癌前哨淋巴结微转移的重要影响因素。见表2、图2。
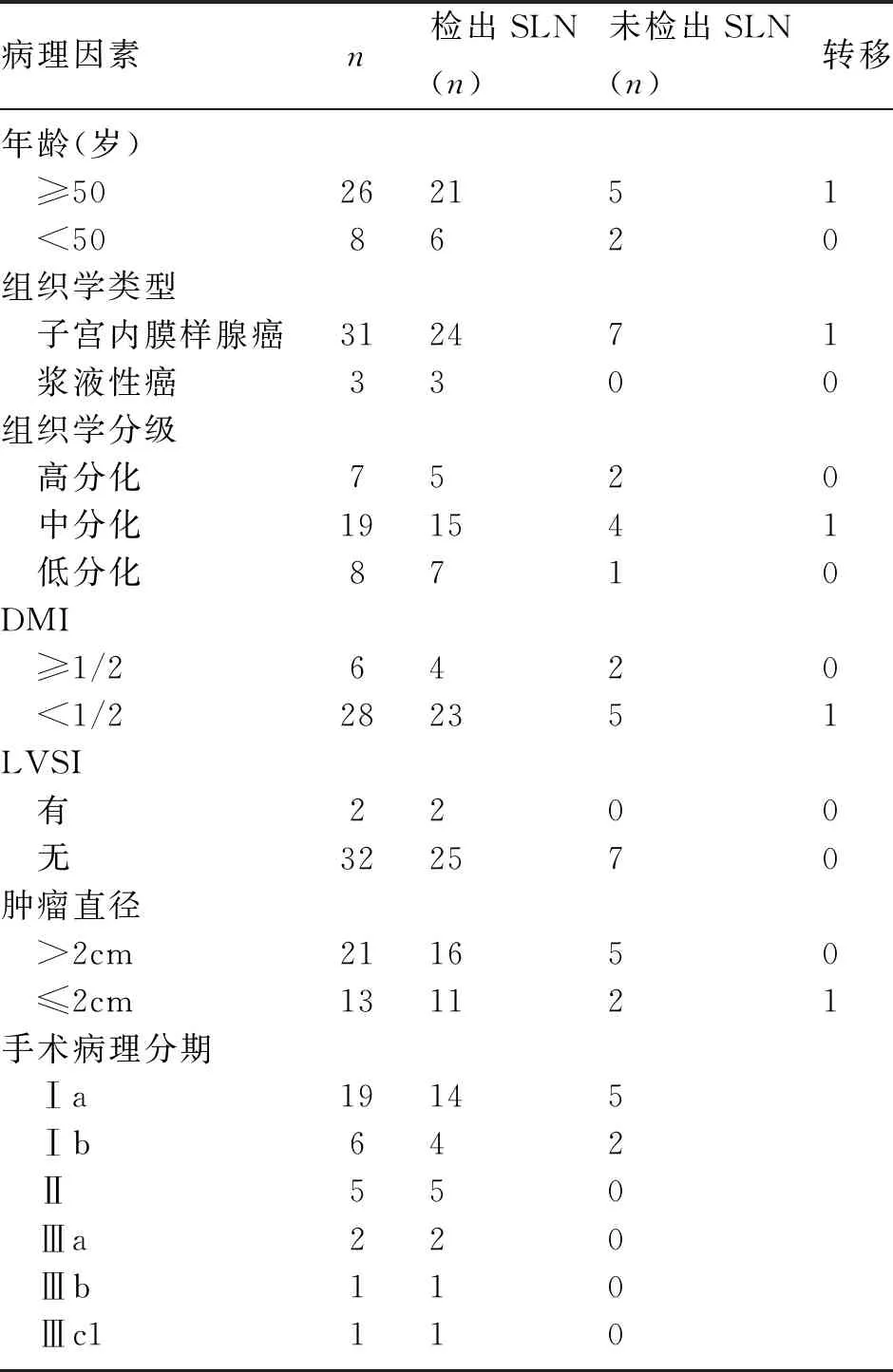
表2 34例患者临床病理特征
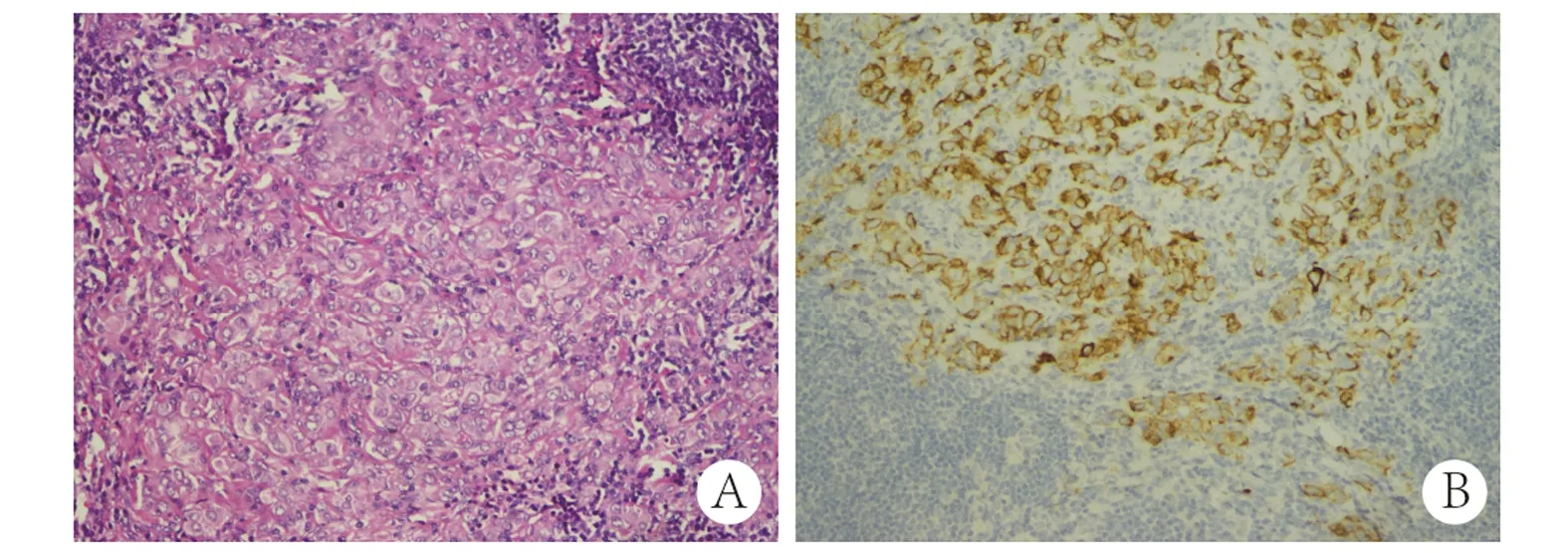
图2 淋巴结转移(10×20)
2.4 SLN与盆腔淋巴结转移状态对比 27例子宫内膜癌患者成功检测出前哨淋巴结,前哨淋巴结SLN及盆腔淋巴结PLN均无转移者(真阴性)共26例,SLN及PLN均有转移者(真阳性)1例。SLN检测盆腔淋巴结微转移的灵敏度100%(1/1),特异度100%(26/26),准确性100%(27/27),SLN假阴性率0%,阳性预测值100%,阴性预测值100%。见表3。
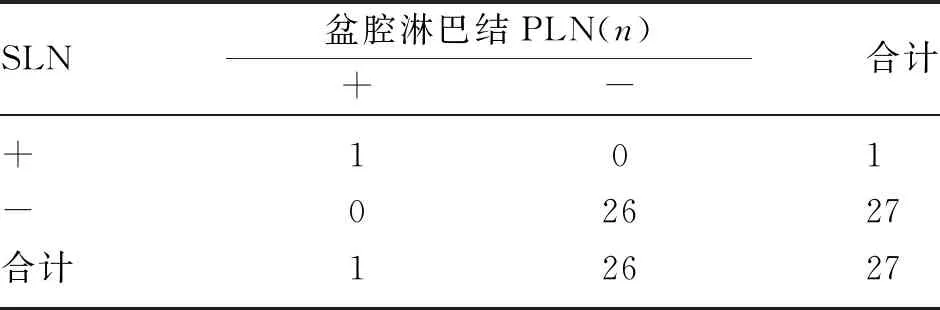
表3 SLN与PLN转移状态的一致性比较
3 讨 论
淋巴转移是子宫内膜癌的主要转移途径,其直接影响患者预后,是决定患者后期是否采取辅助治疗方案的主要因素。根据子宫内膜癌诊疗指南[1],存在下述高危因素的患者,如非子宫内膜样腺癌、高级别腺癌、肌层浸润超过1/2、脉管间质受侵、肿瘤直径大于2cm、宫颈间质受侵等,均应行盆腔和腹主动脉旁淋巴结切除。但大多数患者经系统性淋巴结切除术后并未发现有淋巴结转移。因此,可用SLN活检来检测淋巴结转移情况,在保证手术效果的同时缩小手术范围,避免系统性淋巴结切除引起的多种并发症。病理超分期可检测出常规病理方法所不能发现的淋巴结微转移[8],可提高SLN阴性预测价值,有助于为子宫内膜癌患者提供更精准的治疗方案,降低术后复发率。
子宫内膜、子宫肌层、子宫浆膜以及子宫颈等都可作为子宫内膜癌前哨淋巴结示踪剂的注射部位,但随着研究的不断深入[9],越来越多的学者认为宫颈注射是子宫内膜癌SLN显影最佳的注射途径。美国的斯隆-凯特琳纪念癌症中心(Memorial Sloan-Kettering Cancer Center,MSKCC)推荐宫颈3点、9点注射示踪剂。2001年Cox等[10]对乳腺癌SLN绘图识别技术进行研究,指出SLN绘图活检需要有一个学习曲线,以确保较高的SLN检出率及阴性预测值。Khoury-Collado等[11]提出,子宫内膜癌SLN检测需要存在30例的学习曲线。2012年Barlin等[12]对子宫内膜癌SLN绘图识别技术进行了相关研究,实验中子宫内膜癌患者前哨淋巴结检测率80.5%。本文34例子宫内膜癌患者中,27例患者成功检测出至少1枚前哨淋巴结,SLN总检出率为79.4%(27/34)。子宫内膜癌存在双侧淋巴引流特征,可出现双侧SLN出现与否或检出位置的不一致,需要分侧统计。国内一项研究显示,SLN双侧检出率35.21%,SLN单侧检出率6.9%,假阴性率2.0%,2例假阴性病例均为单侧前哨淋巴结显影,研究指出在双侧前哨淋巴结显影的情况下进行病理超分期检测能有效减少假阴性率[8]。本研究中,SLN双侧检出率55.9%(19/34),高于SLN单侧检出率23.5%(8/34),其中SLN左侧检出率5.9%(2/34),SLN右侧检出率17.6%(6/34)。目前本研究组的34例子宫内膜癌灵敏度100%(1/1),特异度100%(26/26),准确性100%(27/27),SLN假阴性率0%,阳性预测值100%,阴性预测值100%。但证据强度尚不足,有待更大样本、多中心的研究,对比不同的示踪剂,对于有经济能力的患者,最好选择敏感性更高的示踪剂,如吲哚菁绿,美兰联合锝99。
Hafner等[13]提出,常规HE染色法探测出小于3个细胞直径的肿瘤细胞团几率仅为1%。前哨淋巴结绘图联合病理超分期检测技术可致5%~15%患者分期上升,它是对前哨淋巴结进行连续切片以实现小体积转移的检测。Raimond等[14]研究中,子宫内膜癌SLN绘图的淋巴结转移检出率比系统性淋巴结切除提高了近3倍,其中8.1%是通过病理超分期检测出的。Touhami等[15]研究发现,在常规病理检测为阴性的淋巴结中7%存在着微转移,而这些微转移是通过前哨淋巴结病理超分期检测出的,因此将病理超分期技术应用于子宫内膜癌更能准确地检测淋巴结情况,虽然这种方法复杂、费时,国内少有开展,但是SLNB的必不可少的关键环节[6,16]。Kim等[17]指出,子宫肌层浸润、病理分级是前哨淋巴结微转移的重要影响因素,研究中病理超分期检测出SLN转移23例,使得4.5%手术病理分期升高。Todo等[18]研究中,与子宫内膜癌淋巴结无转移组相比,微转移组的8年总生存率和无复发生存率均明显降低,认为淋巴结微转移是子宫内膜癌复发的独立危险因素。但这个观点目前尚不能明确,因为现行的实验多是小样本病例对照研究且淋巴结转移率很低。本研究中,LVSI阳性2例(5.9%),肌层浸润超过1/2者6例(17.6%),肿瘤直径大于2cm 21例(61.8%),低分化者8例(23.5%),SLN微转移1例(2.9%)。
与宫颈癌的阶梯式淋巴转移途径不同,子宫内膜癌具有跳跃性及多途径的淋巴转移特点,前哨淋巴结90%位于髂外、髂内、闭孔区,闭孔淋巴结与腹主动脉旁淋巴结转移状态紧密相关,髂外淋巴结转移的多是病灶局限于子宫体者,闭孔及髂总淋巴结转移的多是宫颈受病灶侵犯者。本研究中,34例子宫内膜癌患者中前哨淋巴结显影位于盆腔者占98.5%,髂总区、髂外区、髂内区、闭孔区、腹主动脉旁区、骶前区分别为5.7%(8/140),62.9%(98/140),15.7%(22/140),14.2%(20/140),1.5%(2/140),0%。
宫颈注射亚甲蓝用于显示子宫内膜癌前哨淋巴结,操作方便、安全可行,对于经济能力有限的患者或在经济水平较低的地区可作为一种较好的示踪剂,SLN绘图灵敏度较高、特异性较好,联合病理超分期可以检测出传统病理学方法不能发现的淋巴结微转移,为子宫内膜癌患者提供更精准的治疗方案。但目前仍需要大样本、多中心的研究,对比不同的示踪剂,在同一组研究中采用相同的示踪剂、相同注射部位,长期随访以明确淋巴结微转移是否对子宫内膜癌患者的总生存率及无复发生存率存在影响。

