盐响应型蛋白质吸附阳离子交换膜
向燕,谢锐,2,巨晓洁,2,汪伟,2,刘壮,2,褚良银,2
(1 四川大学化学工程学院,四川成都610065;2 四川大学高分子材料工程国家重点实验室,四川成都610065)
高纯度蛋白质作为最重要的生物产品之一,在疾病诊断、治疗和预防研究中发挥着至关重要的作用[1-2]。然而蛋白质纯化成本居高不下,迫切需要开发一种经济、高效的纯化工艺[3-4]。近年来,蛋白质吸附膜因其具有多孔结构、吸附速度较快、压降较小等优点,被认为是一种前景广阔的蛋白质纯化手段[5-6]。其中,盐响应型离子交换膜能够响应环境中的盐浓度而实现蛋白质在膜上的吸附和解吸,只需改变盐浓度即可实现蛋白质的纯化[7-8]。制备具有优异蛋白质吸附性能和再生能力的盐响应型离子交换膜对高效蛋白质纯化具有重要的意义。
通常,获得性能优异的盐响应型离子交换膜需要具备三个要素,即化学稳定性优异的基膜材料、含量丰富的蛋白质吸附官能团及简单可控的制备方法。相比于聚弱电解质,聚强电解质具有强水合能力和显著的盐响应性能[9-11],并且能在较宽的pH范围内保持表面电荷不变,操作范围较宽。因此,聚强电解质是制备盐响应型离子交换膜常用的一类功能高分子[12]。目前将聚强电解质引入基膜材料的常用方法有原子转移自由基聚合(ATRP)接枝[7,13-14]等化学法以及共混相转化[15-16]等物理法。Schwellenbach 等[14]采用ATRP 在聚对苯二甲酸乙二醇酯纤维表面接枝甲基丙烯酸甘油酯,再经过一系列衍生化反应生成磺酸基团,得到阳离子交换膜。该膜对溶菌酶(Lys)和人类免疫球蛋白的饱和吸附容量分别为90mg/mL 和92mg/mL。Chenette 等[13]同样采用ATRP 制备了接枝强电解质聚甲基丙烯酸-3-磺酸丙酯钾盐(PSPM)的再生纤维素膜,在pH=8 时,该膜对Lys 饱和吸附容量为97mg/mL。Avramescu 等[16]将含磺酸基团的离子交换树脂Lewatit®与乙烯-乙烯醇共混,再通过液体诱导相分离法制备阳离子交换膜,该膜对初始浓度为1mg/mL的牛血清白蛋白(BSA)的饱和吸附容量为100mg/g。目前常用的方法中ATRP过程较为复杂,共混法过程虽简单但由于功能性的离子交换树脂在相转化过程中较难迁移到膜表面,尚未得到吸附性能较好的盐响应型离子交换膜,此外还存在纤维素类基材膜在水中溶胀导致强度下降、化学稳定性较差等问题[17]。因此,能否从化学稳定性良好的基材膜出发设计一种简单可控的路线来制备吸附性能优异的盐响应型离子交换膜仍具有一定的挑战。
本研究以具有优异化学稳定性和富含叔胺基的聚醚砜酮为基膜材料[18]、甲基丙烯酸缩水甘油酯(GMA)作为桥梁物质,通过“一锅法”将聚强电解质功能高分子聚甲基丙烯酸-3-磺酸丙酯钾盐(PSPM)接枝到多孔基膜上制备盐响应型阳离子交换膜PTA-GS,探究了该膜对具有不同等电点蛋白质的吸附情况,系统研究了蛋白质初始浓度、吸附时间和环境盐浓度对PTA-GS膜蛋白质吸附量的影响,并分析吸附过程的热力学和动力学规律,揭示了蛋白质吸附机理。该研究结果可为制备吸附性能优异的盐响应型蛋白质吸附膜提供新思路,并为阳离子交换膜上蛋白质的吸附行为研究提供指导。
1 材料和方法
1.1 材料
含叔胺基聚醚砜酮(PTA),由中国科学院长春应化所提供;N,N′-二甲基甲酰胺(DMF)、乙二醇单甲醚(EGM)、过硫酸铵(APS)、氯化钠(NaCl)均分析纯,来自成都市科隆化学品有限公司;甲基丙烯酸-3-磺酸丙酯钾盐(SPM)、GMA均分析纯,来自中国阿拉丁试剂有限公司;BSA(分子量68000g/mol)、Lys(分子量14000g/mol)、磷酸缓冲盐溶液(PBS)均分析纯,来自美国索莱宝公司。实验用水来自Milli-Q 纯水系统,电阻率为18.2MΩ·cm。
1.2 主要仪器
搅拌脱泡机,ARE310型,日本THINKY公司;平板刮膜机,FM-2 型,宁波江北新成金机械厂;恒温恒湿箱,TE-PE-100型,韩国JEIO公司;pH/电导率/离子综合测试仪,SevenMulti 型,梅特勒-托利多仪器上海有限公司;水浴恒温振荡器,SHZ-B 型,上海博迅医疗生物仪器有限公司;膜孔径仪,POROLUX 1000 型,德国Porometer 公司;台式扫描电镜(SEM),Phenom Pro 型,荷兰Phenom 公司;界面张力仪,DSA25 型,德国KURSS 公 司; X 射 线 光 电 子 能 谱(XPS),XSAM800型,英国Kratos公司;固体表面zeta电位分析仪,SurPASS2型,奥地利Anton Paar公司;超微量紫外分光光度计,NanoDrop One 型,美国Thermo Fisher 公司;紫外-可见光分光光度计,UV1800型,日本SHIMADZU公司。
1.3 PSPM修饰的盐响应型阳离子交换膜的制备
制备PTA膜:称量1.2g充分干燥的PTA粉末并量取1.2mL 致孔剂EGM 加入到6.5mL DMF 溶剂中(PTA和EGM与体系的总质量之比均恒定为14%),密封,转移至搅拌脱泡机中溶解脱泡4h,得到的铸膜液在25℃下静置12h。将平板刮膜机的刮刀间隙设定为180μm,刮膜。将得到的湿膜迅速转移到蒸气温度为50℃、相对湿度为70%的恒温恒湿箱中停留1min,再浸入25℃纯水中,静置10min。所制得的PTA膜在纯水中浸泡48h,每天换水3次,之后用滤纸吸干膜表面的水,置于温度为25℃、相对湿度24%的干燥柜中保存。
制备PTA-GS 膜:称量2.5g SPM 单体溶解于80mL 纯水中,加入直径4cm 的PTA 膜片后密封,搅拌20min并持续通入氮气以除去氧气。同时量取129μL GMA 加入到20mL 纯水中,搅拌20min,并以每秒1滴的速度加入单体溶液中,在65℃、氮气氛围中开环反应1h。接着,将反应溶液的温度升高至75℃,加入0.01g 引发剂APS 引发自由基聚合反应,反应9h。反应结束后,得到的接枝膜置于纯水中浸泡72h,每天换水3 次。其中,GMA 与SPM的物质的量比恒定为1∶10。
1.4 PSPM修饰的盐响应型阳离子交换膜的表征
利用SEM 对膜的微观结构进行表征,测试前将自然干燥的膜样品固定在样品台上喷金处理60s,用氮气吹扫以保持样品洁净,然后置于样品杯进行观察。膜断面样品需先在液氮中深冷30s并脆断,晾干后再固定于样品台上。
利用界面张力仪的Sessile Drop 模式来测试膜表面的水接触角,测试过程在室温下进行,悬挂的水滴体积设定为4μL,并利用Circle 模型计算接触角大小,测试3 次取平均值。利用固体膜表面zeta电位分析仪并基于流动电位法来测试膜表面的电位,使用1mmol/L氯化钾作为电解质溶液,两个样品的间隙为0.1mm,测试压力为300mbar(1bar=105Pa)。
利用膜孔径仪在室温下测量膜的平均孔径及其分布,测试前用测厚规测量膜厚,然后将膜置于全氟醚溶液中浸泡20min使其完全浸润,并设定最大许用压力进行测量。利用称重法测试膜的孔隙率,首先将膜剪成1cm×2cm 的矩形,并于80℃下干燥6h,称重得干膜的质量。然后,将干膜先后用70%的乙醇水溶液和纯水分别浸泡2h 和12h(换水3次),用滤纸快速吸干膜表面的水并称量膜的湿重。膜的孔隙率可通过文献[19]中的公式计算得到。
利用XPS来测定膜表面的化学组成,将干态膜剪成2cm×2cm 的正方形作为测试样品,测试碳、氧、氮和硫的全谱,使用激发源为铝(Al),能量范围为X 1,在低的分辨率和放大倍数下进行测试。
1.5 PSPM修饰的盐响应型阳离子交换膜的性能
1.5.1 PSPM 修饰的盐响应型阳离子交换膜的盐响应性能
通过比较纯水和不同浓度NaCl 溶液的跨膜通量来表征膜的盐响应性能,并采用式(1)定量计算盐响应开关系数(RNaCl/w)。

式中,JNaCl,x、Jw分别表示物质的量浓度为x的NaCl溶液的跨膜通量、纯水跨膜通量,kg/(m2·h·MPa)。跨膜通量是在室温、跨膜压差600Pa下测定的,膜的有效过滤面积恒为12.56cm2。
1.5.2 PSPM 修饰的盐响应型阳离子交换膜的蛋白质吸附性能
以Lys 为例,PTA-GS 膜对蛋白质的静态吸附性能测试过程如下。将不同质量的Lys粉末溶解在50mL PBS 缓冲液中(pH 约为7.2)配制不同初始浓度的Lys 溶液,作为吸附溶液。各量取两组20mL蛋白质溶液,其中一组加入一定大小的PTAGS膜(直径4cm膜片的四分之一大小),密封并置于水浴振荡器中(振荡速度为120r/min、温度为25℃)培养24h。利用超微量紫外分光光度计在波长280nm处测试剩余吸附溶液和原液中Lys的浓度,再代入式(2)计算PTA-GS膜的蛋白质平衡吸附量(qe,mg/g)。BSA溶液的吸光度使用紫外-可见光分光光度计测得,根据标准曲线换算成浓度再代入式(2)计算qe。
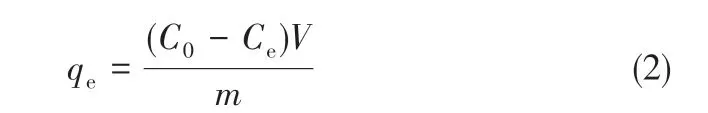
式中,C0和Ce分别为原液和剩余吸附溶液中的蛋白质浓度,mg/mL;m为膜的质量,g;V为用于吸附测试的蛋白质溶液的体积(恒定为20mL),mL。采用多元非线性曲线拟合软件,分别用Langmuir[20]、Freundlich[21]和Redlich-Peterson[22]三种等温吸附模型[式(3)~式(5)]对PTA-GS 膜的蛋白质静态吸附数据进行非线性拟合。
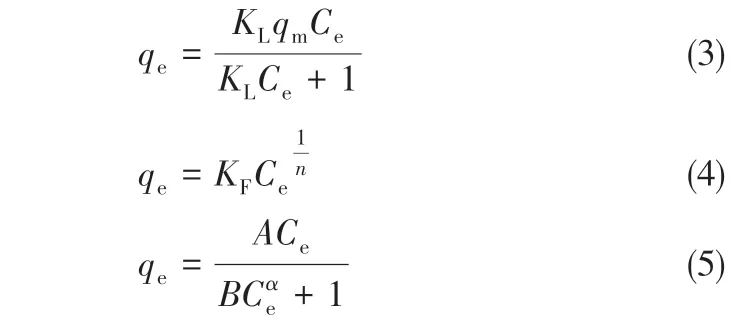
式中,KL为Langmuir吸附平衡常数;qm为膜的最大吸附量,mg/g;KF为Freundlich吸附平衡常数,n为与吸附强度有关的常数;A、B和α为Redlich-Peterson 等温吸附模型的常数,当α为1 时即为Langmuir等温吸附模型。
PTA-GS膜对蛋白质的动态吸附性能测试过程如下。首先配制两组20mL、Lys初始浓度为1.0mg/mL的PBS溶液,其中一组加入一定大小的(直径4cm膜片的四分之一)PTA-GS 膜,并将吸附溶液置于上述条件下,每隔3h 取一次样,将某个时刻的浓度代替Ce代入式(2)可计算得到各个时刻膜的蛋白质吸附量。由于PTA-GS膜对BSA吸附量较小,实验中使用较大面积膜片,即直径4cm圆形膜片。在PBS溶液中加入不同质量的NaCl,再按照上述步骤测试PTA-GS膜在不同浓度NaCl环境中的蛋白质吸附量。采用拟一级和拟二级动力学方程线性表达式[式(6)、式(7)][23-24]来分析PTA-GS膜的蛋白质动态吸附行为。

式中,t为吸附的某一时刻,h;qt为时刻t时PTA-GS 膜的蛋白质吸附量,mg/g;k1为拟一级速率常数,h-1;k2为拟二级速率常数,g/(mg·h)。
1.5.3 PSPM 修饰的盐响应型阳离子交换膜的蛋白质脱附性能
配制1.5mg/mL的Lys的PBS溶液,按上述吸附步骤进行PTA-GS膜的吸附后,将其置于5mL浓度为1mol/L 的NaCl 溶液中,水浴振荡24h 后测试脱附液中Lys的浓度,按式(8)、式(9)计算脱附量和脱附率。


式中,qd为PTA-GS膜的蛋白质脱附量,mg/g;Rd为蛋白质脱附率;Cd为脱附液中蛋白质的质量浓度,mg/mL;Vd为用于脱附测试的蛋白质溶液的体积,mL。
2 结果与讨论
2.1 PSPM 修饰的盐响应型阳离子交换膜的形貌与孔径分布
PTA 膜接枝PSPM 功能高分子前后的扫描电镜照片如图1所示。接枝前后膜的表面均呈现出均匀的多孔结构,但相较于PTA膜,PTA-GS 膜表面的孔径略有减小。PTA膜和PTA-GS 膜的平均孔径和变异系数(即膜孔孔径的标准偏差与平均孔径的比值)[25]分别为1.470μm 和9.3%、1.423μm 和8.4%。且PTA-GS 膜的断面保留了PTA 膜的交错网络结构,该多孔结构可为蛋白质吸附提供大量的吸附位点。此外,接枝前后膜的孔隙率分别为(51.5±5.1)%和(57.0±6.0)%。可见,接枝PSPM 后膜的平均孔径略有减小,孔隙率略有提升,并保持均匀的孔径分布。接枝PSPM 后,PTA-GS 膜表面的水接触角从PTA 膜的89.3°减小到27.4°,说明具有强水合能力的PSPM 聚电解质链的引入大大提高了膜的亲水性。

图1 PTA膜和PTA-GS膜的SEM照片和表面水接触角
2.2 PSPM 修饰的盐响应型阳离子交换膜的化学组成
PTA 和PTA-GS 膜的XPS 全谱图如图2 所示。接枝PSPM 前后,膜的XPS 全谱中均可以观察到C 1s、N 1s 和O 1s 的峰,对应的结合能分别为288.2eV、403.9eV 和535.2eV,主要来源是含叔胺基的聚醚砜酮基材。对于PTA 膜而言,对应结合能为233.6eV 和171.2eV 的S 2s 和S 2p 的峰较为微弱,S 元素的质量分数仅为2.38%。这是因为PTA膜的S元素仅来源于基材上的砜基(O==S==O),含量较低,理论值约为4.81%,高于XPS实测值。相较于PTA 膜,PTA-GS 膜谱图中S 2s 和S 2p 的峰显著增强,S 元素的质量分数达到5.84%。元素S 含量的增加源于含磺酸基团的PSPM,证明PSPM 功能高分子成功接枝到PTA膜上。利用S元素含量的测试结果计算得到膜的接枝率约为14.4%,而称重法计算得到接枝率约为23.9%。可见,由于PTA膜表面富含活性叔胺基,采用1.3 节中的方法成功接枝PSPM 聚强电解质高分子链,并且其接枝率较高,可为蛋白质提供充足的吸附位点。

图2 PTA膜和PTA-GS膜的XPS全谱图
2.3 PSPM 修饰的盐响应型阳离子交换膜的蛋白质吸附性能
2.3.1 蛋白质初始浓度和吸附时间对PTA-GS膜蛋白质吸附量的影响
蛋白质初始浓度和吸附时间对PTA-GS膜的蛋白质吸附量的影响如图3。无论是静态吸附还是动态吸附过程,PTA-GS 膜对BSA 和Lys 的吸附量呈现相似的变化规律。在25℃条件下,PTA-GS 膜对两种蛋白质的平衡吸附量qe随蛋白质初始浓度的增加先增大,达到0.8mg/mL 后趋于平衡,见图3(a)。但PTA-GS 膜对两种蛋白质的饱和吸附量相差较大,其对Lys和BSA的饱和吸附量分别为189.7mg/g和6.8mg/g。由表面zeta 电位分析可知,在pH 为7的低浓度氯化钾电解质溶液中,PTA和PTA-GS 膜表面的zeta电位分别为-7.95mV和-59.35mV,说明中性条件下,PTA-GS 膜表面具有较强的负电性。因此,在pH 为7.2 的PBS 缓冲溶液中,PTA-GS 膜呈电负性,而由于此时的pH 小于Lys 的等电点11而大于BSA 的等电点4.7,Lys 带正电而BSA 带负电。可见,PTA-GS 膜对Lys 具有较高的吸附量是因为PTA-GS 膜与Lys 间的静电吸引作用,而由于带负电的BSA 与膜表面负电荷存在静电排斥作用,故PTA-GS膜对BSA的吸附量较低。此外,随着溶液中蛋白质浓度的增加,Lys 分子与PTA-GS 膜接触的概率增大,所以PTA-GS膜的平衡吸附量也随之增加;但PTA-GS膜的吸附位点有限,故可吸附的蛋白质量有限,因此当蛋白质占据了PTA-GS膜上所有吸附位点后,继续增加蛋白质浓度无法使PTA-GS膜的吸附量增加。
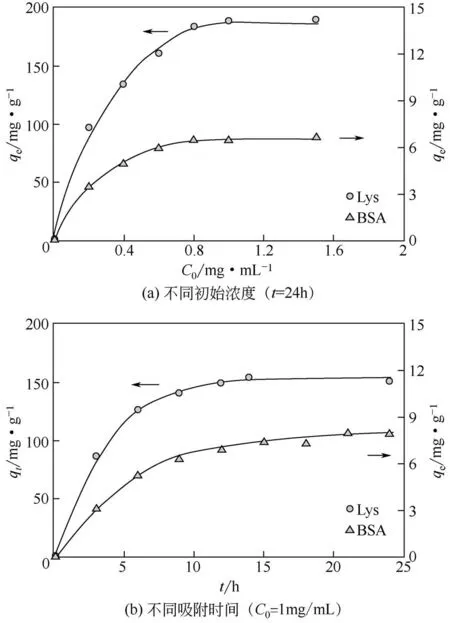
图3 初始浓度和吸附时间对PTA-GS膜蛋白质吸附量的影响(pH=7.2,T=25℃)
PTA-GS膜吸附两种蛋白质的动力学行为如图3(b)所示。随着吸附时间的延长,PTA-GS膜对Lys和BSA 的吸附量均呈现出先快速增大后逐渐平稳的趋势,先后在12h 和18h 后达到平衡,平衡吸附量分别为151.9mg/g 和8.1mg/g。与BSA 相比,PTA-GS 膜吸附Lys 时达到吸附平衡所需的时间更短,且平衡吸附量更高。这种现象可能的原因是,PTA-GS 膜与BSA分子存在静电排斥作用,主要依靠范德华力和氢键力吸附BSA,属于分子间的弱相互作用力;而PTA-GS 膜吸附Lys 则是借助膜表面大量负电荷与该环境下带正电的Lys 的静电引力,即库仑引力,库仑引力的作用比范德华力和氢键力的作用强得多,因此PTA-GS 膜吸附Lys 时具有更快的吸附速度和更高的平衡吸附量。
2.3.2 PTA-GS膜吸附蛋白质的等温吸附模型
采用Langmuir、Freundlich 和Redlich-Peterson三种等温吸附模型对PTA-GS膜的蛋白质静态吸附数据进行拟合,结果如图4所示,相应的模型参数见表1。对于Lys 在PTA-GS 膜上的吸附,Redlich-Peterson 模型的相关系数R2和卡方系数χ2分别为0.9962 和0.3674,Langmuir 模 型 的R2和χ2分 别 为0.9938 和0.4975,Freundlich 模型的R2和χ2分别为0.9764和2.1665。根据卡方检验的基本原理,选择95%作为置信度,查询卡方表可知当模型拟合得到的卡方系数χ2小于1.635时,可有95%的把握认为实验数据符合该模型。 Redlich-Peterson 和Langmuir 模型的R2均高于0.99,χ2较为接近且均小于1.635,因此可认为这两种模型对实验数据的拟合效果更好,由该结果可知PTA-GS 膜对Lys 的吸附同时存在单分子层吸附和多分子层吸附,但主要吸附形式是单分子层吸附,原理是带正电的蛋白质Lys 与带负电的PTA-GS 膜间的库仑引力。对于BSA在PTA-GS 膜上的吸附,非线性拟合的结果与Lys 吸附结果相似,Redlich-Peterson 模型的R2和χ2分别为0.9978和0.0072,对实验数据的拟合效果最好,Langmuir 模型次之,结果表明PTA-GS 膜对BSA的吸附也同时存在单分子层吸附和多分子层吸附,区别在于PTA-GS膜吸附BSA主要依据的是范德华力和氢键力,均是属于分子间的弱作用力。通过Langmuir模型参数得到25℃环境下PTA-GS膜吸附BSA 的最大吸附量qm和平衡常数KL为8.2mg/g 和3.75,而吸附Lys 的最大吸附量qm为232.1mg/g,平衡常数KL为4.30,均大于前者。结果表明PTA-GS膜对带正电的蛋白质Lys具有更好的吸附性能,能够选择性地吸附等电点差异较大的蛋白质。

图4 PTA-GS膜吸附蛋白质的等温吸附模型
2.3.3 PTA-GS膜吸附蛋白质的动力学模型
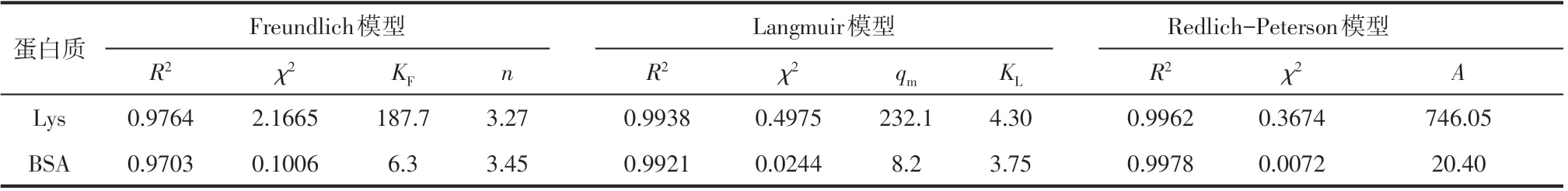
表1 三种等温吸附模型的模型参数
采用拟一级动力学和拟二级动力学方程来拟合PTA-GS 膜对蛋白质的动态吸附行为,结果如图5所示,相应的模型参数见表2。通常,采用相关系数的平方R2的大小来判断拟合效果。对于PTA-GS膜吸附Lys的实验数据,采用拟二级动力学方程进行拟合时,相关系数R2为0.9966,高于拟一级动力学方程的相关系数0.9727。根据拟二级动力学方程计算出的平衡吸附量qe为196.1mg/g,比拟一级动力学方程计算结果(233.8mg/g)相比更接近实验值,表明PTA-GS 膜吸附Lys 的吸附行为更符合拟二级动力学方程,即吸附速率由吸附位点和Lys的浓度共同决定。而BSA 的拟合结果则刚好相反,采用拟一级动力学方程拟合的R2为0.9934,而采用拟二级动力学方程拟合的R2为0.9866,拟一级动力学方程拟合的R2更高且高于0.99。同时,根据两种动力学方程计算出的平衡吸附量qe分别为7.7mg/g和11.4mg/g,可知拟一级动力学方程计算值与实验值(8.1mg/g)更为接近,由此可知,PTA-GS膜吸附BSA 的吸附行为更符合拟一级动力学方程。由于PTA-GS膜与BSA分子存在静电排斥作用,膜上BSA的吸附量很低,故吸附液中BSA的浓度变化非常小,可近似认为BSA浓度不变,而PTA-GS膜上可吸附BSA 的吸附位点有限,故吸附速率由膜上吸附位点决定。
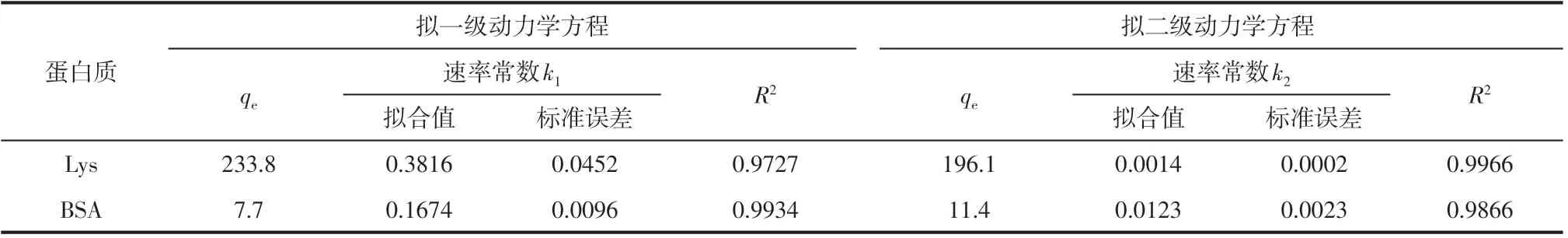
表2 两种动力学模型的模型参数表

图5 PTA-GS膜吸附蛋白质的动力学模型
2.3.4 NaCl浓度对PTA-GS膜渗透通量和蛋白质吸附量的影响
PTA-GS膜对不同浓度NaCl溶液的跨膜通量和盐响应开关系数RNaCl/w如图6(a)所示。随着NaCl 溶液浓度的增加,PTA-GS膜的通量和RNaCl/w值均呈增加的趋势。其中,PTA-GS 膜的纯水通量为12740kg/(m2·h·MPa),而1mol/L 的NaCl 溶液的跨膜通量高达404720kg/(m2·h·MPa),盐响应开关系数RNaCl/w达到31.8,表现出显著的盐响应性能。在低盐浓度环境中,含有大量负电磺酸基团的PSPM高分子链之间存在较强的静电排斥作用,同时由于PSPM 高分子链上磺酸基团与水分子之间的强水合作用,使得PSPM 链很大程度地溶胀,膜孔“关闭”,通量减小;而在高盐浓度环境中,Na+与带负电荷的磺酸基团结合,减弱了高分子链间的静电排斥相互作用,使PSPM 链收缩,膜孔“打开”,通量显著增加。
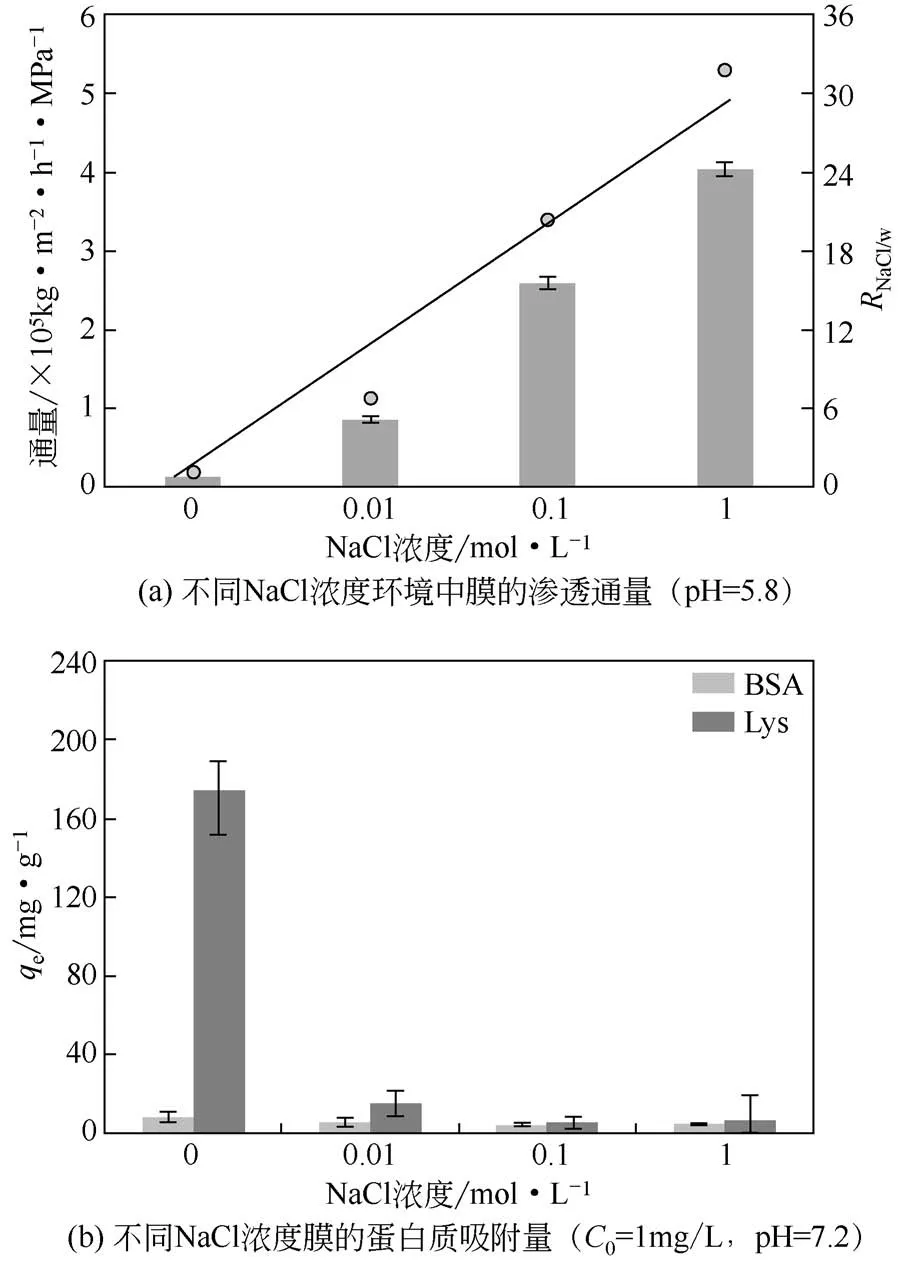
图6 NaCl浓度对PTA-GS膜渗透通量和蛋白质吸附量的影响(T=25℃)
在中性PBS 缓冲溶液中,不同NaCl 浓度对PTA-GS 膜的蛋白质平衡吸附量的影响如图6(b)所示。PTA-GS 膜在不同NaCl 浓度的PBS 溶液中的BSA平衡吸附量均较小(小于8.1mg/g),而PTA膜在相同条件下的BSA吸附量较高,达到(37.3±3.6)mg/g。这是由于PTA-GS膜与BSA分子之间存在较强的静电排斥作用,而PTA膜相对较为疏水(图1),BSA可通过疏水作用吸附在膜表面,故PTA 膜的BSA吸附量较高。类似地,在不同NaCl 浓度的缓冲溶液中,PTA 膜对Lys 也具有较高的吸附量,即(39.7±3.9)mg/g。而PTA-GS 膜对Lys 的平衡吸附量则与NaCl 浓度密切相关。当NaCl 浓度为0、0.01mol/L、0.1mol/L和1mol/L时,PTA-GS膜上Lys吸附量qe分别为(174.2±22.8)mg/g、(15.0±6.4)mg/g、(5.4±3.2)mg/g 和(6.4±6.4)mg/g,可见,平衡吸附量随NaCl 浓度的升高而降低。当环境NaCl 浓度较低时,PSPM 链上因静电排斥作用而伸展,吸附位点(即带负电的磺酸基团)充分暴露在膜表面,借助静电吸引力将大量带正电的Lys 吸附在PTA-GS 膜上[图7(a)]。随着NaCl 浓度的增加,Na+与PTA-GS膜上磺酸基团结合减弱了PSPM链间的静电排斥作用,PSPM 链收缩,导致各吸附位点距离缩短,增大Lys 与吸附位点结合的空间位阻;同时Na+与PTA-GS膜上PSPM链的负电荷形成离子对,屏蔽了链上的负电荷,导致PTA-GS 膜与Lys 的静电吸引作用减弱,因此Lys的平衡吸附量显著减小[图7(b)]。因此,PTA-GS膜在无NaCl的PBS溶液中具有最好的吸附效果,而较高浓度NaCl 的PBS 溶液可以大大降低Lys 在膜上吸附。当Lys 初始浓度为1.5mg/mL时,PTA-GS膜在无NaCl的PBS缓冲液中对Lys 的平衡吸附量为208.7mg/g;使用含1mol/L NaCl 的PBS 缓冲液振荡洗涤后Lys 的脱附量为165.5mg/g,脱附率达到79.3%。表明PTA-GS 膜具有较好的再生能力。

图7 PTA-GS膜吸附和脱附蛋白质的示意图
3 结论
(1)通过简单可控的“一锅法”将聚强电解质PSPM 接枝到化学稳定性良好的PTA 微孔膜上,成功制备了盐响应型离子交换膜PTA-GS。
(2)Redlich-Peterson 和Langmuir 等温吸附模型能较好地拟合Lys 和BSA 在PTA-GS 膜上的吸附行为。此外,PTA-GS 膜对Lys 的吸附过程符合拟二级动力学方程,而BSA在PTA-GS膜上的吸附过程与拟一级动力学方程更相符。
(3)在无NaCl 的中性缓冲溶液中,呈强电负性的PTA-GS 膜对带正电荷的Lys 表现出较高平衡吸附量,高达(174.2±22.8)mg/g,而BSA 的平衡吸附量仅为(8.1±2.5)mg/g。此外,PTA-GS 膜的平衡吸附量随NaCl 浓度的升高而降低。其在含1mol/L NaCl的缓冲溶液中再生后的Lys脱附率可达79.3%。
(4)PTA-GS 膜的蛋白质脱附率和吸附量仍有提升空间,今后可选择对蛋白质吸附量更低的基材以降低不可逆吸附、提高蛋白质吸附或改善膜的制备方法(如采用静电纺丝等)以提升膜的孔隙率,获得更高的蛋白质吸附性能。

