兔可食性组织中杆菌肽残留量HPLC-MS/MS测定方法
聂贞,全家兴,王美红,张小龙,蒋玥,卜仕金
(扬州大学兽医学院 江苏省动物重要疫病与人兽共患病防控协同创新中心,江苏 扬州 225009)
杆菌肽是由一组类似的多肽成分组成的混合物,其中杆菌肽A、B1和B2组分被认为最具抗微生物活性[1-2]。兽医临床上常见以杆菌肽锌和杆菌肽亚甲基水杨酸盐形式用于畜禽促生长和防治动物的坏死性肠炎[3-5]。在欧盟,亚甲基水杨酸杆菌肽还被推荐用于治疗由产气荚膜梭菌引起的兔坏死性肠炎。杆菌肽在猪和禽等主要生产动物的可食性组织中及奶中残留量的检测方法已有很多研究报道[6-10],但杆菌肽在兔的可食性组织中残留量的检测分析方法至今未见报道。因此,开展兔可食性组织中杆菌肽的残留检测方法研究,对杆菌肽今后推广应用于家兔和指导临床合理用药具有重要的现实意义。研究旨在建立兔可食用组织(肌肉、脂肪、肾脏和肝脏)中杆菌肽残留标志物的高效液相色谱串联质谱联用(HPLC-MS/MS)检测法,为兔可食性组织中杆菌肽残留的监控提供技术手段,这对保障人类消费者食用动物源性食品的安全性具有重要意义。
1 材料与方法
1.1 仪器和试剂 仪器:AB sciex Qtrap 6500plus三重四极杆串联质谱仪;AB sciex ExionLCTMAC高效液相色谱仪;XBridge®C18色谱柱(2.1 mm×100 mm,3.5 μm);EppendorfCentrifuge 5810 R台式高速冷冻离心机;QUINTIX124-1CN电子天平;上海沪西WH-1微型涡旋混合仪;Eppendorf可调移液器(10 μL、100 μL、5000 μL)。
试剂:甲醇、乙腈(色谱纯,美国TEDIA公司);三氟乙酸(色谱纯,上海MACKLIN公司);甲酸、氨水(色谱纯,上海阿拉丁公司);三氯乙酸、正己烷(分析纯,国药集团化学试剂有限公司);杆菌肽标准品(杆菌肽A、B1、B2和B3总含量84.8%,杆菌肽A含量53.2%。批号:C10418000,购自德国Dr. Ehrenstorfer GmbH公司);水为符合GB/T 6682规定的一级水。
1.2 标准溶液配制 准确称取约4.68 mg杆菌肽标准品,置10 mL容量瓶中,用0.1%甲酸甲醇溶解并定容至刻度,即配置浓度为0.4 mg/mL(以杆菌肽计)的储备液,于-20 ℃冰箱中保存。准确吸取适量杆菌肽标准储备液,用0.1%甲酸水溶液稀释制备浓度为1000、10000 ng/mL的标准工作液,现配现用。
1.3 方法
1.3.1 液相色谱条件 XBridge®C18色谱柱(2.1 mm×100 mm,3.5 μm),流速:0.4 mL/min,柱温:35 ℃,进样量:5 μL,流动相:A为0.1%甲酸水,B为乙腈,梯度洗脱条件见表1。

表1 梯度洗脱条件
1.3.2 质谱条件 电喷雾离子源,正离子扫描,多反应监测(MRM),喷雾电压5500.0 V,去簇电压120.0 U/V,离子化温度550 ℃,气帘气压力30.0 Psi,碰撞室压力8 Psi。根据杆菌肽离子扫描结果,确定监测离子对见表2。

表2 杆菌肽A、杆菌肽B定性、定量离子对及碰撞能
1.3.3 样品前处理 准确称取2.0(±0.01)g匀浆的兔组织样品于50 mL离心管A内,加入2 mL 10%三氯乙酸乙腈溶液, 涡旋一分钟,加入5 mL 0.5%三氟乙酸水,涡旋五分钟,接着10000 r/min离心5 min,取上清至离心管B。重复提取一次,合并提取液上清于离心管B中。向离心管B中加入5 mL正己烷并10000 r/min离心5 min,弃去上层有机相以及中间乳化层,待净化。将OASIS®PRiME HLB 3cc 150 mg固相萃取柱依次用5 mL甲醇和5 mL水活化后,将离心管B中处理完的样品液过柱,待样品液全部流出后,依次用3 mL氨水甲醇和3 mL 1%甲酸乙酸乙酯淋洗,微微抽干,用2 mL甲醇乙腈洗脱并抽干收集于10 mL指形管中。向指形管加入2 mL 0.1%甲酸水,混匀后过0.22 μm有机滤膜过滤,滤液待HPLC-MS/MS检测。
1.4 定性方法 定性需满足以下条件:①空白样品中不出现与阳性对照相同的离子峰;②特征离子峰信噪比(S/N)≥3;③样品中杆菌肽的保留时间与标准溶液保留时间的偏差在±2.5%之内;④定性离子对的相对丰度与浓度相当的基质标准的相对丰度一致,偏差满足2002/657/EC[11]中的要求。
1.5 定量方法的确立
1.5.1 基质标准曲线的制备 制备空白肌肉、脂肪、肝脏和肾脏样品各6份,经前处理后加入适量的标准工作液配成浓度为50、75、150、300、600、1000 ng/g的基质匹配标准溶液,在本试验所建立的条件下,按照浓度从低至高的顺序依次进样。使用测得的杆菌肽特征离子峰面积作为纵坐标,对应的标准溶液浓度作为横坐标,绘制基质匹配标准曲线。
1.5.2 检测限、定量限的测定 用标准储备液分别制备兔肌肉、脂肪、肝脏和肾脏的空白基质添加样品,再按1.3项下的条件进行处理、分析,取S/N≥3时杆菌肽的浓度为方法的检测限(LOD),S/N≥10时杆菌肽的浓度为定量限(LOQ),每个浓度5个平行。
1.5.3 准确度和精密度的测定 准确称取2 g空白兔肌肉、脂肪、肝脏和肾脏,添加适量的杆菌肽标准工作液,使其浓度分别为50、100、300、800 ng/g。按照1.3.3的方法进行处理后,分别进样5 μL进行HPLC-MS/MS测定。测定的结果带入各自标准曲线中,与真实值比较,以计算回收率。每批次每浓度做6个平行样品,共进行三个批次分三天完成。
2 结果与分析
2.1 方法专属性 在优化的色谱条件下,杆菌肽标准品溶液中杆菌肽A出峰时间约为3.74 min,杆菌肽B的出峰时间约为3.56 min和3.68 min,峰型良好。见图1和图2。
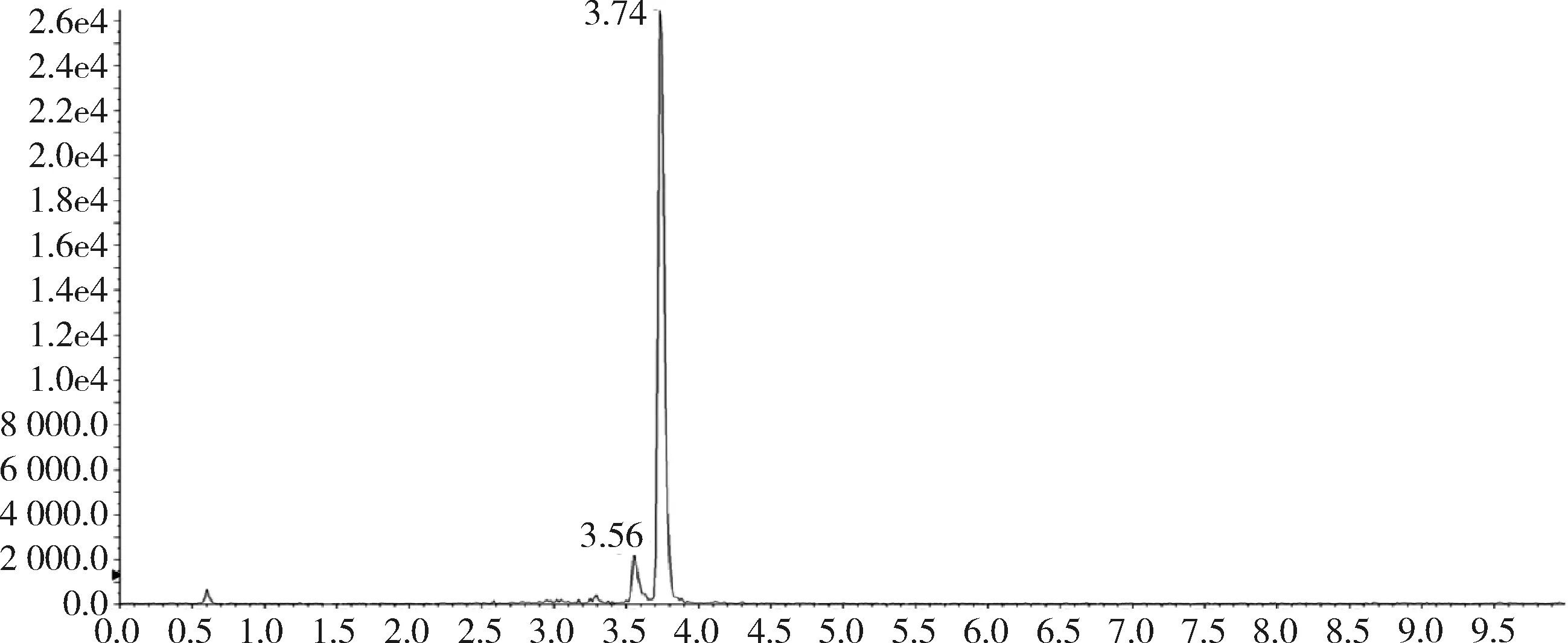
图1 标准品中杆菌肽A总离子流图(杆菌肽50 ng/g)

图2 标准品中杆菌肽B总离子流图(杆菌肽50 ng/g)
对比兔的可食性组织(肌肉、脂肪、肝脏、肾脏)空白基质图谱与空白基质添加杆菌肽标准品的图谱,可以看出标准品中杆菌肽A、杆菌肽B都与基质杂质分离良好,互不干扰,可用于定量分析。扫描空白基质与空白基质添加药物(50 ng/g)样品中杆菌肽A定量离子对(711.6>199.1)的离子流图见图3~图10,扫描空白基质与空白基质添加药物(50 ng/g)样品中杆菌肽B定量离子对(705.0>199.0)的离子流图见图11~图18。
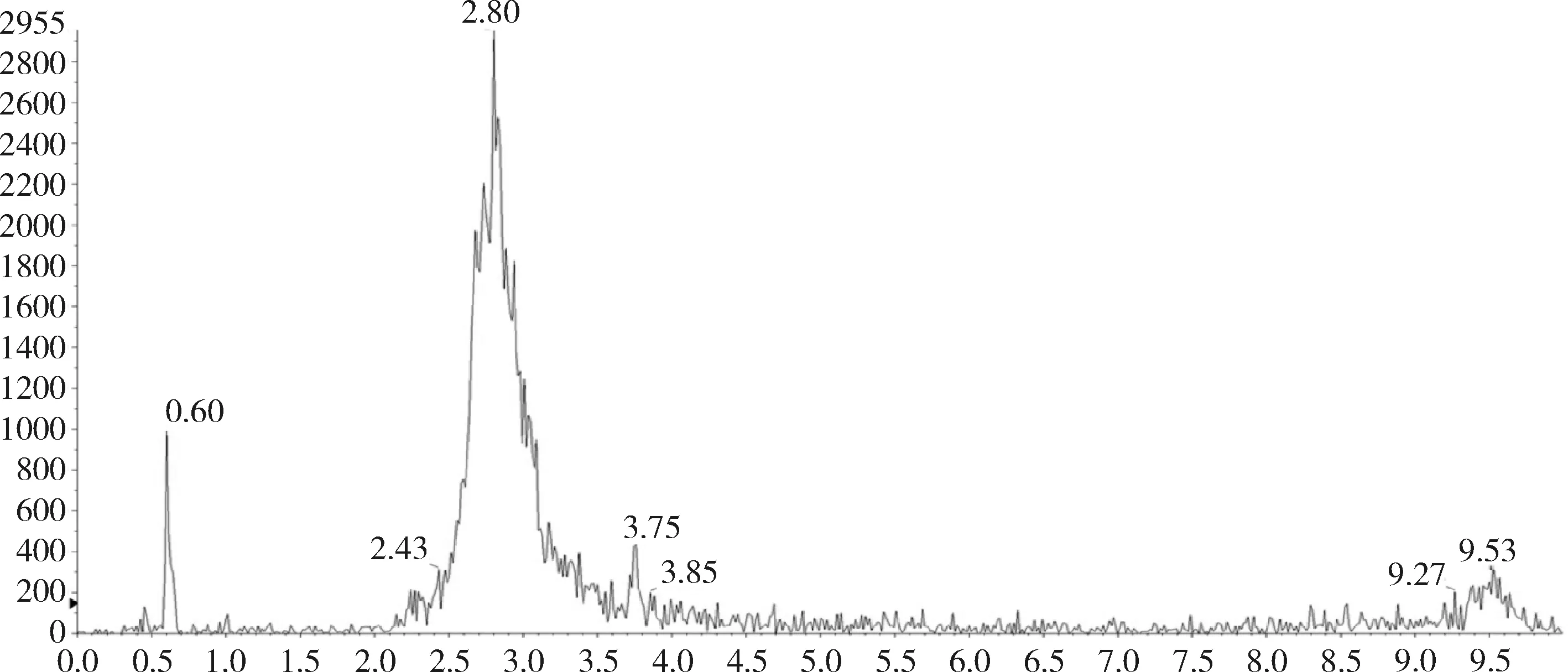
图3 空白肌肉中杆菌肽A总离子流图

图4 添加标准品的肌肉中杆菌肽A总离子流图(杆菌肽50 ng/g)

图5 空白脂肪中杆菌肽A总离子流图

图6 添加标准品的脂肪中杆菌肽A总离子流图(杆菌肽50 ng/g)

图7 空白肾脏中杆菌肽A总离子流图

图8 添加标准品的肾脏中杆菌肽A总离子流图(杆菌肽50 ng/g)

图9 空白肝脏中杆菌肽A总离子流图
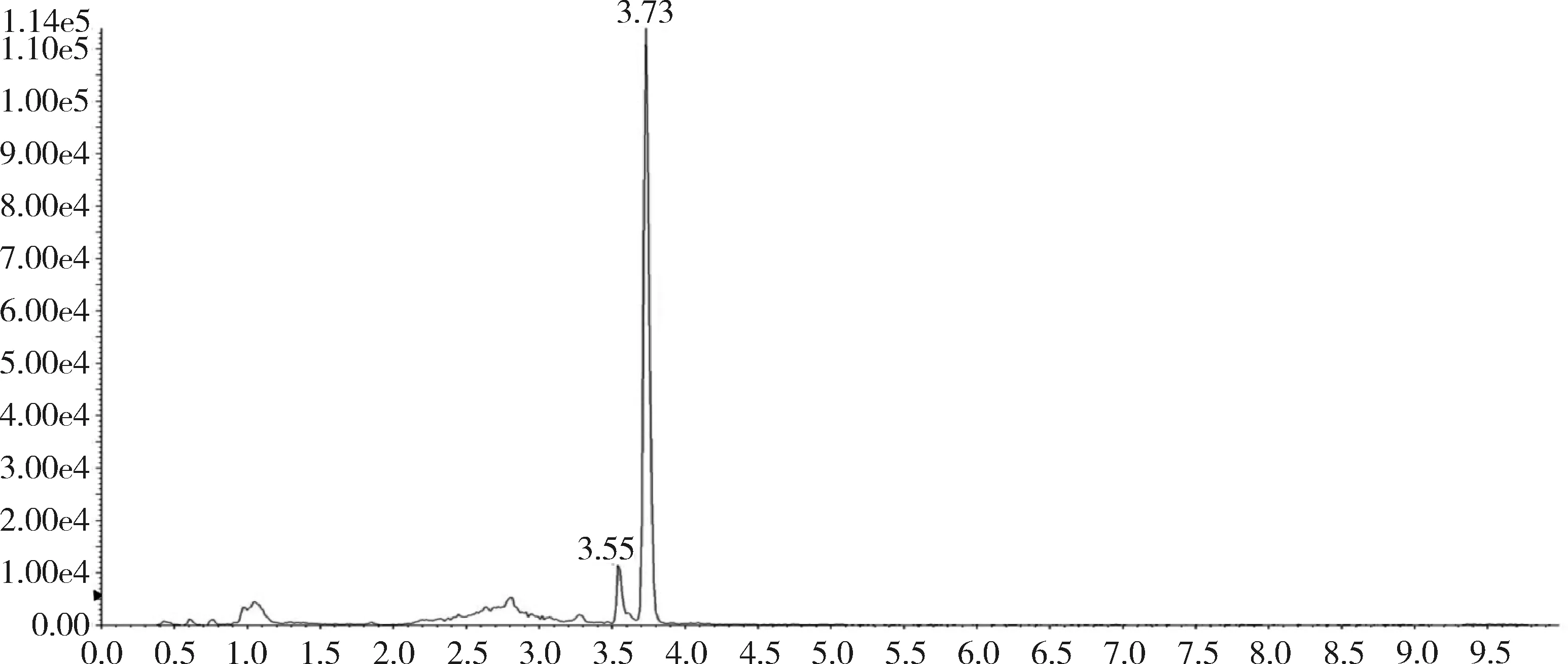
图10 添加标准品的肝脏中杆菌肽A总离子流图(杆菌肽50 ng/g)

图11 空白肌肉中杆菌肽B总离子流图

图12 添加标准品的肌肉中杆菌肽B总离子流图(杆菌肽50 ng/g)
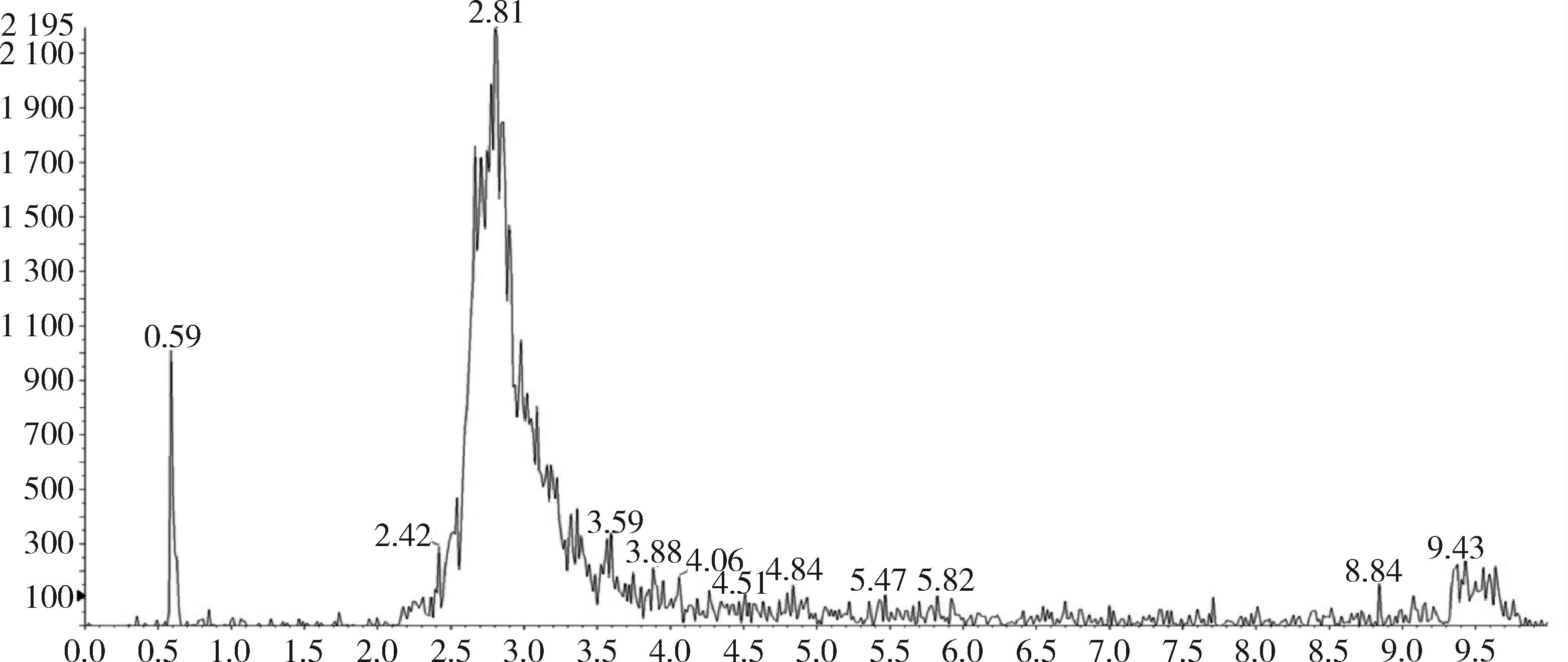
图13 空白脂肪中杆菌肽B总离子流图
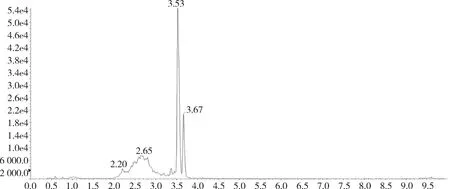
图14 添加标准品的脂肪中杆菌肽B总离子流图(杆菌肽50 ng/g)

图15 空白肾脏中杆菌肽B总离子流图
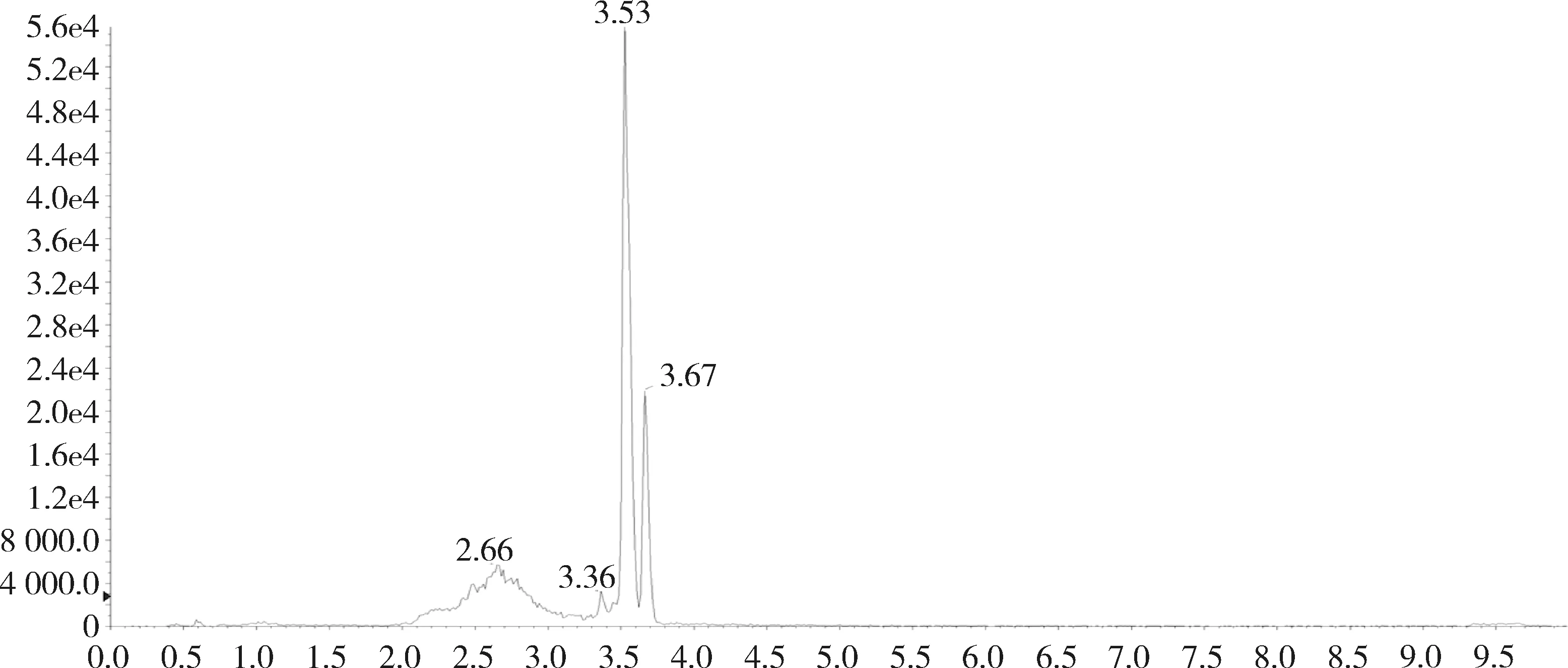
图16 添加标准品的肾脏中杆菌肽B总离子流图(杆菌肽50 ng/g)

图17 空白肝脏中杆菌肽B总离子流图
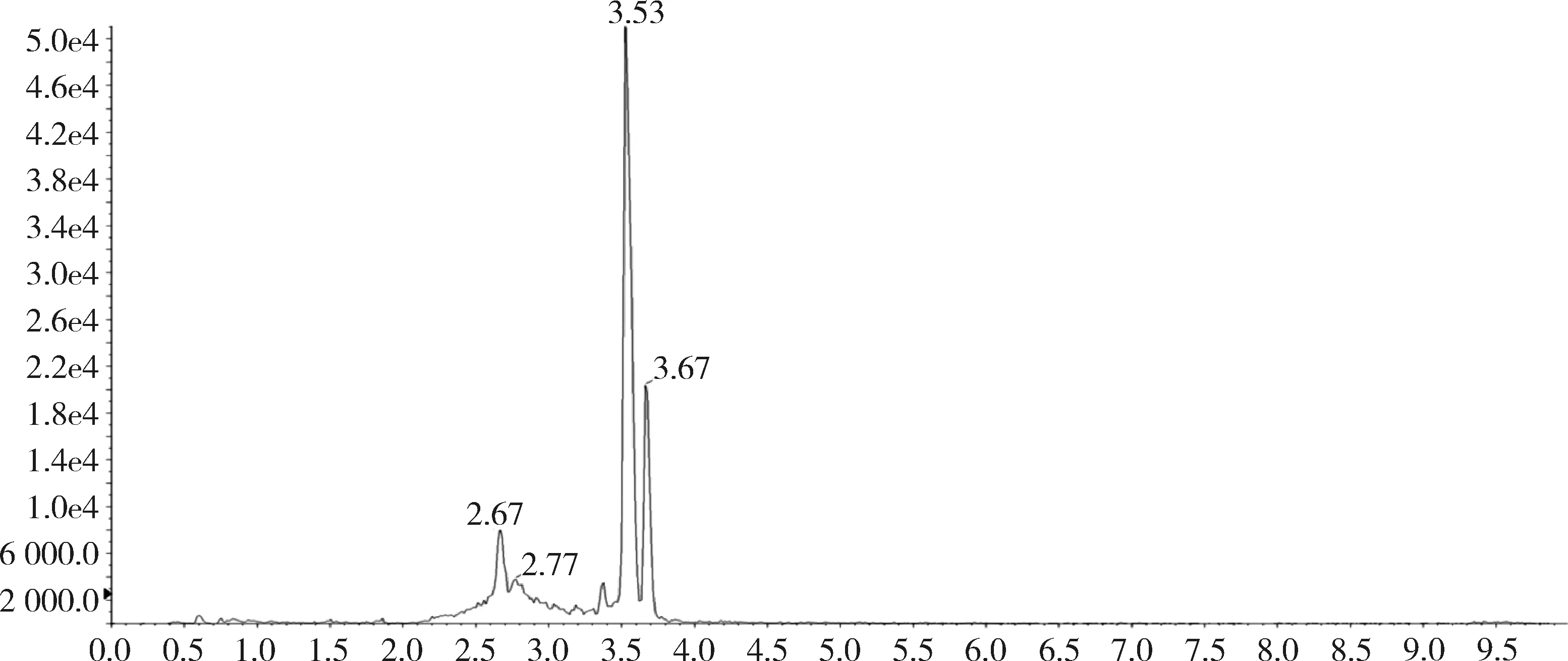
图18 添加标准品的肝脏中杆菌肽B总离子流图(杆菌肽50 ng/g)
2.2 线性结果 杆菌肽在50~1000 ng/g添加浓度范围内,药物浓度与峰面积呈良好的线性关系,线性回归方程相关系数(R2)≥0.99 (见表3)。

表3 杆菌肽在兔可食性组织线性方程
2.3 检测限(LOD)和定量限(LOQ) 取S/N≥3时浓度为最低检测限,该方法检测限为30 ng/g;根据精密度和准确度试验结果,取信噪比S/N≥10时浓度为最低定量限为50 ng/g。
2.4 准确度和精密度 样品中杆菌肽HPLC-MS/MS测定方法的结果表明,兔可食性组织中杆菌肽在50、150、300、800 ng/g四个添加水平下测定的平均回收率(以杆菌肽A与杆菌肽B之和计算)在74.7%~83.8%。见表4。
2.5 定性试验 通过考察来源于6只不同兔的组织的测定结果,兔可食性组织中内源性杂质不干扰样品中杆菌肽A、杆菌肽B含量的测定。基质添加标准品的杆菌肽A、杆菌肽B相对离子丰度符合2002/657/EC 规定的范围要求。

表4 杆菌肽加标回收率与相对标准偏差(n=6)
3 讨 论
3.1 前处理方法的优化 前处理条件优化中,通过比较0.5%甲酸甲醇水(1∶1)、0.5%甲酸甲醇乙腈(1∶1)、0.5%甲酸乙腈水(1∶1)、0.5%甲酸乙腈水(3∶7)、0.1%甲酸水等提取方法,并参照GB/T 20743-2006给出的方法净化后进样分析,结果显示,采用0.5%甲酸甲醇水(3∶7)和0.5%三氟乙酸水提取能够获得较好的回收率,但需除杂净化。优化后最终确定提取液为使用5 mL 0.5%三氟乙酸水提取2次。动物组织中含有大量的蛋白与脂肪,会严重影响HPLC-MS/MS系统的分析定量。目前对动物可食性组织或环境中杆菌肽提取液的净化大多采用OASIS®HLB 3cc 60 mg或200 mg固相萃取柱净化。试验中比较了OASIS®HLB 3cc 60 mg、150 mg、200 mg,OASIS®PRiME HLB 3cc 60 mg、150 mg和Agilent Bond Elut-ENV 200 mg 3 mL几种不同规格的固相萃取柱在6 mL水、3 mL甲醇:5%氨水溶液(V/V 20/80)加3 mL1%甲酸乙酸乙酯、3 mL甲醇:5%氨水溶液(V/V 10/90)加3 mL 1%甲酸乙酸乙酯等不同淋洗条件下的净化效果,结果表明,在使用甲醇:5%氨水溶液(V/V 20/80)和1%甲酸乙酸乙酯作为淋洗液时,OASIS®PRiME HLB小柱表现得更好,能够有效减少杂质且不会损耗过多杆菌肽。筛选洗脱液时,甲醇和乙腈差异不显著。最终确定使用乙腈沉淀蛋白,正己烷除脂,OASIS®PRiME HLB 150 mg固相萃取柱净化,淋洗条件为3 mL甲醇:5%氨水溶液(V/V 20/80)加3 mL 1%甲酸乙酸乙酯,洗脱液为2 mL甲醇乙腈(V/V 20/80),可获得较好的回收率,且杂质不影响定量。
3.2 色谱条件的优化 在使用针泵进样对杆菌肽标准品进行离子扫描时,杆菌肽离子化会出现不同的状态,因此,在不同的实验中会依照实验条件选择不同的电荷状态。本试验条件下,选择杆菌肽双电荷状态即杆菌肽A的母离子质荷比为712、杆菌肽的B母离子质荷比为705时,具有更加稳定的响应值和更低的基线。因此本试验在离子扫描时选择双电荷状态作为杆菌肽特征离子。
大多数文献报道中,液相条件都是使用甲酸水乙腈体系,偶有其他类型的流动相体系。在尝试选择对人危害较小且更加经济的甲酸水甲醇体系时发现,杆菌肽在8 min的流动相体系中,虽然出峰时间约为2.8 min且具有较好的峰形和峰高,但与兔组织中的杂质峰严重重叠,干扰定量。进一步优化后,最终选择依旧甲酸水乙腈体系,在该体系条件下可获得较好的峰形,且不与杂质相互干扰,利于定量分析。
4 结 论
本试验建立了兔可食性组织中杆菌肽的提取、净化及含量的HPLC-MS/MS检测法。兔可食性组织中杆菌肽残留使用0.5%三氟乙酸水提取,10%三氯乙酸乙腈沉淀蛋白,正己烷除脂,固相萃取柱净化,以0.1%甲酸水和乙腈为流动相进行梯度洗脱。质谱采用电喷雾离子源(ESI),正离子模式,多反应检测(MRM)模式。结果表明,杆菌肽在50~1000 ng/g添加浓度范围内,浓度与响应值之间线性关系良好,相关系数大于0.99,方法的检测限为30 ng/g,定量限为50 ng/g。杆菌肽平均添加回收率在74.7%~ 83.8 %,批内批间变异系数均小于10%。依据EMEA规定的兔可食性组织中杆菌肽MRL标准,试验制定的兔可食性组织中杆菌肽残留标志物的HPLC-MS/MS测定方法,适用于兔可食性组织中杆菌肽残留量。

