紫杉醇脂质体与表柔比星联合治疗晚期乳腺癌的效果研究
徐肖
北京市昌平区医院肿瘤科,北京 102200
乳腺癌是危害女性健康与生命安全的严重疾病,其中的晚期患者主要采用化疗药物治疗。然而,不同化疗方案治疗晚期乳腺癌患者的效果与安全性却存在一定的差异[1]。目前,紫杉类、蒽环类等药物是指南推荐治疗晚期乳腺癌的一线药物[2]。紫杉醇制剂是在无水乙醇与聚氧乙烯蓖麻油混合溶媒中溶入紫杉醇,但进入机体后易形成变态反应,所以用药前应预先使用抗变态药物。紫杉醇脂质体采用磷脂包裹紫杉醇,以便预防溶媒所致的变态反应。表柔比星属于蒽醌类化合物,不仅可以在肿瘤组织保持高浓度状态,且具有显著的抗肿瘤活性。2016年12月—2019年11月该院对30例晚期乳腺癌患者应用了表柔比星与紫杉醇脂质体联合治疗,取得了满意的效果,现报道如下。
1 资料与方法
1.1 一般资料
方便选择该院收治的60例晚期乳腺癌患者作为研究对象,以随机数字表法将其随机分为两组,其中对照组与研究组,各30例。纳入标准:经病理检查证实;美国癌症联合会(AJCC)与国际抗癌联盟(UICC)原发肿瘤局部淋巴结远处转移(TNM)分期为Ⅲ期与Ⅳ期;卡氏评分(KPS)评分>80分;预计生存期>3个月;该次研究内容已告知患者知情,并签署了知情同意书。排除标准:c-erbB-2阳性乳腺癌;放化疗史;化疗禁忌症;严重脏器功能障碍;免疫系统疾病;哺乳期或妊娠期女性。对照组:均为女性;年龄38~70岁,平均年龄(49.6±5.3)岁;TNM分期为Ⅲ期22例,Ⅳ期8例;肿瘤直径为3.2~5.2 cm,平均为(4.3±0.5)cm;病理类型为浸润性小叶癌2例,浸润性导管癌27例,其他类型1例。研究组:均为女性;年龄39~68岁,平均年龄(49.5±5.4)岁;TNM分期为Ⅲ期21例,Ⅳ期9例;肿瘤直径为3.2~5.0 cm,平均为(4.2±0.6)cm;病理类型为浸润性小叶癌3例,浸润性导管癌26例,其他类型1例。两组在上述一般情况构成对比中,差异无统计学意义(P>0.05)。该次研究经医院伦理委员会批准。
1.2 方法
两组均采取化疗治疗,化疗前应用抗过敏、止吐等预防措施。对照组:表柔比星(国药准字H20093251,规格:10 mg)90 mg/m2+5%葡萄糖注射液100 mL,静脉滴注,d1;环磷酰胺(国药准字H14021788)600 mg/m2+氯化钠100 mL,静脉滴注,d1,每隔3周使用1次。研究组:表柔比星75 mg/m2+5%葡萄糖注射液100 mL,静脉滴注;紫杉醇脂质体135 mg/m2+氯化钠注射液500 mL,静脉滴注,d1,每隔3周使用1次,持续治疗4个疗程。
1.3 观察指标
根据实体瘤疗效标准(RECIST)1.1[3]评价两组患者的近期疗效。全部目标病灶消失为完全缓解;基线病灶长径之和缩小≥30%为部分缓解;基线病灶长径之和缩小,但未及部分缓解,或增加但及进展为稳定;基线病灶长径之和增加≥20%或检查出现新病灶为进展。总有效率=(完全缓解例数+部分缓解例数+稳定例数)/总例数×100.00%。②根据世界卫生组织(WHO)相关标准[4]评价两组化疗不良反应情况,观察指标包括:血液系统毒性、外周神经系统毒性、消化系统毒性、其他毒性。③对比两组治疗前后血清肿瘤标志物的变化,包括:糖类抗原199(CA199)、糖类抗原125(CA125)与癌胚抗原(CEA),上述指标均采用放射免疫分析法检测,具体操作严格按照说明书执行。
1.4 统计方法
2 结果
2.1 两组患者近期疗效对比
研究组患者治疗的总有效率为80.00%,高于对照组53.33%,差异有统计学意义(P<0.05)。见表1。

表1 两组患者近期疗效对比
2.2 两组患者化疗不良反应对比
两组患者血液系统毒性、外周神经系统毒性、消化系统毒性、其他毒性的发生率对比差异无统计学意义(P>0.05)。见表2。

表2 两组患者化疗不良反应对比[n(%)]
2.3 两组患者治疗前后血清肿瘤标志物的变化
治疗前,两组患者CA199、CA125与CEA水平对比差异无统计学意义(P>0.05);治疗后,研究组CA199、CA125与CEA水平均低于对照组,差异有统计学意义(P<0.01)。见表3。
表3 两组患者治疗前后血清肿瘤标志物的变化对比(±s)
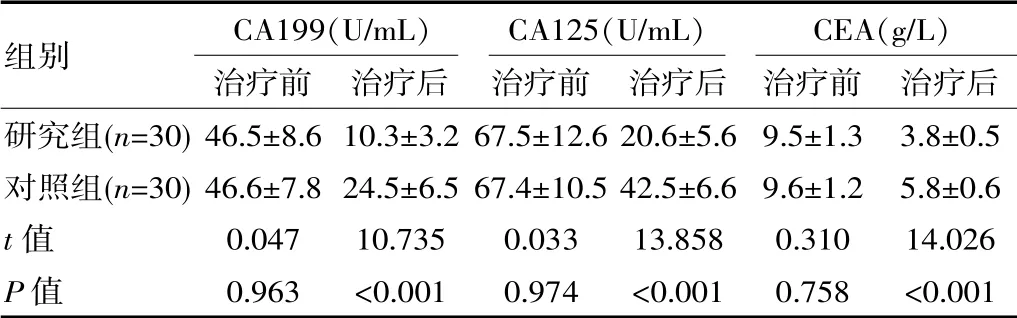
表3 两组患者治疗前后血清肿瘤标志物的变化对比(±s)
研究组(n=30)对照组(n=30)t值P值组别46.5±8.6 46.6±7.8 0.047 0.963 10.3±3.2 24.5±6.5 10.735<0.001 67.5±12.6 67.4±10.5 0.033 0.974 20.6±5.6 42.5±6.6 13.858<0.001 9.5±1.3 9.6±1.2 0.310 0.758 3.8±0.5 5.8±0.6 14.026<0.001 CA199(U/mL)治疗前 治疗后CA125(U/mL)治疗前 治疗后CEA(g/L)治疗前 治疗后
3 讨论
近年来,随着女性生活方式的变化与工作压力的增加,乳腺癌的发病率也随之攀升,且不断向年轻化群体扩增,现已成为重大的社会公共卫生问题[5]。由于乳腺癌细胞失去了正常细胞特征,细胞间连接松散,极易脱落,脱落后的细胞随着淋巴液或血液播散全身,所以晚期乳腺癌病例十分常见。目前,针对晚期乳腺癌患者主要采用化疗方案治疗,以期减少或杀灭癌细胞,抑制病情进展,延长患者的生存时间。然而,不同化疗方案在晚期乳腺癌患者中的应用效果却参差不齐[6]。因此,探寻一种可靠且安全的化疗方案,保障晚期乳腺癌患者的治疗效果,延长其生存期已成为临床学者亟需解决的问题。
紫杉醇脂质体属于新型紫杉醇制剂,该药不包含聚氧乙烯蓖麻油,并可以包裹紫杉醇,增强药物的稳定性与组织相溶性,且以静脉滴注方式给药,在短时间内便可发挥出较强的药效。同时,紫杉醇脂质体是一种细胞毒类抗肿瘤药物,可以促进微管双聚体装配,避免其解聚,诱导整个细胞周期微管排列异常与细胞分裂期微管星状体形成,继而减少细胞分裂,抑制肿瘤生长[7]。表柔比星属于蒽醌类化合物,可以直接嵌入肿瘤细胞DNA链,抑制脱氧核糖核酸形成途径与转录过程,继而影响肿瘤细胞的生长与增殖,最终促使肿瘤细胞凋亡。相关学者[8]将62例三阴乳腺癌患者分为试验组与对照组,试验组应用紫杉醇脂质体联合表柔比星化疗,对照组采用环磷酰胺联合表柔比星化疗,结果显示试验组近期总有效率87.10%高于对照组64.52%。该文研究结果显示,研究组治疗的总有效率为80.00%,高于对照组53.33%(P<0.05)。结果说明,表柔比星和紫杉醇脂质体联合应用近期疗效显著,为延长患者的生存期奠定了良好的基础。
肿瘤标志物是诊断与评价乳腺癌患者病情的可靠指标。其中CA199属于低聚糖肿瘤相关抗原,是一种主要存在于血液循环中的相关抗原;CA125属于糖类抗原,与乳腺癌密切相关,可用于评价病情进展[9];CEA属于人类胚胎抗原特征的酸性糖蛋白,主要存在于内胚层细胞分化而成的癌细胞表面,是一种细胞膜结构蛋白。郁肖夫等[10]对49例乳腺癌患者应用了表柔比星联合紫杉醇化疗,结果显示该组治疗后CEA(3.81±0.62)g/L、CA125(21.28±5.65)U/mL、CA199(10.35±3.21)U/mL,均低于治疗前(9.73±1.34)g/L、CA125(67.49±14.25)U/mL、CA199(46.53±8.98)U/mL。基于上述肿瘤标志物与乳腺癌具有密切的相关性,该研究对患者治疗前后CA125、CA199与CEA的变化进行了观察与对比,结果显示,治疗后研究组CA199(10.3±3.2)U/mL、CA125(20.6±5.6)U/mL、CEA(3.8±0.5)g/L水平均低于对照组(24.5±6.5)U/mL、(42.5±6.6)U/mL、(5.8±0.6)g/L(P<0.01)。可见,紫杉醇脂质体与表柔比星能够有效调节患者的肿瘤标志物水平,确保整体治疗效果。从安全性来看,研究组血液系统毒性、外周神经系统毒性、消化系统毒性、其他毒性的发生率6.67%、10.00%、26.67%、6.67%与对照组10.00%、10.00%、23.33%、10.00%对比差异无统计学意义(P>0.05)。结果说明,表柔比星和紫杉醇脂质体联合应用并未增加药物不良反应,安全性较佳。
综上所述,紫杉醇脂质体与表柔比星联合治疗晚期乳腺癌效果确切,适于临床推广。需要注意的是,由于该次研究样本数量偏少,加之随访时间有限,对于两种药物联合应用的远期疗效及对患者生存周期的影响,仍需要大样本、长时间的随访研究。

