口服肝靶向制剂介导受体ASBT和ASGPR在肝泡型包虫病大鼠模型体内的表达分析
高瑞雪, 胡春晖, 张发斌, 高 攀, 甘雪辉, 张耀刚, 姜博璠
1 青海大学医学院, 西宁 810001; 2 青海省包虫病研究重点实验室, 西宁 810001
肝泡型包虫病(hepatic alveolar echinococcosis, HAE)是由多房棘球蚴寄生人体、感染肝脏所致的慢性寄生虫病,在我国畜牧业发达地区流行[1-4]。治疗手段以手术切除为主,但HAE的边缘带界限不清,术中难以完全切除,患者的复发率高达7.7%~30%[5-6]。且对于多器官转移、晚期等无法进行手术的患者,药物治疗尤为重要。目前现有的治疗包虫病的药物如苯并咪唑类(Benzimidazoles)药物[7-8]主要以口服给药为主,但给药后毒副作用较大,肝局部药物浓度过低[9],疗效欠佳。因此,基于HAE的生物学基础,研究新型肝靶向制剂是目前治疗包虫病的关键。现有的肝靶向制剂的研究主要是基于粒径效应的注射用被动肝靶向,但注射给药患者依从性低,因此考虑口服肝靶向制剂。
研究[10-12]表明,顶端钠依赖性胆盐转运体(apical sodium-dependent bile acid transporter, ASBT) 是存在于回肠末端上皮细胞的一种膜转运蛋白,作为药物吸收的潜在靶点受到了广泛关注。去唾液酸糖蛋白受体(asialoglycoprotein receptor,ASGPR)是肝细胞特异性表达的一种内吞型受体,利用该受体介导的内吞机制可以实现药物或基因的肝靶向递送[13]。ASBT、ASGPR被证实为有效的口服肝靶向制剂介导受体,将其应用于HAE口服肝靶向新剂型,需验证二者在HAE的表达情况。因此本研究分别对HAE大鼠模型回肠组织中ASBT及肝组织中ASGPR的表达情况进行检测分析,为后期研发靶向新剂型提供基础依据。
1 材料与方法
1.1 实验动物 雄性6~8周龄SPF级SD大鼠,体质量(200±20) g,购于江苏省南京市江宁区青龙山动物繁殖场,实验动物生产许可证号:3202781029,实验动物使用许可证号:SYXK(青)2016-0001。饲养于青海省包虫病研究重点实验室,室温(23±2) ℃,相对湿度55%左右,自由进食、饮水。
1.2 主要试剂 ASBT兔多克隆抗体ab203205、ASGPR兔多克隆抗体ab42488购于Abcam公司;HRP标记山羊抗兔抗体G23303、CY3山羊抗兔抗体GB21303购于Servicebio公司;β-actin兔多克隆抗体AC026购于ABclonal公司;Total RNA提取试剂盒、去基因组DNA反转录试剂盒、Takara嵌合法实时荧光定量PCR试剂盒购于TaKaRa公司;大鼠β-actin内参引物购于上海生工生物工程公司。
1.3 HAE大鼠模型的建立[14]10只SD大鼠制备HAE模型。制备方法如下:解剖感染多房棘球绦虫的沙鼠脏器(由青海省包虫病研究重点实验室提供),分离包囊、洗涤、剪碎,通过台盼蓝染色法检测原头节活性、镜下计数活性原头节数量,制成含活性原头节2000枚/μl的混悬液,备用。10%水合氯醛按0.3 ml/100 g腹腔注射麻醉SD大鼠,剑突右下处暴露肝脏,将制备好的原头节混悬液用无菌注射器吸取0.2 ml注射入肝脏,缝合(图1)。造模4个月后用mindray公司的Resona7彩色多普勒超声系统检查,确认造模是否成功。根据超声病灶横切面的长、宽,纵切面的宽,确定病灶体积(长×宽×宽),造模成功的SD大鼠为HAE组,完成后续实验。
1.4 动物分组与组织取样 8只SD大鼠为正常对照组,8只经超声检查造模成功的SD大鼠为HAE组(造模10只,成功8只)。分别取正常大鼠回肠组织、肝组织,HAE大鼠回肠组织、其他非患病肝组织、HAE大鼠肝组织病灶边缘带(图1),备用。

图1 HAE模型大鼠的建立与肝组织取样
1.5 免疫荧光检测 取上述组织样本用4%多聚甲醛固定,石蜡包埋、切片,并将切片浸入EDTA抗原修复缓冲液,采用微波热修复抗原。加入自发荧光淬灭剂5 min,流水冲洗10 min,滴加BSA室温封闭30 min。滴加0.1 mmol/L PBS稀释好的一抗(ASBT 1∶100;ASGPR 1∶50),4 ℃过夜孵育。滴加CY3二抗室温避光孵育50 min,DAPI复染细胞核室温避光孵育10 min,用抗荧光淬灭封片剂封片,荧光显微镜观察并采集图像(DAPI紫外激发波长330~380 nm,发射波长420 nm,发蓝光;CY3激发波长510~560 nm,发射波长590 nm,发红光)。
1.6 Western Blot检测蛋白表达水平 组织样本匀浆后,加RIPA裂解液提蛋白,BCA法进行蛋白浓度测定,以每孔蛋白上样量15 μg配制上样体系,煮沸变性5 min,12%SDS-PAGE恒流60 mA电泳,恒流180 mA转膜90 min,10%脱脂牛奶封闭1 h,将PVDF膜置于稀释的ASBT(1∶1000)、ASGPR(1∶1000)、β-actin(1∶100 000)一抗中,4 ℃孵育过夜。次日,PVDF膜TBST漂洗3次(每次5 min)后,以HRP标记山羊抗兔抗体(1∶10 000)为二抗室温孵育1 h,TBST漂洗3次(每次10 min), 将ECL显影液均匀的覆盖住PVDF膜表面,显影,拍照。采用Image J进行显影结果的灰度值分析。
1.7 实时荧光定量PCR检测基因表达水平 组织样本用Total RNA提取试剂盒提取总RNA。按去基因组DNA反转录试剂盒说明书操作,完成总RNA反转,得到cDNA。引物由上海生工生物工程公司合成(表1),内参基因选用β-actin。用Takara嵌合法实时荧光定量PCR试剂盒配制PCR反应液,LightCycler480 System进行qPCR反应,得到目的基因与内参基因Ct值,以2-ΔΔCt为统计量,计算得出目的基因的相对含量。
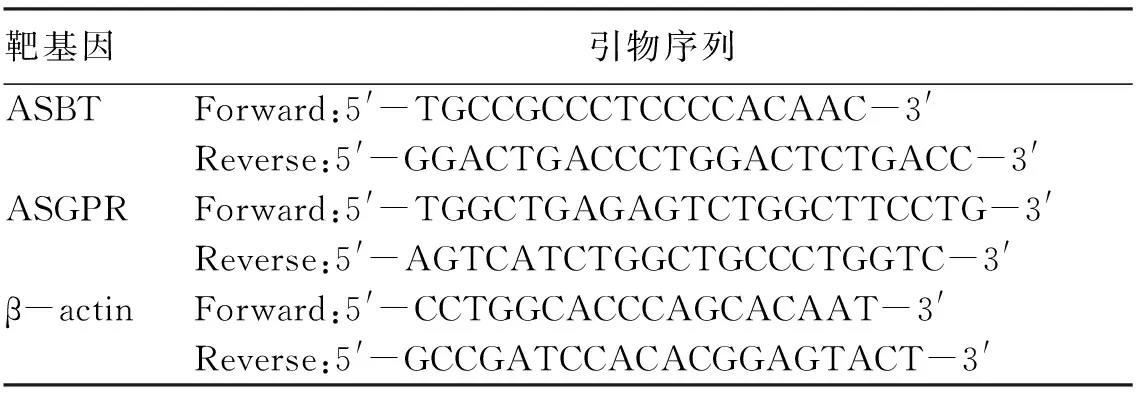
表1 实时荧光定量PCR引物
1.8 伦理学审查 本研究方案经由青海大学医学院医学科学研究伦理委员会审批,动物实验符合实验室动物管理与使用准则。

2 结果
2.1 HAE大鼠模型造模情况超声检查 对模型大鼠肝脏超声检查,并通过对病灶横、纵两个切面的检测确定肿块大小。超声检查结果显示,肝内不均质肿块,肿块体积范围为0.3~3.3 cm3,内部结构复紊乱,边缘不规则,周边实性部分与肝实质分界不清,部分伴有点状强回声钙化沉积(图2)。
2.2 ASBT在HAE大鼠模型回肠组织中的表达与分布
免疫荧光镜检ASBT在回肠组织的分布情况显示,ASBT在游离面和基底面细胞膜存在高表达。在HAE大鼠中,ASBT在其回肠组织中荧光强度高,且较正常组呈上调趋势(P<0.05)(图3,表2);Western Blot结果分析蛋白表达水平,ASBT在HAE组表达量较正常组显著,条带趋势递增,呈现高表达,与免疫荧光结果趋势一致。通过分析灰度值,HAE组表达量较正常组高(P<0.05)(图4,表2);分析实时荧光定量PCR mRNA相对表达量,结果显示ASBT在HAE组较正常组表达上调(P<0.05)(表2)。

注:虚线标注为病灶肿块;a,超声检查横切面;b,超声检查纵切面;c,HAE大鼠模型肝脏感染模型图。图2 典型HAE模型大鼠超声检查及感染模型图
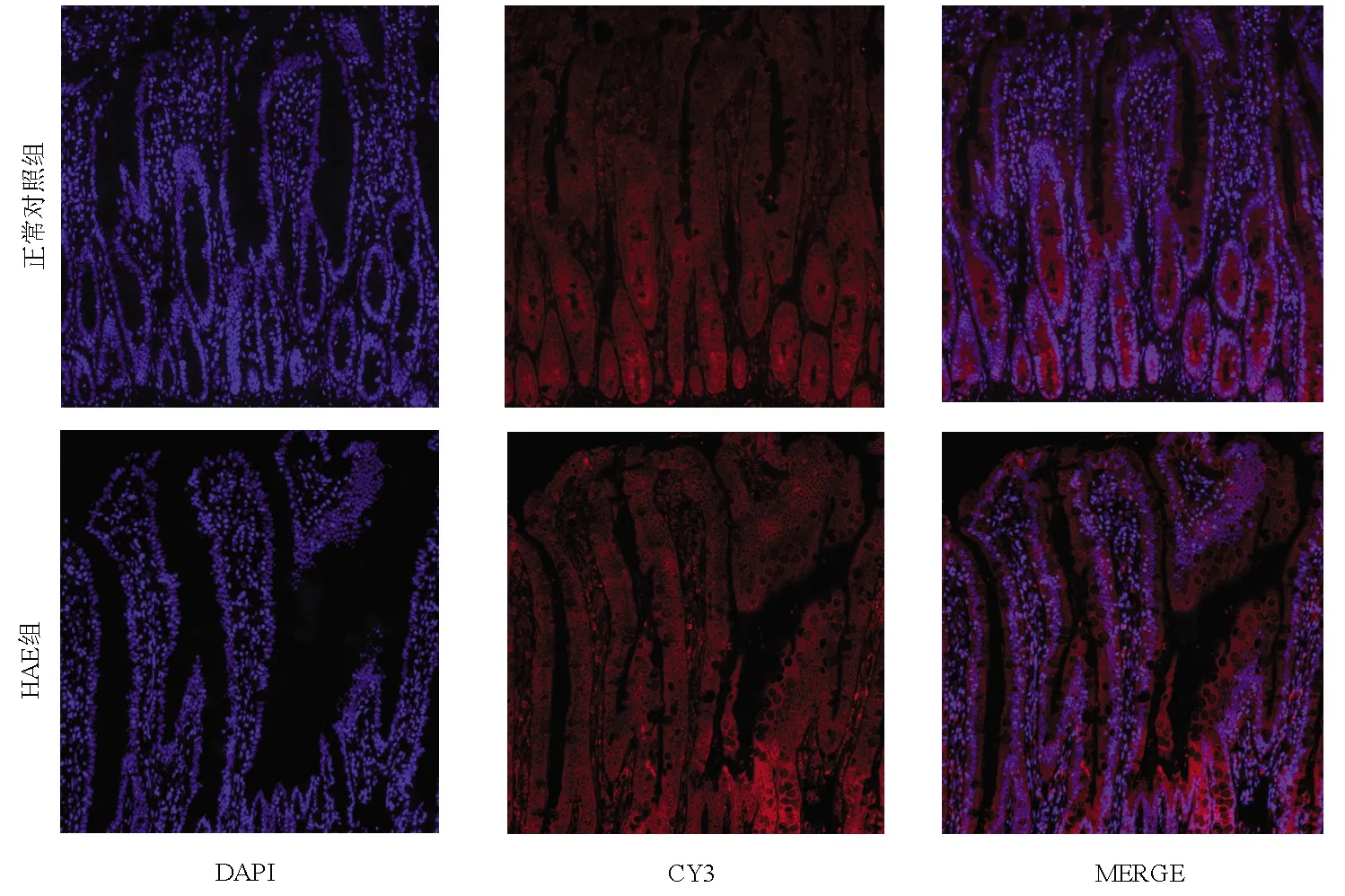
注:DAPI,蓝色荧光(细胞核);CY3,红色荧光(ASGPR阳性表达);MERGE,叠加。图3 ASBT在正常大鼠及HAE大鼠回肠组织的表达分布(免疫荧光染色,×200)

图4 ASBT在正常大鼠及HAE大鼠回肠组织蛋白的表达水平
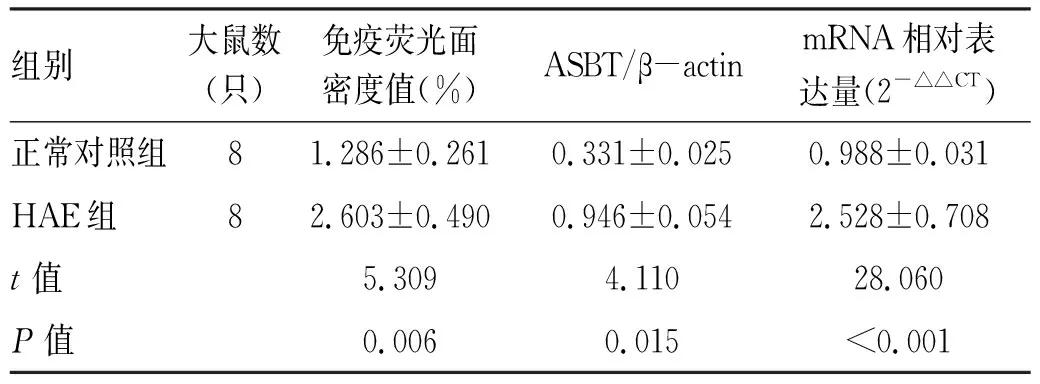
表2 ASBT在正常大鼠及HAE大鼠的表达比较
2.3 ASGPR在HAE大鼠模型肝组织中的表达与分布 免疫荧光镜检结果显示,ASGPR在肝组织高表达,HAE组较正常组表达高,且接近病灶的部位荧光强度最强(P<0.05)(图5,表3);Western Blot结果显示,其在HAE组表达量较正常组显著,条带趋势递增,靠近病灶的边缘带表达量较非患病肝组织表达量高(P<0.05)(图6,表3);实时荧光定量PCR mRNA相对表达量分析显示,HAE组较正常组表达上调,趋势与免疫荧光、Western Blot一致(P<0.05)(表3)。

图6 ASGPR在正常大鼠及HAE大鼠肝组织蛋白的表达水平

表3 ASGPR在正常大鼠及HAE大鼠的表达比较
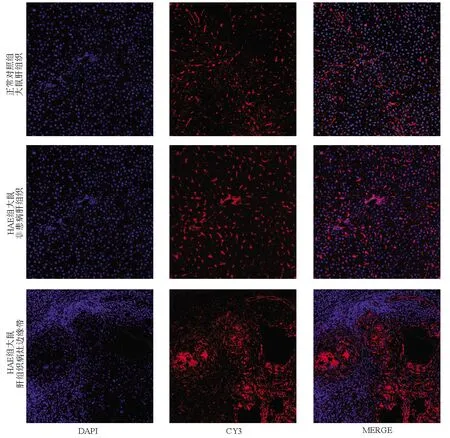
注:DAPI,蓝色荧光(细胞核);CY3,红色荧光(ASGPR阳性表达);MERGE,叠加。图5 ASGPR在正常大鼠及HAE大鼠肝组织的表达分布(免疫荧光染色,×200)
3 讨论
根据世界卫生组织治疗意见,目前HAE的治疗方式以手术切除病灶为主,并长期给予苯并咪唑类药物[15]。由于HAE的治疗时间较长(1~2年),患者大多来自农牧区,顺应性较好的口服制剂给药为首选给药方式。然而,目前史可肠虫清(阿苯达唑片)为口服普通制剂,口服给药后局部病灶部位药物浓度过低是其达不到理想药效学的主要原因[16-20]。因此,为了克服上述缺点,制备患者顺应性强、疗效显著的口服肝靶向制剂成为本课题组研究的重点。
研究显示,肠转运蛋白在提高某些大分子药物,如胰岛素[11]或微粒给药系统[21-22]的药物吸收速率和程度上起到了重要作用。ASBT是在回肠末端上皮细胞的顶端刷状缘膜中高度表达的一种膜转运蛋白,属于转运蛋白的溶质载体家族,可与胆酸结合,是表达于小肠的重要载体蛋白。范未伟[11]利用ASBT设计胰岛素新型口服纳米载体可高效递送胰岛素,与皮下注射重组胰岛素相比,胰岛素的细胞摄取量较高[21]。Lozano等[22]研究证实可通过ASBT增强抗肿瘤药物向胆管癌的递送。由此可见,ASBT可作为转运受体,用于提高口服药物的生物利用度。
ASGPR大量存在于肝细胞上且在肝外少表达,且它与包含半乳糖和N-乙酰基-半乳糖胺残基的多个分子具有先天结合亲和力[23-24],因此ASGPR可能成为肝靶向给药的物质基础。Wang等[25]利用ASGPR与半乳糖分子的高亲和性,制成负载有姜黄素的球形纳米载体,明显增强了姜黄素的肝脏分布。Wu等[26]基于ASGPR-半乳糖的受体-配体相互作用构建了糖聚合物,从而实现针对肝细胞癌治疗药物的特异性转运和释放。
基于ASBT为理想的前药转运体、ASGPR为肝靶向给药系统的理想受体,本课题组拟通过ASBT介导转运口服药物吸收入血,药物经血液送达肝脏,再由肝脏高表达的ASGPR内吞,使药物在肝脏内部充分释放,进而有效改善当前治疗药物存在的弊端,为HAE的药物治疗提供新的可能。本研究显示,ASBT、ASGPR在HAE组呈现高表达,且越接近病灶的组织,其肝细胞ASGPR表达量越高。换言之,若以ASGPR为受体的新剂型研发成功,当其进入HAE患者体内,越接近病灶的组织与新剂型的结合度越高,进而有效解决了当前药物肝脏局部血药浓度较低的问题。因此,将ASBT作为治疗HAE药物的前药转运体,ASGPR作为治疗药物的肝靶向给药系统的受体,二者结合,可能有效解决当前治疗药物血药浓度低及肝脏局部血药浓度低等问题。本研究为后续研发治疗HAE的口服靶向新剂型提供了强有力的理论基础。
利益冲突声明:本研究不存在研究者、伦理委员会成员、受试者监护人以及与公开研究成果有关的利益冲突。
作者贡献声明:高瑞雪、胡春晖、张发斌负责课题设计,撰写论文,修改论文;高瑞雪、高攀、甘雪辉、张耀刚、姜博璠参与收集数据及数据分析;高瑞雪、胡春晖、张发斌负责拟定写作思路,指导撰写文章并最后定稿。

