外源5氨基乙酰丙酸(ALA)对低温胁迫下枇杷叶片AsAGSH循环的影响
曹碧珍

摘 要:采用不同質量浓度(100、150、175 mg·L-1)的5氨基乙酰丙酸(ALA)处理低温胁迫下3年生的早钟6号枇杷容器苗,以喷施清水为对照(CK),在-3℃下低温胁迫处理3 h,比较分析不同处理对枇杷叶片过氧化氢(H2O2)、抗坏血酸(AsA)和还原型谷胱甘肽(GSH)含量及脱氢抗坏血酸还原酶(DHAR)、谷胱甘肽还原酶(GR)、单脱氢抗坏血酸还原酶(MDHAR)和抗坏血酸过氧化物酶(APX)活性的影响。结果表明:与CK相比,外源ALA处理的枇杷叶片显著促进了叶片中抗坏血酸(AsA)和还原型谷胱甘肽(GSH)含量的增加及脱氢抗坏血酸还原酶(DHAR)、单脱氢抗坏血酸还原酶(MDHAR)、谷胱甘肽还原酶(GR)和抗坏血酸过氧化物酶(APX)活性的上升,降低过氧化氢(H2O2)含量。说明外源ALA处理促进了低温胁迫下枇杷叶片AsA-GSH的有效循环,增强细胞的抗氧化性,提高枇杷幼苗的耐寒性。说明适当外源5氨基乙酰丙酸(ALA)处理能够调控枇杷叶片中AsAGSH循环,进而提高枇杷叶片的抗寒性,减轻枇杷在低温胁迫下的损伤,其中以175 mg·L-1ALA处理效果最显著。
关键词:5氨基乙酰丙酸;枇杷;低温胁迫;AsAGSH循环
中图分类号:S 667.3 文献标志码:A 文章编号:0253-2301(2021)11-0007-07
DOI: 10.13651/j.cnki.fjnykj.2021.11.002
Effects of Exogenous 5aminolevulinic Acid (ALA) on the AsA-GSHCirculation in Loquat Leaves Under the Stress of Low Temperature
CAO Bi-zhen
(Putian Xialin Sub-District Office of People′s Government of Chengxiang District, Putian, Fujian 351100, China)
Abstract: Different concentrations of 5aminolevulinic acid (ALA) (100, 150, 175 mg·L-1) were used to treat the three-year-old Zaozhong No.6 loquat container seedlings under the stress of low temperature. With spraying water as the control (CK), the effects of different treatments on the contents of hydrogen peroxide (H2O2), ascorbic acid (AsA) and reductive glutathione (GSH) and the activities of dehydroascorbate reductase (DHAR), glutathione reductase (GR), monodehydroascorbate reductase (MDHAR) and ascorbate peroxidase (APX) in the leaves of loquat were compared and analyzed when applying the low temperature stress at -3℃ for 3 h. The results showed that: compared with CK, the exogenous treatment with ALA on the leaves of loquat significantly promoted the increase of the contents of ascorbic acid (AsA) and reductive glutathione (GSH), and the activities of dehydroascorbate reductase (DHAR), monodehydroascorbate reductase (MDHAR), glutathione reductase (GR) and ascorbate peroxidase (APX) in loquat leaves, but reduced the content of hydrogen peroxide (H2O2). This indicated that the exogenous treatment with ALA promoted the effective circulation of AsA-GSH in loquat leaves under the stress of low temperature, enhanced the antioxidant activities of cells, and improved the cold tolerance of loquat seedlings. Therefore, the appropriate exogenous treatment with 5aminolevulinic acid (ALA) could regulate the AsA-GSH circulation in loquat leaves, thus improving the cold resistance of loquat leaves and reducing the damage of loquat under the stress of low temperature, among which the treatment with 175 mg·L-1 ALA had the most significant effect.
Key words: 5aminolevulinic acid; Loquat; Low temperature stress; AsA-GSH circulation
枇杷Eriobotrya japonica Lindl.是一种典型的亚热带常绿果树,好湿润、温和的气候条件。枇杷品种根据生态类型可分为耐寒性较强的温带型品种和耐寒性较弱的热带型品种,而低温胁迫则是热带型枇杷品种生长的关键性因子。近些年来,我国南方山地枇杷产区都有出现不同程度的冻害,福建主要以早钟6号枇杷(Eriobotrya japonica Lindl.cv.Zaozhong No.6)受冷害最为严重[1]。探讨枇杷抗冻性的调控机制对于减少因冷害造成的损失具有重要意义。5氨基乙酰丙酸(5aminolevulinic acid,简称ALA)是叶绿素等色素构成的重要前体,也是一种存在于植物机体中的非蛋白氨基酸[2]。在低浓度条件下,ALA作为一种新的调节植物生长的激素类物质,既可以提高植物的抗逆性,也可以促进植物的生长[3]。相关研究表明,施用ALA能明显提高低温胁迫下辣椒叶片中抗坏血酸(AsA)、还原型谷胱甘肽(GSH)等的含量,提高抗坏血酸过氧化物酶(APX)、脱氢抗坏血酸还原酶(DHAR)、谷胱甘肽还原酶(GR)和单脱氢抗坏血酸还原酶(MDHAR)等的酶活性,降低植物叶片中活性氧的产生速率。因此,ALA能够有效清除细胞内的活性氧,进而减轻低温胁迫的冻害[4]。赵宝龙等[5]研究发现盐胁迫下,在葡萄叶面喷施ALA能够提高葡萄叶片中AsA和GSH含量以及叶片中MDHAR、DHAR、GR和APX的活性,因而使AsA-GSH循环代谢正常有效地运行,增强了植物的耐盐性,提高了植物清除活性氧的能力,缓解因盐胁迫而造成的伤害。低温条件下,枇杷极易受到冻害,目前已有相关学者研究了外源NO、GSH、SA、硝普钠以及钙调素拮抗剂TFP等对低温胁迫下枇杷幼果AsA-GSH循环代谢的影响[6-9],但是关于外源ALA对低温胁迫下枇杷叶片AsAGSH循环的影响未见相关研究报道。本研究以早钟6号枇杷品种为试验材料,研究喷施不同浓度的外源ALA对低温胁迫下枇杷叶片AsAGSH循环系统的影响,旨在为揭示其生理机制提供理论依据。
1 材料与方法
1.1 试验材料
选取没有病虫害的、没有损伤的、长势整齐一致的、生长正常的3年生早钟6号枇杷容器苗为试材。样品处理参照赵宝龙等[5]的方法稍做修改,处理前1 d将枇杷幼苗叶片冲洗干净,A1、A2、A3处理分别采用100、150 、175 mg·L-1 ALA喷施叶片至湿润为止,以喷施清水为对照(CK,0 mg·L-1ALA处理),2 d后于-3℃低温下处理3 h,相对湿度70%,光照强度2000 Lx。每个处理3株,即为3次重复。采样参照吴锦程等[10]的方法,选取枝条自上往下数第3~5片叶片(叶龄10~15 d)进行取样,每个处理共取10片叶组成混合样,并将样品经液氮速冻后置于-70℃超低温冰箱中保存待测相关指标。
1.2 测定项目与方法
可溶性蛋白和H2O2含量的测定参照邹琦等[11]的方法,以μmol·g-1表示H2O2含量,以mg·g-1表示蛋白质含量。GSH和AsA含量测定参照陈建勋等[12]的方法,以μmol·g-1表示GSH和AsA的含量。DHAR和MDHAR活性测定参照宋松泉等[13]的方法,以μmol AsA·min-1·mg-1表示DHAR活性,以nmol NADH·min-1·mg-1表示MDHAR活性。GR和APX酶活性的测定参照陈建勋等[12]的方法,GR的1个酶活性单位用1 min内OD340 nm变化0.01来定义,以室温下1 min氧化1 μmol AsA的酶量作为一个酶活性单位(U)。
1.3 数据分析
试验各项指标测定均为3次重复试验,取平均值。试验数据采用SSPS软件和Microsoft Excel进行处理并作图。
2 结果与分析
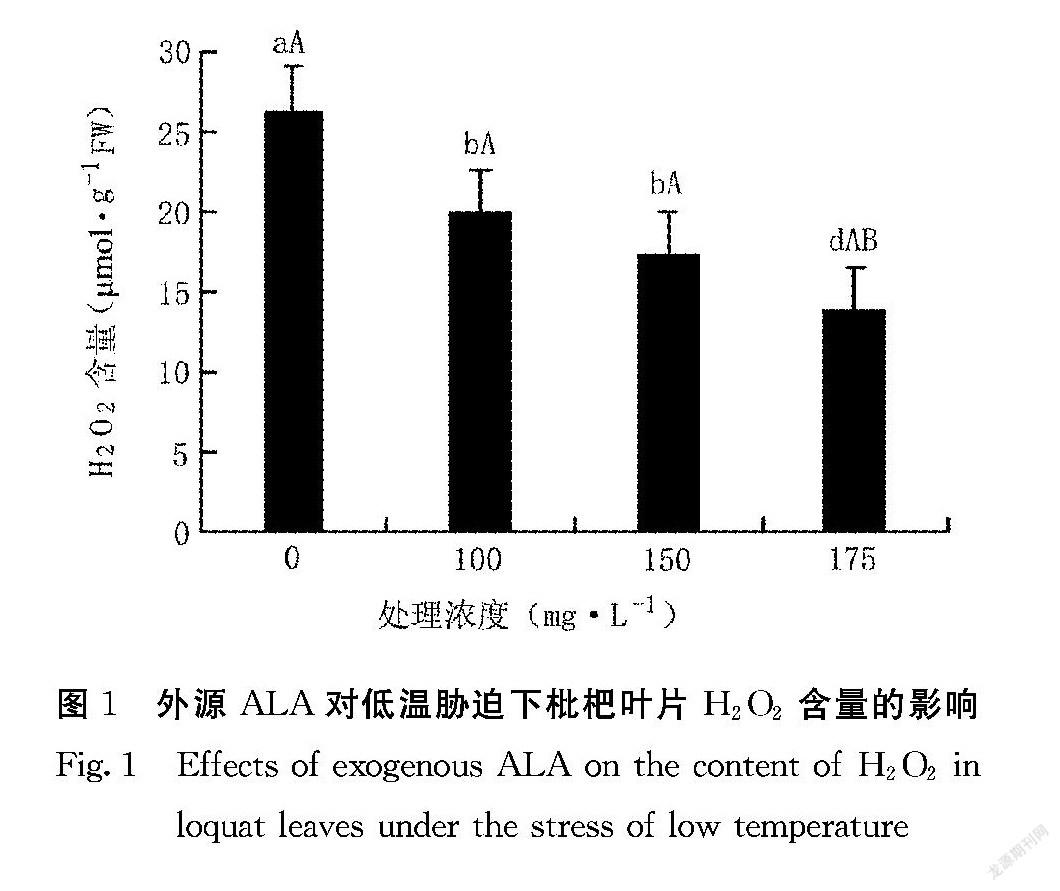
2.1 外源ALA对低温胁迫下枇杷叶片H2O2含量的影响
植物细胞在低温胁迫等逆境下会发生活性氧的积累,并使细胞质膜过氧化加剧受损,从而使细胞受到冻害。由图1可知,在-3℃低温胁迫下,不同浓度外源ALA处理的枇杷叶片中H2O2含量均低于清水对照(CK),且差异达显著水平(P<0.05)。175 mg·L-1处理与100、150 mg·L-1处理之间H2O2含量差异达显著水平(P<0.05)。在低温逆境下,不同浓度外源ALA处理的枇杷叶片H2O2含量表现为100 mg·L-1>150 mg·L-1 >175 mg·L-1,表明外源ALA处理能够减少低温逆境下枇杷叶片中H2O2含量的積累,随着浓度的增加,枇杷叶片H2O2含量均呈下降趋势。
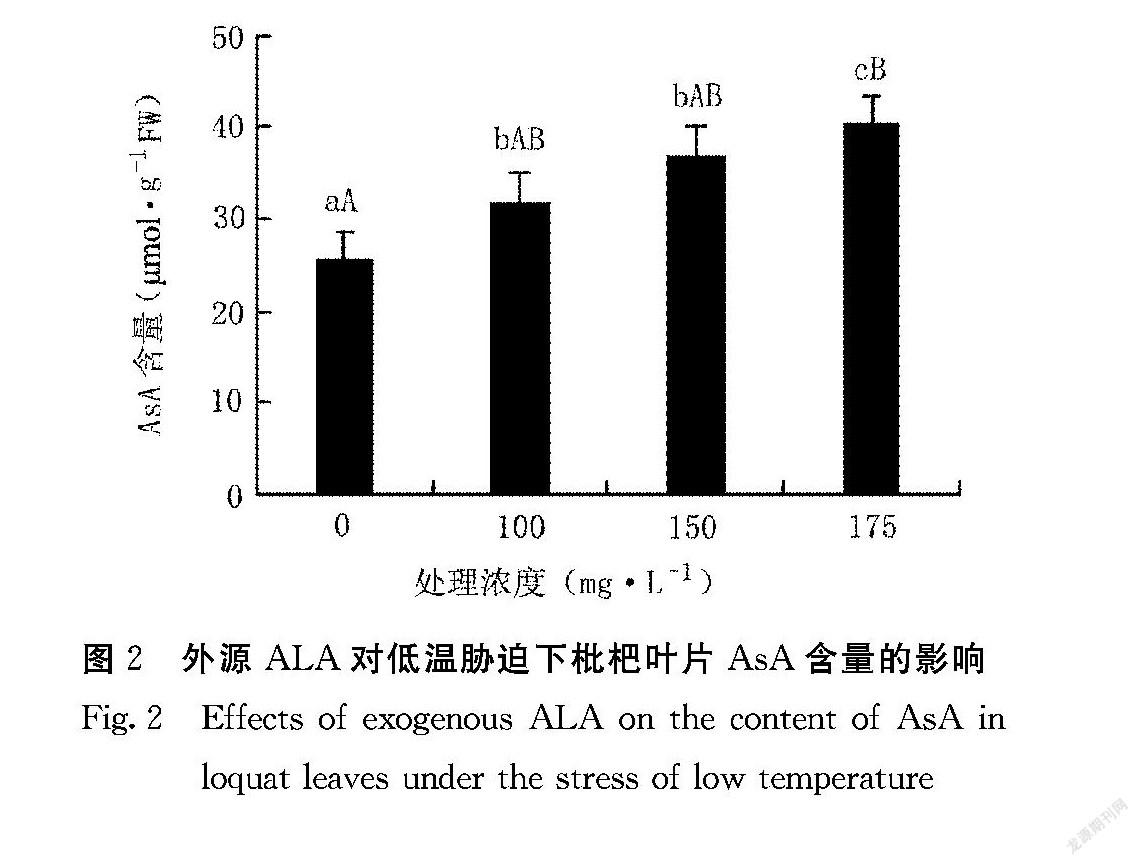
2.2 外源ALA对低温胁迫下枇杷叶片AsA含量的影响
AsA能够通过氧化还原反应来清除H2O2,是植物细胞内重要的抗氧化剂。由图2可知,在-3℃低温胁迫下,不同浓度外源ALA处理的枇杷叶片中AsA含量均高于清水对照(CK),且差异均达显著或极显著水平。175 mg·L-1 ALA 处理的枇杷叶片AsA含量上升最为明显,与清水对照(CK)差异达极显著水平(P<0.01)。在低温逆境下,随着外源ALA处理浓度的增加,枇杷叶片中AsA含量均呈上升趋势。说明外源ALA能够增加低温胁迫下枇杷叶片AsA含量。
2.3 外源ALA对低温胁迫下枇杷叶片GSH含量的影响
GSH也是植物细胞内重要的过氧化物清除剂之一。由图3可知,在-3℃低温胁迫下,枇杷幼苗叶片中GSH含量均随着外源ALA浓度的增加而呈上升趋势,大小变化表现为175 mg·L-1 >150 mg·L-1>100 mg·L-1,ALA处理的枇杷幼苗叶片中GSH含量均高于清水对照(CK),且差异均达显著或极显著水平。由此说明,外源ALA处理能够提高低温逆境下枇杷幼苗叶片中GSH含量,增加GSH的积累;并且随着ALA浓度的增加,枇杷叶片中GSH含量均上升。
2.4 外源ALA对低温胁迫下枇杷叶片DHAR活性的影响
DHAR在维持植物细胞内抗坏血酸的水平起着重要的作用。由图4可见,在-3℃低温胁迫下,随着外源ALA浓度的增加,枇杷幼苗叶片中DHAR活性增加。外源ALA处理的枇杷幼苗叶片的DHAR活性均大于清水对照(CK),且差异达显著或极显著水平。150 mg·L-1处理与100 mg·L-1处理差异达显著水平(P<0.05),175 mg·L-1处理与100 、150mg·L-1 处理差异达极显著水平(P<0.01)。可见,不同浓度外源ALA处理对枇杷幼苗叶片DHAR活性有不同的影响,由此可以得出,外源ALA处理可以有效提高低温胁迫下枇杷幼苗叶片DHAR活性。
2.5 外源ALA对低温胁迫下枇杷叶片MDHAR活性的影响
从图5可知,在-3℃低温胁迫下,枇杷幼苗叶片经外源AsA各浓度的处理后,MDHAR的活性有提高,且均高于清水对照组(CK),其中100 mg·L-1处理的枇杷叶片MDHAR活性与清水对照差异不显著(P>0.05),但150 mg·L-1 、175 mg·L-1 ALA处理的MDHAR活性与清水对照及100 mg·L-1 ALA处理差异达极显著水平(P<0.01)。表明外源ALA处理对枇杷幼苗叶片MDHAR活性有一定的影响。在低温胁迫下,不同浓度外源ALA处理的枇杷叶片MDHAR活性表现为175 mg·L-1>150 mg·L-1>100 mg·L-1。说明外源ALA的处理可以增加MDHAR活性。
2.6 外源ALA对低温胁迫下枇杷叶片APX活性的影响
从图6可知,在-3 ℃低温胁迫下,不同浓度外源ALA处理对枇杷幼苗叶片APX活性有不同的影响,但趋势都高于清水对照组(CK)。并且随着外源ALA浓度的增加,枇杷叶片APX活性也得到提高,差异性达显著水平(P<0.05)。其中175 mg·L-1 ALA处理的枇杷叶片APX活性增加最为明显,与清水对照(CK)处理相比差异达极显著水平(P<0.01)。由此可说明,枇杷幼苗叶片在-3℃低温胁迫下,叶片喷施一定浓度的外源ALA,可以显著提高枇杷叶片中APX活性。
2.7 外源ALA对低温胁迫下枇杷幼苗叶片GR活性的影响
植物细胞中GSH库的水平与GR活性有关,GR能够将GSSG还原为GSH,对维持AsA-GSH循环具有重要的作用,而且它的活性也是H2O2清除能力的标志。从图7可知,在-3℃低温胁迫下,外源ALA处理的枇杷幼苗叶片GR活性均提高,表现为175 mg·L-1>150 mg·L-1>100 mg·L-1 ,且與清水对照(CK)处理差异达显著水平(P<0.05)。但经外源ALA各处理之间GR活性差异均不显著(P>0.05)。由此可以说明,外源ALA能够提高低温胁迫下枇杷叶片GR活性,促进其清除H2O2的能力。
2.8 外源ALA对低温胁迫下枇杷叶片形态变化的影响
在-3℃低温胁迫下,不同浓度外源ALA处理枇杷幼苗叶片的形态特征与清水对照(CK)存在差异。由图8~9可知,在低温胁迫处理后的第1 d,清水对照处理的枇杷幼苗叶片形态所表现出的冻害程度较重,呈现叶片卷曲,叶色褐变,而外源ALA处理的枇杷幼苗形态所表现出的冻害程度较清水对照(CK)处理轻,呈现叶片出现较少的卷曲,叶色褐变程度较轻,且随着外源ALA浓度的增加,枇杷幼苗叶片形态所表现出的冻害程度趋于减轻。由图8~9可见,在低温胁迫处理后的第7 d,清水处理的枇杷幼苗叶片变化更为明显,部分枇杷幼苗已枯萎,100 mg·L-1ALA处理的枇杷幼苗叶片枯萎程度较清水对照(CK)轻,而150 mg·L-1和175 mg·L-1ALA处理的枇杷幼苗叶片枯萎程度最轻。不同处理幼苗冻害的形态变化与对应冻害的相关生理指标变化相吻合。
3 讨论
植物在逆境条件下会发生过氧化氢的积累并且能够氧化细胞内蛋白质、核酸等,使细胞受到伤害,进而加快细胞的衰老和解体[14]。AsA-GSH循环系统是植物体内清除细胞活性氧的重要途径之一,能够提高植物的抗逆性[15]。AsA-GSH循环中两种重要的抗氧化剂是AsA和GSH,且GR、MDHAR、DHAR、APX等也是AsA-GSH循环体系中重要的组成酶。在AsA-GSH循环体系中,在APX的催化下,抗坏血酸能与过氧化氢反应,使其接受以还原型谷胱甘肽为中介的NADPH电子供体最终还原为水,进而达到H2O2的清除。而ASA则通过MDHAR的作用再生成,GSH则在GR的作用下再生成[16-17]。AsA能有效清除活性氧减轻植物细胞的氧化受损,有研究表明,在低温胁迫下,对辣椒叶片喷施一定浓度的ALA能够提高辣椒叶片中AsA含量,降低活性氧的产生速率,进而缓解低温逆境对辣椒的伤害[4]。本研究中不同浓度外源ALA处理能提高枇杷叶片AsA含量进而减少H2O2含量,减轻低温胁迫对枇杷的伤害。GSH能够通过参与AsA-GSH循环来清除H2O2,或是直接清除H2O2。GSH还具有加快AsA再生的作用。相关研究表明,盐胁迫下对黄瓜幼苗喷施外源
ALA能提高黄瓜幼苗中GSH含量,增强其抗盐性[3]。本研究结果表明,外源ALA处理能够提高低温胁迫下枇杷幼苗叶片中GSH含量,清除逆境下积累的H2O2,进而减轻细胞的损伤。
在低温胁迫下,AsA在APX作用下清除H2O2,而AsA被氧化形成DHA和MDHA,MDHA和DHA在MDAR和DHAR作用下再生成AsA,因而MDHAR和DHAR的活性也得到相应的提高[5]。有研究表明,在低温胁迫下,草莓叶片中APX活性的增加提高了植物的抗性[18]。本试验结果表明,在枇杷叶面喷施外源ALA能够进一步提高低温胁迫下枇杷叶片中APX、MDHAR、DHAR活性,其结果与外源ALA缓解黄瓜幼苗盐胁迫的效果及机理研究的结果一致[19]。GR是植物细胞中清除活性氧的重要组分之一,其活性能直接影响还原型谷胱甘肽库的水平。有研究发现在玉米幼苗表面喷施一定浓度的外源ALA能够有效提高GR活性,进而提高玉米幼苗的抗冷性[20]。本试验结果发现,在枇杷叶面喷施一定浓度的外源ALA能有效地提高低温胁迫下枇杷叶片中GR活性,从而减轻低温胁迫对枇杷的冻害。4 结论
本研究结果表明,在低温胁迫下枇杷幼苗叶面喷施外源5氨基乙酰丙酸(ALA)能够进一步提高枇杷幼苗叶片中AsA和GSH的含量以及DHAR、MDHAR、GR和APX的活性,降低H2O2的含量,从而促使AsA-GSH循环系统的正常有效运行,提高枇杷幼苗清除H2O2的能力,使枇杷幼苗叶片的形态变化较小,进而能有效缓解因低温胁迫而造成枇杷幼苗的氧化伤害,增强植物的抗冷性。
参考文献:
[1]吴锦程,陈建琴,梁杰,等.外源一氧化氮对低温胁迫下枇杷叶片AsA-GSH循环的影响[J].应用生态学报,2009,20(6):1395-1400.
[2]徐田军,董志强,兰宏亮,等.低温胁迫下聚糠萘合剂对玉米幼苗光合作用和抗氧化酶活性的影响[J].作物学报,2012,38(2):352-359.
[3]燕飞.外源5氨基乙酰丙酸(ALA)对盐胁迫下黄瓜幼苗生理调控效应研究[D].咸阳:西北农林科技大学,2014.
[4]刘涛.5氨基乙酰丙酸对低温胁迫下辣椒生理代谢的影响[D].南京:南京农业大学,2011.
[5]赵宝龙,刘鹏,王文静,等.5氨基乙酰丙酸(ALA)对盐胁迫下葡萄叶片中AsA-GSH循环的影响[J].植物生理学报,2015,51(3):385-390.
[6]吴锦程,梁杰,陈建琴,等.GSH对低温胁迫下枇杷幼果叶绿体AsA-GSH循环代谢的影响[J].林业科学,2009,45(11):15-19.
[7]黄志明,吴锦程,陈伟健,等.SA对低温胁迫后枇杷幼果AsA-GSH循环酶系统的影响[J].林业科学,2011,47(9):36-42.
[8]黄志明,陈宇,吴晶晶,等.硝普钠对低温胁迫下枇杷幼果线粒体AsA-GSH循环代谢的影响[J]. 热带作物学报,2011,32(8):1469-1474.
[9]林素英,梁杰,黄志明,等.钙调素拮抗剂TFP对低温胁迫下枇杷幼果AsA-GSH循环的影响[J]. 热带作物学报,2012,33(11):1980-1984.
[10] 吴锦程,陈伟建,蔡丽琴, 等.外源NO对低温胁迫下枇杷幼果抗氧化能力的影响[J]. 林业科学,2010,46(9):73-78.
[11]邹琦.植物生理学实验指导[M]. 北京:中国农业出版社,2001:166-167.
[12]陈建勋,王晓峰.植物生理学实验指导[M].广州:华南理工大学出版社,2002: 119-127.
[13]宋松泉,程紅焱,姜孝成,等.种子生物学研究指南[M].北京:科学出版社,2005: 97-100.
[14]王娟,李德全.水分胁迫对玉米根系AsA-GSH循环及H2O2含量的影响[J].中国生态农业学报,2002,10(2):98-100.
[15]MANISHA G,ANN C,JACO V,et al.Copper affects the enzymes of ascorbate-glutathione cycle and its related metabolites in the roots of ascorbate-glutathione cycle and its related metabolites in the roots of Phaseolus vulgaris[J].Physiologia Plantarum,1996,106(3):262-267.
[16]孙军利,赵宝龙,郁松林.外源水杨酸对高温胁迫下葡萄几种抗氧化酶活性和抗氧化物含量的影响[J].植物生理学报,2014,50(7):1014-1018.
[17]尹永强,胡建斌,邓明军.植物叶片抗氧化系统及其对逆境胁迫的响应研究进展[J].中国农学通报,2007,23(1):105-110.
[18]罗娅,汤浩茹,张勇.低温胁迫对草莓叶片SOD和AsA-GSH循环酶系统的影响[J].园艺学报,2007,34(6):1405-1410.
[19]武玥.外源5氨基乙酰丙酸(ALA)缓解黄瓜幼苗盐胁迫的效果及机理研究[D].兰州:甘肃农业大学,2018.
[20]孙阳. 5氨基乙酰丙酸(ALA)诱导玉米幼苗抗冷性的生理效应[D].哈尔滨:东北农业大学,2017.
(责任编辑:林玲娜)

