5-氨基水杨酸和免疫抑制剂药物预防上消化道型克罗恩病复发的疗效与安全性分析
陈媛媛,魏 娟,孙晓伟,杨 钊,赵 丽,陈春燕,吴 琳,杨妙芳,汪芳裕,刘 炯
0 引 言
克罗恩病(Crohn′s disease,CD)是炎症性肠病的一个主要亚型,是一种肠道透壁性疾病,病变呈节段性非连续分布,可累及全消化道[1-2]。根据蒙特利尔分型,可分为回肠型(L1)、结肠型(L2)、回结肠型(L3)及上消化道型(L4)。 在解剖学上L4-CD可进一步分为屈氏韧带以上的消化道:L4-食管、胃、十二指肠,屈氏韧带以下消化道包括:L4-空肠和L4-近端回肠[3]。L4-CD发病率为0.5%~16%[4]。L4-CD患者常提示病情严重,增加再住院率和再手术率。近年来,空肠及近端回肠的累及因预后更差而受到重视[4-7]。
目前关于L4-CD有效的医疗管理方法的文献很少,质子泵抑制剂(proton pump inhibitors,PPI)仅抑制胃酸的产生,不应作为单独治疗[8]。当患者出现并发症如严重的梗阻和穿孔、出血时,则需要外科干预[9]。5-氨基水杨酸(5-aminosalicylic acid,5-ASA)是CD中最常用的处方药,治疗轻到中度的活动性克罗恩病有效[12]。RCT的荟萃分析发现,没有证据表明口服美沙拉嗪制剂在诱导或维持缓解方面优于安慰剂,而美沙拉秦作为一种诱导剂仅具有适度的益处[13-14]。免疫抑制剂仍是最常用于克罗恩病患者维持缓解的药物[15-16]。然而免疫抑制剂有显著的不良反应,约10%~28%的患者报告不良反应[17],尤其在东方人群中,最严重的不良反应是白细胞减少[18-19]。因此,本研究旨在比较5-ASA药物和免疫抑制剂药物预防L4-CD的复发的疗效与安全性。
1 资料与方法
1.1 研究对象回顾性分析2012年1月至2018年12月东部战区总医院消化内科48例确诊为L4-CD患者的临床资料。根据临床用药分为5-ASA组(使用5-ASA,n=30)和免疫抑制剂组(使用免疫抑制剂硫唑嘌呤、甲氨蝶呤、雷公藤总苷,n=18)。纳入标准:①根据《2018年中国炎症性肠病诊断与治疗的共识意见》,CD诊断明确的中国患者,年龄在14~ 75岁,且疾病处于缓解期;②已完善全消化道评估(包括内镜及CT、MR小肠造影)并按蒙特利尔标准分型:上消化道型;③治疗上使用5-ASA药物或者免疫制剂来治疗和维持缓解。排除标准:①溃疡性结肠炎、肠结核、感染性胃肠炎、胃肠道肿瘤及其他原因引起的肠病(如活动性自身免疫病)、合并严重的心肺肝肾及造血功能障碍;②外伤性肠切除术史;③针对克罗恩病正在进行的治疗:手术治疗L4-CD、激素、抗生素全身用药和管饲;之前或正在使用英夫利昔单抗;④有肝功能异常史;筛查时或在之前的6个月内白细胞<4.5×109,血红蛋白<80 g/L,血小板<100×109。2组性别、年龄、病程、病变部位等比较差异无统计学意义(P>0.05),见表1。
1.2方法收集的资料包括性别、发病年龄、发展至L4病程、肛周病变、吸烟史与家族史等一般情况,着重记录患者的上消化累及部位、病变类型、治疗方法、复发和不良反应。L4-CD根据病变部位分为:屈氏韧带以上为L4-EGD者(n=28),屈氏韧带以下为L4-空肠与近端回肠者(n=20)。其中L4-EGD者分为5-ASA亚组(n=18),免疫亚组(n=10);L4-空肠与近端回肠者分为5-ASA空回肠亚组(n=12),免疫空回肠亚组(n=8)。内镜评估由内镜专家评出CD简化内镜评分(simple endoscopic score for Crohn′s disease,SES-CD),2年是该研究设计的终点。
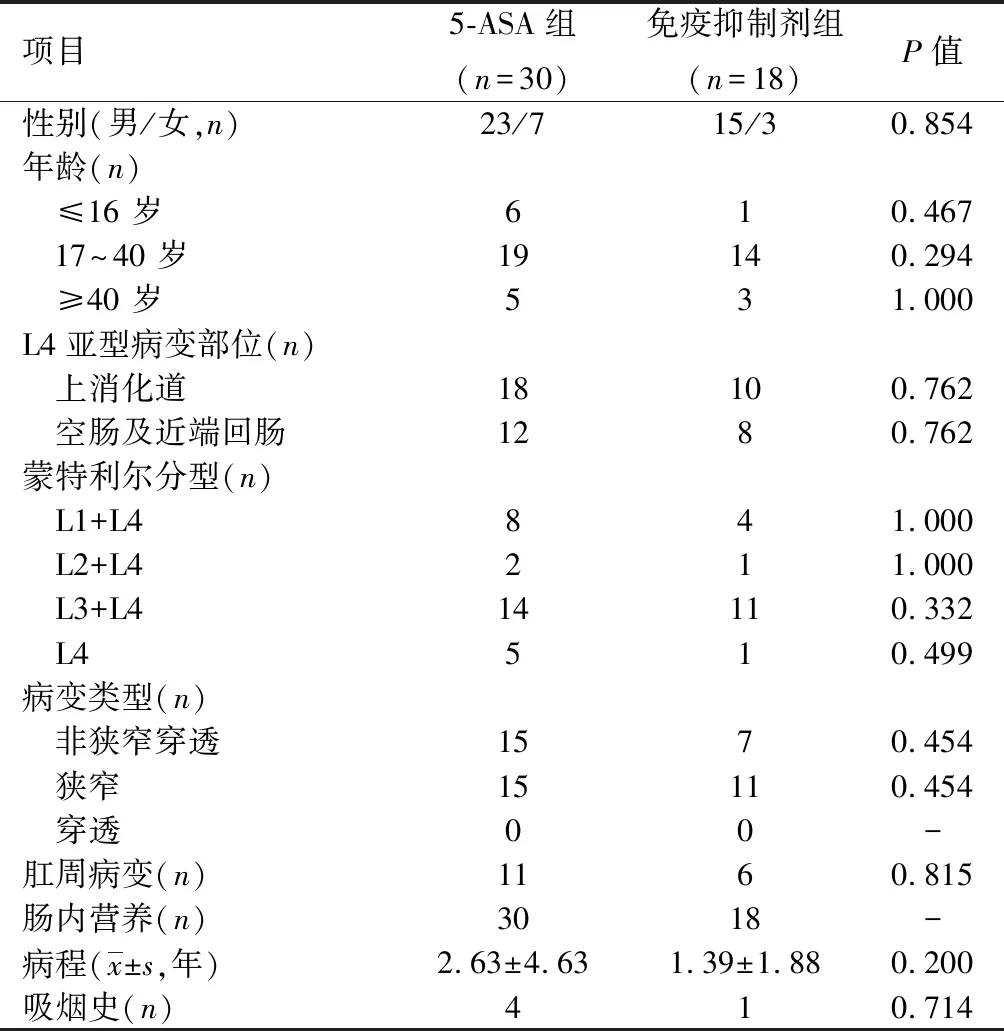
表 1 L4-CD患者一般资料的比较
1.3观察指标临床复发定义为第6个月、12个月、24个月时克罗恩病活动指数(Crohn′s disease activity index,CDAI)>150且升高70,且导致复发的病变经内镜或影像学证实;内镜复发定义为患者的新发病变或SES-CD评分下降<50%且SES-CD>2[20-21];手术复发定义为需要手术诱导缓解。比较造血系统损伤、肝功能损伤、胃肠道及皮肤黏膜等的不良反应发生率。在L4-CD的亚型比较中,比较2组疾病行为(非狭窄非穿透、狭窄、穿透、肛周病变)及临床、内镜、手术复发率。

2 结 果
2.1 患者内镜、临床、手术复发的比较5-ASA组6个月内内镜及临床复发率、12个月内及临床复发率、24个月内内镜及临床与手术复发率较免疫抑制剂组明显升高(P<0.05)。见表2。

表 2 L4-CD患者内镜、临床、手术复发的比较[n(%)]
2.2L4-EGD组与L4-空肠与近端回肠组疾病行为的比较L4-EGD者、肛周病变者较L4-空肠与近端回肠者明显增多(P<0.05),L4-空肠与近端回肠者狭窄增多(P<0.05)。见表3。L4-EGD者5-ASA亚组与免疫亚组6个月、12个月、24个月内镜、临床、手术复发率比较差异无统计学意义(P>0.05),见表4。L4-空肠与近端回肠者5-ASA空回肠亚组6个月内内镜、临床复发率显著高于免疫空回肠亚组(P<0.05),12个月及24个月内镜、临床、手术复发率亦显著升高(P<0.05)。见表5。

表 3 L4-EGD组与L4-空肠近端回肠组疾病行为的比较(n)

表 4 L4-EGD者5-氨基水杨酸与免疫抑制剂内镜、临床、手术复发比较[n(%)]
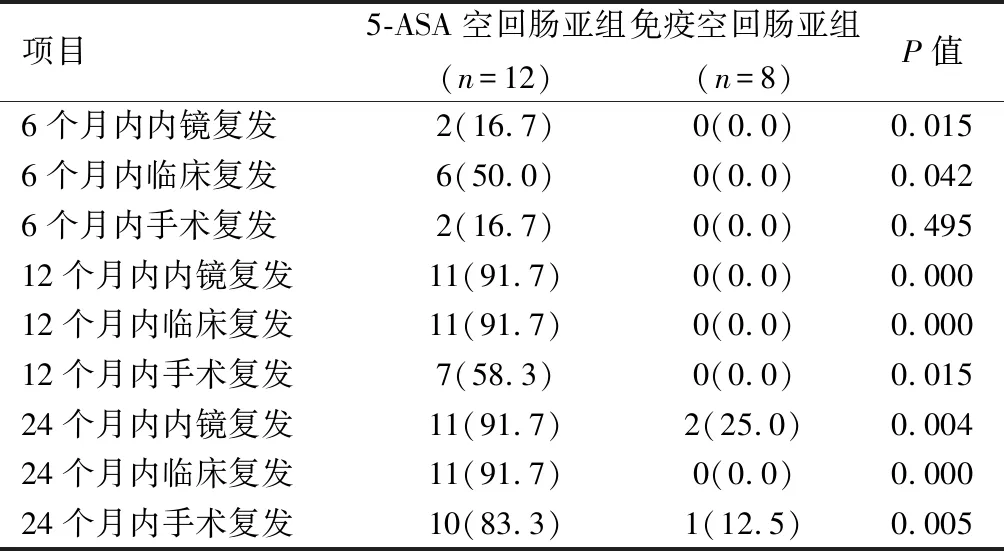
表 5 L4-空肠与近端回肠者5-氨基水杨酸与免疫抑制剂内镜、临床、手术复发的比较[n(%)]
2.3发生不良反应的比较5-ASA组出现胃肠道不良反应1例,免疫抑制剂组白细胞减少2例,2组均无其他不良反应。5-ASA组与免疫抑制剂组不良反应发生率比较差异无统计学意义(3.3%vs11.1%,P=0.644),因不良反应停药率比较差异亦无统计学意义(0vs5.6%,P=0.375)。
3 讨 论
本项研究中,5-氨基水杨酸组6、12、24个月内镜、临床及24个月手术复发率都显著高于免疫抑制剂组(P<0.05),可能是因为L4-CD病情程度重,活动性强,容易复发,而5-氨基水杨酸对L4-CD病情控制差,不能有效维持缓解而导致复发加重,甚至需手术治疗。
在L4的亚组比较中,L4-空场与近端回者5-ASA空回肠亚组6、12、24个月内镜、临床复发率显著高于免疫空回肠亚组(P<0.05),而L-EGD者两组药物比较差异无统计学意义(P>0.05),提示L4-空场与近端回肠者可能较L4-EGD者疾病活动更强,也可能跟纳入的病例数较少有关。同时,L4-空肠与近端回肠者5-ASA空回肠亚组12、24个月手术复发率也高(P<0.05),这可能与L4-空肠与近端回肠组狭窄病变较多有关(P<0.05)。
既往研究表明,L4累及往往预后较差,如住院时间延长或反复住院,手术需要增加,术后容易复发等[4]。而目前对于L4-CD的治疗原则,ECCO指南推荐早期使用免疫抑制剂或生物制剂治疗,而我国多采用美沙拉嗪/激素-免疫抑制剂-生物制剂的升阶梯治疗,对于两种治疗方案的对比目前仍缺乏RCT研究。Guo等[22]的回顾性研究表明,硫嘌呤治疗有助于降低L4-CD患者手术复发的风险。在本研究中,5-氨基水杨酸对L4-CD病情控制差,而免疫抑制剂维持L4-CD缓解方面有明显疗效。
L4亚型的比较中,L4-EGD组两种药物比较无统计学意义,而L4-空肠与近端回肠组免疫抑制剂预防12、24个月临床复发疗效优于5-氨基水杨酸。同时免疫抑制剂组12、24个月手术复发疗效也优于5-氨基水杨酸,可能是因为累及空肠、近端回肠组容易出现狭窄病变,这也与以往研究相符[23],提示L4-CD空肠与近端回肠组需优先考虑免疫抑制剂治疗,可能有助于维持临床缓解,延缓手术,从而改变病情进展,改善预后。
近年来,CD的治疗目标从单纯的症状控制转向粘膜愈合和深度缓解[24]。实现内镜愈合(而不仅仅是症状缓解)会显著降低复发率,再住院次数和外科手术的风险[25-26]。内镜复发先于临床复发,通过内镜下粘膜评估能有效预测临床或手术复发。结肠镜检查,是检测CD内镜疾病活动的金标准[27]。本研究中,临床诊断CD复发通过CDAI评分,诊断内镜复发用SES-CD简易评分,它作为克罗恩病内镜严重性指数(CDEIS)的简化标准,在验证内镜指数,评价CD方面比CDEIS更有效率[27-28]。本研究结果显示免疫抑制剂药物维持L4-CD缓解,预防内镜复发优于5-氨基水杨酸,对临床具有指导意义。
免疫抑制剂药物治疗CD可引起严重的骨髓抑制,常发生白细胞、血红蛋白和血小板减少,尤其以白细胞减少为主。尽管免疫抑制剂是治疗CD的一种廉价、有效的治疗选择,但较高的不良反应发生率往往限制了其临床应用[29-30]。本研究中,免疫抑制剂组出现两例白细胞减少,不良反应发生率11.1%,1例更换另一种免疫抑制剂,5-ASA组1例胃肠道不良反应,不良反应发生率3.3%,总体来看2组不良反应均较少,可能跟纳入的病例数较少有关。
我们的结果显示,免疫抑制剂优于5-氨基水杨酸维持L4-CD缓解。然而,荟萃分析和随机临床试验表明,免疫抑制剂单一疗法与生物制剂或联合治疗相比,治疗效果是有限的[31-32]。随着生物制剂的发展,越来越多可选择的、有效的、更便宜的生物制剂用于治疗广泛病变和更严重CD患者[33-34]。另外,随着肠内营养(EEN)在克罗恩病(不仅仅是儿童)治疗中的研究越来越多[35-36],已被发现并证实有重要价值,今后有必要进一步添加生物制剂和EEN组进行比较研究。
这是一项单中心的回顾性研究,病例数量有限,血清学资料不完整,如炎症指标C-反应蛋白(CRP)和粪钙蛋白(FC),以及在回顾性研究中无法进行药物血清学监测,有一定内在的缺陷,然而,我们获得的初步信息对于改善L4疾病的预后需要更积极的初始治疗,具有重要意义。另外,我们的结果未来还需要大样本的随机对照研究来确认。

