125I粒子植入联合抗PD-1治疗对小鼠Lewis肺癌的抑制作用研究
曹熠熠 李文波 翁宇 李佳 陈畅 庞华 王政杰
肺癌是全球癌症发病率及死亡率最高的癌症[1],并且大部分患者初诊时已失去手术机会[2]。晚期患者主要的治疗方式有放疗、化疗及分子靶向治疗。近年,免疫治疗在提高肺癌晚期患者生存率方面具有很大潜力,如抗程序性死亡受体-1(programmed cell death receptor-1,PD-1)/程序性死亡配体1(pro⁃grammed death-ligand 1,PD-L1)治疗,能显著延长肺癌患者生存期[3-4]。
PD-1及其配体PD-L1是造成肿瘤微环境免疫抑制状态的关键分子。肿瘤细胞可通过表达PD-L1与T细胞表面的PD-1结合,导致T细胞功能衰竭[5]。研究发现,放疗可促进T 细胞活化与增殖,激活抗肿瘤免疫,但同时会上调肿瘤细胞PD-L1表达,抑制抗肿瘤免疫,导致放疗的免疫激活作用不足以打破免疫抑制状态[6]。研究表明,常规放疗联合抗PD-1 治疗可协同促进抗肿瘤免疫,显著抑制肿瘤生长[7]。
放射性125I 粒子植入是一种近距离内放疗,有别于常规放疗,具有超分割低剂量率特点,已作为晚期肺癌治疗的重要手段之一。目前,关于超分割放疗对肿瘤免疫的影响研究较少,超分割放疗联合抗PD-1 治疗的相关报道也少见。本研究通过构建小鼠Lewis肺癌模型,利用流式细胞术分析125I粒子植入对免疫抑制分子的影响,以及125I粒子植入联合抗PD-1治疗的抗肿瘤作用,为临床上超分割放疗联合抗PD-1治疗提供理论依据。
1 材料与方法
1.1 材料
1.1.1 细胞株及小鼠 LEWIS 肺癌细胞(LLC)购自中国科学院上海细胞库。C57BL/6 纯系雌性小鼠,6~8 周龄,体质量18~22 g,购自重庆医科大学实验动物中心,SPF 条件下饲养。小鼠接种原位肿瘤,第12天将小鼠分为对照组(control组)和125I粒子植入组(125I RPI组),每组5只。动物实验经过重庆医科大学附属第一医院伦理审查会批准,并按照伦理委员会实验动物使用和保护规定执行。
1.1.2 试剂 胎牛血清、DMEM培养基、胰酶、磷酸盐缓冲液(PBS)均购自美国GIBCO 公司,红细胞裂解液、流式抗体(CD4-FITC、CD8a-APC、CD25-BV421、Foxp3-PE、同型对照抗体)、固定破膜液均购自美国BD Pharmingen 公司,胶原酶Ⅳ购自美国Sigma 公司,DNA 酶、透明质酸酶购自北京索莱宝生物科技有限公司,125I粒子植入购自成都欣科有限公司。PD-1抗体购自美国BioXcell公司。
1.2 方法
1.2.1 细胞培养 将LLC 加入含10%胎牛血清的DMEM 高糖培养基,接种于25 cm2的培养皿中,并置于37℃、5%CO2的孵箱中培养,待细胞贴壁并覆盖培养皿底部80%左右时,用0.25%胰蛋白酶消化并传代。
1.2.2 肿瘤模型建立 收集处于对数生长期的细胞,PBS重悬,调整细胞浓度。将0.1 mL细胞悬液(细胞数量为1×106)接种于小鼠右后肢皮下,定义为原位肿瘤。第3天在左前肢皮下注射1×106个LLC细胞,定义为远位肿瘤。成瘤后每2~3天用游标卡尺测量并记录肿瘤体积,肿瘤体积=1/2(长径×短径²)。
1.2.3125I 粒子植入 第12 天当肿瘤体积达(300±50)mm3,挑选形态规则,近似球形的肿瘤。1%戊巴比妥腹腔注射麻醉小鼠,剂量为50 mg/kg。将小鼠固定,对肿瘤及周围皮肤消毒,18 G植入针从在距肿瘤边缘0.5 cm 处皮下潜行刺入瘤体中心,退出针芯,将一粒125I 粒子装入植入针中,利用针芯将粒子推入瘤体中心,退出植入针,用棉球压迫止血。小鼠采用单笼饲养,观察小鼠饮食、活动、精神,以及瘤体皮肤有无红肿、破溃等。
1.2.4 抗PD-1 治疗 在第12、14、16、18 和20 天给予PD-1抗体200 μL,腹腔注射,剂量为200 μg/只。
1.2.5 流式检测 第24 天,处死小鼠,剥离肿瘤,眼科剪将肿瘤剪碎至泥浆,加入消化酶,在37℃水浴震荡箱中孵育1~2 h。消化完毕后筛网过滤获得单细胞悬液,调整细胞数量至5×106。加入流式抗体,避光处理30 min,染色完成后离心,洗涤,重悬后上机。Foxp3染色时,用Perm/Fix破膜固定液,按照产品说明书进行染色。流式细胞检测结果使用Flowjo 软件进行分析。
1.3 统计学分析
采用GraphPad Prism 8.0 软件进行统计学分析。计量资料以x±s表示。独立样本比较采用t检验,均数比较采用单因素方差分析,肿瘤生长曲线的比较采用重复测量方差分析。所有实验均独立重复3次。以P<0.05为差异具有统计学意义。
2 结果
2.1 125I粒子植入对PD-1/PD-L1轴的的影响
在肿瘤接种后第24天处死小鼠,取肿瘤组织,用流式细胞术分析肿瘤细胞PD-L1 及肿瘤浸润CD8+T细胞表面PD-1 的表达。结果显示125I 粒子植入后肿瘤细胞PD-L1表达上调(P<0.001),CD8+T细胞PD-1表达也上调(P=0.001,图1)。
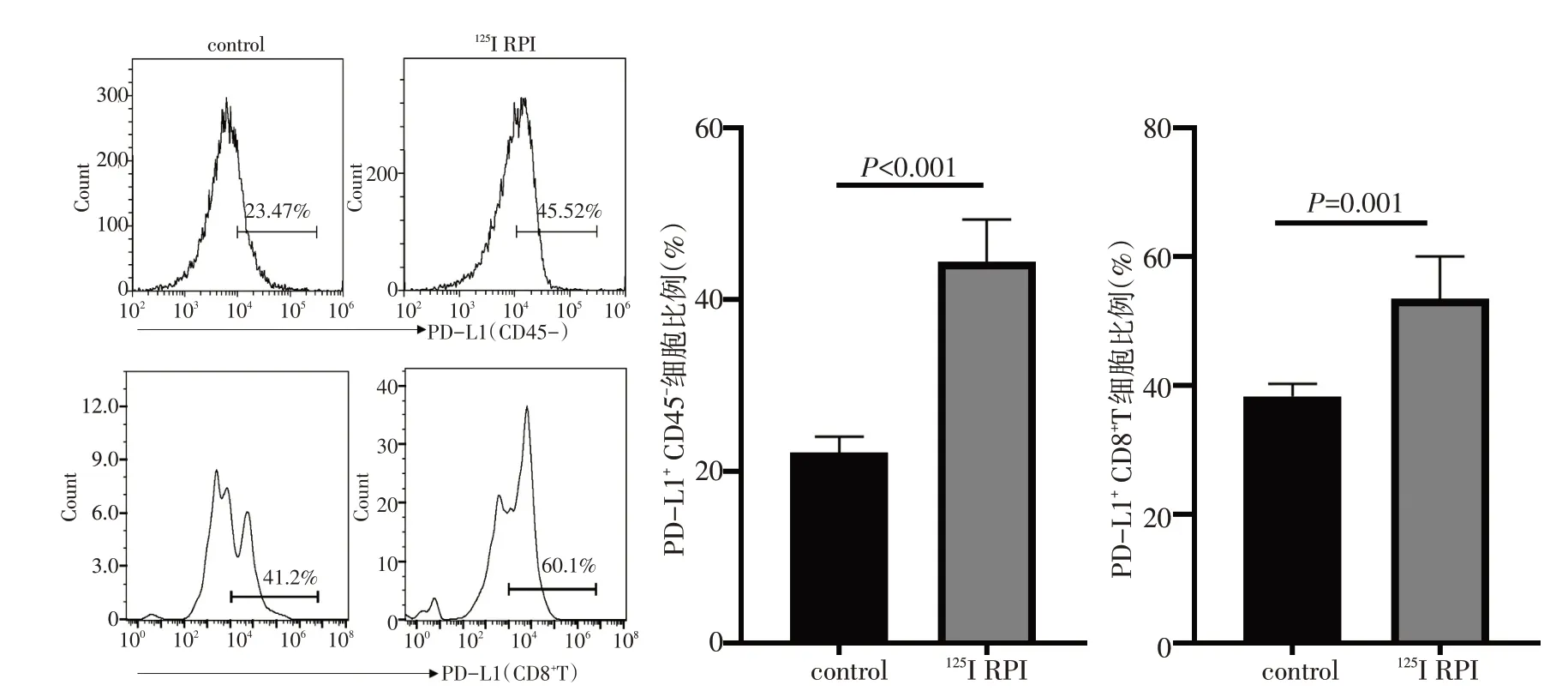
图1 125I粒子植入对肿瘤细胞PD-L1表达及CD8+T细胞PD-1表达的影响
2.2 125I粒子植入对调节性T细胞的影响
进一步分析肿瘤组织中另一种免疫抑制淋巴细胞—调节性T 细胞(regulatory T cell,Treg)的比例,对照组肿瘤组织中Treg 比例为26.12%±2.76%,粒子植入组Treg 的比例为23.92%±1.98%,两组无显著性差异(P=0.196,图2)。
2.3 125I粒子植入联合抗PD-1治疗对肿瘤生长的影响
小鼠同时接种原位肿瘤和远位肿瘤,第12 天将小鼠分为PBS 组、125I RPI 组、抗PD-1 组和联合治疗组,并给予相关治疗。原位肿瘤生长曲线显示,与PBS组相比,抗PD-1组原位肿瘤体积减小不明显(P=0.548),125I RPI 组肿瘤体积显著减小(P=0.037)。联合治疗组能显著抑制原位肿瘤生长,肿瘤体积明显小于抗PD-1组和125I RPI组,差异均具有统计学意义(P<0.001 和P=0.005)。此外,远位肿瘤生长曲线显示,联合治疗组远位肿瘤体积明显小于抗PD-1 组和125I RPI 组(P=0.038 和P=0.017)。相比于对照组,抗PD-1 组和125I RPI 组远位肿瘤体积无显著性差异(P=0.713和P=0.980,图3)。
2.4 125I 粒子植入联合抗PD-1 治疗对抗肿瘤免疫的影响
进一步对肿瘤微环境中CD4+T 细胞及CD8+T 细胞进行分析。结果显示,与PBS 组相比,125I RPI 组与抗PD-1 组CD8+T 细胞比例未明显增加(均P>0.05),而联合治疗组CD8+T 细胞比例显著增加(P<0.001)。CD4+T细胞各组无显著性差异(均P>0.05,图4)。

图3 联合治疗对小鼠移植瘤肿瘤生长的影响
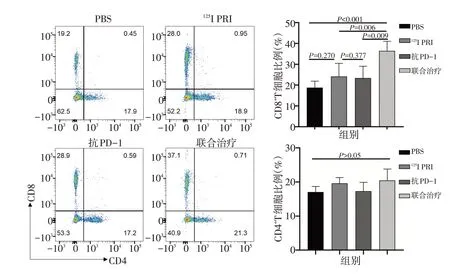
▶图4 联合治疗对肿瘤浸润CD4+T、CD8+T细胞比例的影响
3 讨论
放疗能造成照射野肿瘤细胞DNA 分子链断裂,抑制肿瘤细胞生长,此外还能引起照射野外肿瘤组织的减小或消退,这种现象被称为远位效应[8]。其原因是放疗可以促进肿瘤免疫原性细胞死亡,增加肿瘤抗原释放,使被辐射肿瘤变成“原位疫苗”[9],从而激活免疫。但放疗又能够上调包括PD-L1在内的免疫抑制分子表达,导致临床上远位效应十分罕见。鉴于此,有研究发现,放疗联合抗PD-1 治疗能诱发远位效应[8]。然而,目前研究仅限于探讨常规分割、低分割以及单次大剂量放疗联合抗PD-1 治疗的抗肿瘤作用,并且都采用外放疗[10-12]。125I粒子植入是一种超分割近距离内放疗,本研究旨在研究125I 粒子植入联合抗PD-1治疗的抗肿瘤作用。
既往研究发现,放疗的分割模式、剂量对肿瘤免疫有着不同的影响,与免疫治疗联合的疗效也存在差异[13]。所以本研究首先探究了125I粒子植入对免疫微环境中免疫抑制分子PD-1、PD-L1 及Treg 细胞的影响。Treg 是一种抑制性T 细胞,能抑制肿瘤免疫,有研究发现单次大剂量的放疗会上调Treg 的表达[14],本研究结果发现超分割放疗不会上调Treg 的表达,可见Treg 细胞可能不参与125I 粒子植入后的免疫抑制。本研究发现,125I粒子植入后PD-1及PD-L1表达上调,提示PD-1/PD-L1轴参与125I粒子植入后的免疫抑制,这为联合抗PD-1/PD-L1治疗提高125I粒子植入疗效的理论基础提供了依据。
本研究对125I 粒子植入联合抗PD-1 治疗的疗效结果表明,125I粒子植入联合抗PD-1治疗能显著抑制肿瘤生长,同时抑制远位肿瘤生长,产生远位效应,提示125I粒子植入联合抗PD-1能打破免疫抑制,激活全身抗肿瘤免疫。进一步探究其机制,本研究发现联合治疗可通过促进肿瘤浸润CD8+T细胞增殖活化,增强抗肿瘤免疫,但对CD4+T细胞比例无影响。既往研究发现,将CD4+T 细胞耗竭后对放疗联合抗PD-1治疗的疗效无影响[15],与本研究的结果一致。
此外,对于抗PD-1/PD-L1 治疗而言,既往研究发现,抗PD-1/PD-L1药物的疗效与肿瘤免疫微环境密切相关[16]。放疗能改变肿瘤免疫微环境,增加免疫治疗的敏感性,显著提高抗PD-1/PD-L1 疗效[17-18]。与免疫治疗的联合,使放疗的目的已经不再只局限于肿瘤局部控制,另一目的是最大程度地激发机体抗肿瘤免疫,发挥佐剂作用,与免疫治疗产生协同作用[19]。有研究证明放疗的免疫促进作用有时限性,放疗结束后再行免疫治疗会明显减弱抗肿瘤作用[6],125I 粒子植入能提供180 天的持续照射,可以发挥长时间的免疫促进作用,与抗PD-1/PD-L1治疗协同作用的时间窗更长。另外,与外放疗相比,125I粒子植入具有高度适形的优点,能实现靶区高剂量的同时降低对周围正常组织损伤,使正常组织中放射敏感性淋巴免疫细胞免受辐射。
本研究通过构建小鼠肺癌模型对125I粒子植入联合抗PD-1 治疗的协同机制进行了初步研究,证明了125I粒子植入联合抗PD-1治疗能激活抗肿瘤免疫,显著抑制肿瘤生长,为临床肺癌晚期患者的治疗提供了新思路。未来将进一步深入研究联合治疗的抗肿瘤机制并探索最佳的治疗方案。

