左乙拉西坦对缺氧缺血性脑损伤新生大鼠的神经保护作用及氧化应激反应的影响
王海滨,门庆玲,蔡艳丽,周文龙,郭海志,陈瑞祥
(资阳市第一人民医院 1.神经内科; 2.心血管内科,四川 资阳 641300;3.云南省第三人民医院 药剂科,云南 昆明 650011)
缺血缺氧性脑损伤(hypoxia ischemia brain-damage,HIBD)是机体脑部因缺乏或限制氧气和葡萄糖供应而造成结构损伤和功能紊乱,长时间的局部缺血可导致大脑严重或致命的损害[1]。在新生儿中,HIBD是导致其死亡和感觉运动、认知功能严重受损的主要因素[2]。目前,虽然大量学者对新生儿缺氧缺血性脑病(hypoxic ischemic encephalopathy,HIE)进行研究,但其具体发病机制尚不完全清楚,临床治疗缺乏特异性药物。因此,从分子水平对HIE发病机制的研究对其临床诊治具有重要意义。核因子E2相关因子2(nuclear factor erythroid 2-related factor 2,Nrf2)不仅是机体抗氧化的主要调节因子,也是抗感染、解毒蛋白基因表达的细胞保护因子[3],抗氧化反应元件(antioxidant response element,ARE)是其主要靶点,血红素加氧酶(heme oxyge-nase, HO-1)是ARE主要作用因子,Nrf2-ARE在脑损伤性疾病、帕金森等认知功能障碍性疾病中发挥重要作用[4-5]。左乙拉西坦(levetiracetam,LEV)是常见的抗癫痫药,可以有效治疗热性惊厥所引起脑损伤[6],但关于LEV对HIE的作用研究报道较少,本研究通过观察LEV对HIBD新生大鼠的影响,探究其可能作用机制,为HIE的临床诊治提供一定的理论基础。
1 材料与方法
1.1 材料
1.1.1 实验动物: SPF级雄性SD大鼠50只,7日龄,体质量15g左右[北京维通利华公司提供,许可证号:SCXK(京)2016-0006,合格证号:0015675]。
1.1.2 试剂: LEV(上海迈瑞尔化学科技有限公司)白细胞介素-6(IL-6)ELISA试剂盒、肿瘤坏死因子α (TNF-α)ELISA试剂盒(Abcam公司);丙二醛(MDA)ELISA试剂盒(南京森贝伽生物科技有限公司);超氧化物歧化酶(SOD)ELISA试剂盒(上海酶联生物公司);Trizol试剂(Invitrogen公司);鼠单克隆抗Caspase-3抗体、鼠单克隆抗Bcl-2抗体(Santa Cruz公司);兔源多克隆抗Nrf2抗体、兔源多克隆抗HO-1抗体、兔源单克隆抗GAPDH抗体(CST公司);辣根过氧化物酶标记的兔抗鼠免疫球蛋白(IgG)二抗(Abbkine公司)。
1.2 方法
1.2.1 大鼠的分组及处理: 随机挑选40只新生大鼠,参考文献[7]构建HIBD新生大鼠模型,另选10只为sham组。将造模成功的40只新生大鼠随机分成:model组(灌胃等量0.9%氯化钠溶液)、L、M、H LEV组[灌胃10、30、50 mg/(kg·d)],每组各10只,连续8 d,末次给药24 h后进行后续实验。
1.2.2 采集组织标本: 取小鼠眼球静脉丛血,1 800 r/min离心10 min取血清,储存于-20 ℃冰箱保存。取其脑部组织,剪取约0.5 g用于提取组织蛋白,储存在-80 ℃冰箱中备用。剩余脑组织,用4%多聚甲醛溶液固定,做常规石蜡切片,备用。
1.2.3 HE染色观察脑组织病理变化: 脑组织切片,脱蜡至水化,苏木精染色、伊红染液复染,脱水,透明,封片,镜下观察脑组织病理变化。
1.2.4 TUNEL检测脑组织神经元凋亡: 脱蜡至水化,TUNEL染色、脱水、透明、封片,镜下观察脑组织神经元凋亡情况。TUNEL阳性胞核内可见棕黄色颗粒,镜下随机选取5个视野,计算每个视野凋亡率,凋亡率(%)=TUNEL阳性细胞/总细胞数×100%,取平均数。
1.2.5 ELISA检测血清中炎性因子IL-10、IL-6、TNF-α及氧化应激因子MDA含量、SOD活性: 取血清,用ELISA试剂盒分别检测IL-10、IL-6、TNF-α、MDA的含量以及SOD活性表达,具体操作步骤参考其说明书。
1.2.6 Western blot检测脑组织caspase-3、Bcl-2、Nrf2、HO-1蛋白表达: 提取脑组织蛋白,BCA法检测蛋白浓度,调整上样蛋白至50 μg,十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),转膜、加一抗(caspase-3、Bcl-2、Nrf2、HO-1、GAPDH,1∶1 000),4 ℃孵育过夜,次日,加二抗室温孵育2 h,洗膜,加ECL发光液,用Bio-Rad成像系统检测蛋白吸光度信号,Image J软件定量分析蛋白表达情况。
1.3 统计学分析

2 结果
2.1 各组大鼠脑组织病理学变化结果
model组大鼠脑组织细胞排列紊乱呈弥漫性分布,空泡化增加,出现炎性浸润现象;与model组相比,L、M、H LEV组大鼠脑组织细胞排列较整齐,组织病理改变明显减少(图1)。
2.2 LEV对各组大鼠脑组织神经元凋亡的影响
与sham组相比,model组大鼠脑组织神经元凋亡率显著升高(P<0.05);与model组相比,L、M、H LEV组大鼠脑组织神经元凋亡率显著降低(P<0.05);与L、M LEV组相比,H LEV组大鼠脑组织神经元凋亡率显著降低(P<0.05)(图2, 3)。
2.3 LEV对各组大鼠血清中炎性因子IL-6、TNF-α的影响
与sham组相比,model组血清中IL-6、TNF-α表达显著升高(P<0.05);与model组相比,L、M、H LEV组大鼠血清中IL-6、TNF-α表达显著降低(P<0.05);与L、M LEV组相比,H LEV组大鼠血清中IL-6、TNF-α表达显著降低(P<0.05)(图4)。
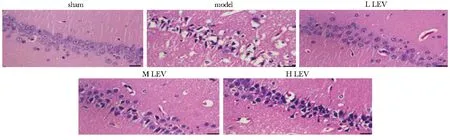
图1 各组大鼠脑组织HE染色图
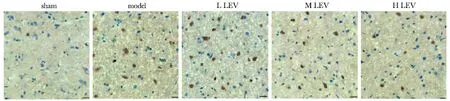
图2 各组大鼠脑组织TUNEL染色图Fig 2 TUNEL staining of brain tissue of rats in each group(scale bar=50 μm)

*P<0.05 compared with the sham group; #P<0.05 compared with the model group; ▲P<0.05 compared with the LEV low concentration group; ■P<0.05 compared with the LEV medium concentration group图3 LEV对各组大鼠脑组织神经元凋亡率的影响Fig 3 Effects of LEV on the apoptosis rate of neurons in brain tissue of rats in each
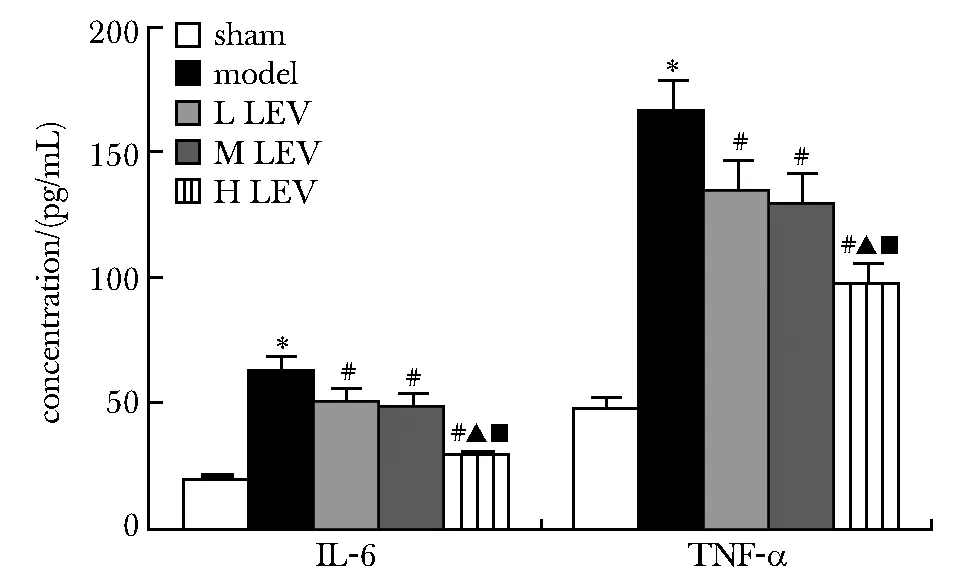
*P<0.05 compared with the sham group; #P<0.05 compared with the model group; ▲P<0.05 compared with the LEV low concentration group; ■P<0.05 compared with the LEV medium concentration group图4 LEV对各组大鼠血清中炎性因子IL-6、 TNF-α的影响Fig 4 Effects of LEV on inflammatory cytokines IL-6 and TNF-α in serum of rats in each group
2.4 LEV对各组大鼠血清中氧化应激因子MDA含量、SOD活性的影响
与sham组相比,model组大鼠血清中MDA含量显著升高(P<0.05),SOD活性显著降低(P<0.05);与model组相比,L、M、H LEV组血清中MDA含量显著降低(P<0.05),SOD活性显著升高(P<0.05);与L、M LEV组相比,H LEV组大鼠血清中MDA含量显著降低(P<0.05),SOD活性显著升高(P<0.05)(图5)。
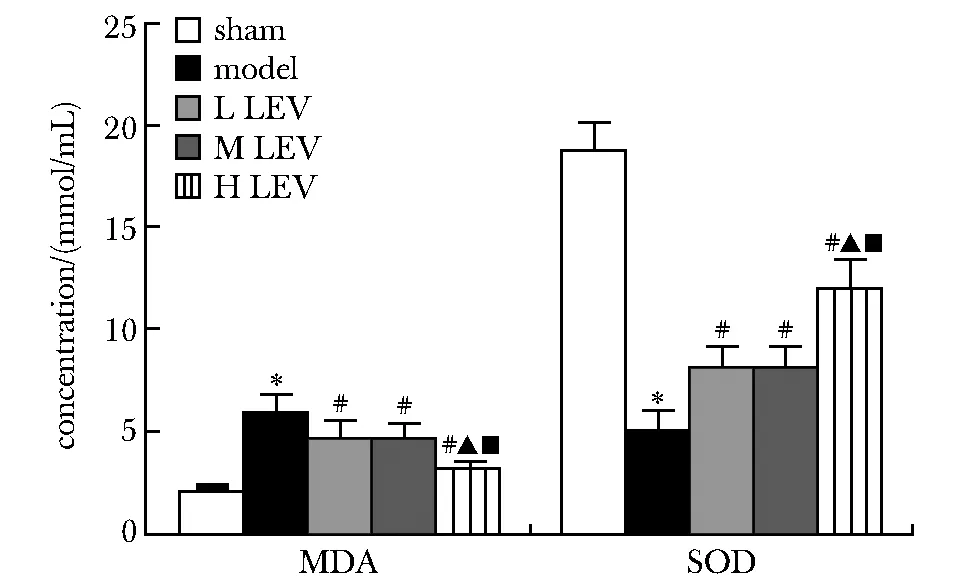
*P<0.05 compared with the sham group; #P<0.05 compared with the model group; ▲P<0.05 compared with the LEV low concentration group; ■P<0.05 compared with the LEV medium concentration group图5 LEV对各组大鼠血清中氧化应激因子MDA含量、 SOD活性的影响Fig 5 Effects of LEV on MDA and SOD expression in serum of rats in each n=10)
2.5 LEV对各组大鼠脑组织Caspase-3、Bcl-2蛋白表达的影响
与sham组相比,model组大鼠脑组织caspase-3蛋白表达显著升高(P<0.05),Bcl-2蛋白表达显著降低(P<0.05);与model组相比,L、M、H LEV组大鼠脑组织caspase-3蛋白表达显著降低(P<0.05),Bcl-2蛋白表达显著升高(P<0.05);与L、M LEV组相比,H LEV组大鼠脑组织caspase-3蛋白表达显著降低(P<0.05),Bcl-2蛋白表达显著升高(P<0.05)(图6)。
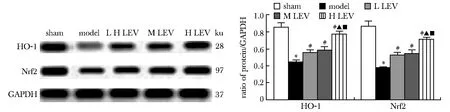
2.6 LEV对各组大鼠脑组织Nrf2、HO-1蛋白表达的影响
与sham组相比,model组大鼠脑组织Nrf2、HO-1蛋白表达显著降低(P<0.05);与model组相比,LEV低、中、高浓度组大鼠脑组织Nrf2、HO-1蛋白表达显著升高(P<0.05);与LEV低、中浓度组相比,高浓度组大鼠脑组织Nrf2、HO-1蛋白表达显著升高(P<0.05)(图7)。
3 讨论
HIE是引起新生儿脑损伤,导致其死亡的重要原因之一,脑部缺氧缺血性发作与胎龄、 代谢、 脑部感染、持续性脑损伤等多种因素有关[8],临床HIE患者出现不同程度脑水肿,神经细胞病变、脑组织坏死等病理变化[9]。本研究发现,与sham组相比,model组大鼠脑组织细胞排列紊乱呈弥漫性分布,细胞空泡增加,出现炎性浸润,与报道一致[7],提示HIBD新生大鼠model构建成功。HIE存活者常出现智力障碍、瘫痪、癫痫等神经系统性疾病后遗症,严重危害患者的生命健康和生活质量。LEV对新生儿缺氧缺血性脑病引起的癫痫发作有治疗作用[10]。本研究发现,经LEV治疗后,HIBD新生大鼠的病理症状明显减轻,提示LEV对HIBD症状有一定缓解作用。

*P<0.05 compared with the sham group; #P<0.05 compared with the model group; ▲P<0.05 compared with the LEV low concentration group; ■P<0.05 ompared with the LEV medium concentration group
*P<0.05 compared with the sham group; #P<0.05 compared with the model group; ▲P<0.05 compared with the LEV low concentration group; ■P<0.05 compared with the LEV medium concentration group
脑部局部缺血引起原发性损伤,由于细胞凋亡、炎性因子紊乱导致脑损伤,加剧脑病,IL-6、TNF-α是炎性反应中重要调控因子。LEV可以减轻HIBD新生大鼠体内炎性反应[11]。本研究发现,经LEV治疗后,大鼠血清IL-6、TNF-α水平显著降低,提示LEV可以抑制炎性反应因子IL-6、TNF-α分泌,减轻机体炎性反应。Caspase-3是促凋亡因子,Bcl-2是抑凋亡因子,共同调控细胞凋亡机制。LEV可以抑制脑缺血再灌注损伤后促凋亡蛋白表达,从而抑制神经细胞凋亡,发挥脑保护作用[12]。本研究发现,经LEV治疗后,大鼠脑组织神经元凋亡率、caspase-3蛋白表达显著降低,Bcl-2蛋白表达显著升高,提示LEV可以抑制Caspase-3蛋白表达、促进Bcl-2蛋白表达,抑制HIBD脑组织神经元细胞凋亡。
氧化应激是引起新生儿脑损伤的重要因素,细胞中促氧化剂和抗氧化剂之间比例不平衡造成氧化应激发生,MDA和SOD是评估氧化应激的生化标志物。在小儿癫痫痰火扰神证中LEV可抑制MDA含量,促进SOD活性[13]。本研究发现,经LEV治疗后,大鼠血清MDA含量显著降低,SOD活性显著升高,提示LEV可以调控MDA、SOD蛋白表达,减轻HIBD新生大鼠体内氧化应激反应。Nrf2是机体抗氧化保护机制中重要的转录因子,可以编码抗氧化剂酶HO-1,不仅可以防止氧化损伤,调节细胞凋亡,还调节炎性以及促进血管生成[14]。研究显示,LEV可以通过调控Nrf2-ARE通路,使HO-1蛋白表达增多,起到抗癫痫的作用[15]。本研究进一步发现,经LEV治疗后,大鼠脑组织Nrf2、HO-1蛋白表达显著升高,提示LEV可通过降低MDA含量,升高SOD活性,发挥抗氧化作用可能与Nrf2-ARE通路激活有关。
综上所述,LEV可抑制脑细胞凋亡,减轻HIBD新生大鼠体内炎性反应和氧化应激反应,发挥神经保护作用,可能与Nrf2-ARE通路激活有关,但其具体作用机制需进一步研究。

