钙离子对灌浆期藜麦淀粉及其合成酶活性的影响
唐 媛, 刘恩泽, 余海萍, 董 雨, 邬晓勇
(成都大学 农业农村部杂粮加工重点实验室,四川 成都 60106)
藜麦(Chenopodiumquinoawilld.)是苋科(Amaranthaceae) 藜属(Chenopodium) 一年生双子叶植物,起源于南美洲安第斯地区,已有5 000~7 000 a的种植历史,是当地居民的主要食物之一,被称为“粮食之母”[1—3].钙是植物生长发育所必需的营养元素之一,占植物干物质质量的0.1%~5%[4].植物中大部分钙离子主要分布于茎、叶部位,植物老叶中的钙含量高于嫩叶中的,而根和果实中分布较少[5].植物在生长的过程中基本均受到钙离子的调节,钙离子参与细胞分裂到植物开花结实的整个生命进程[6].土壤中的钙含量对植物生长发育有重要影响.一般,土壤表土层的平均含钙量达1.37%,土壤溶液中钙浓度为10~20 mol/L时,能够满足大部分作物的生理需求[7].不同地区土壤的含钙量差异明显.在我国长江以南地区,由于气候高温多雨,钙的淋溶强烈,除石灰岩地区外,土壤常常呈酸性,容易缺钙[8].土壤缺钙时,植物的茎细易倒伏,穗小粒不饱,空壳多,产量低,品质差,如水稻、花生等[9].但在高钙土壤地区(如喀斯特地区),土壤中的钙含量过高也会影响植物的形态和生理特性[10—11].植物细胞对土壤中钙离子的吸收能力与土壤中钙离子的含量成正比,但在高Ca2+条件下,植物的种子和花粉萌发受抑制,从而导致生长发育受阻碍[12].因此,在农业生产中,可根据植物的钙需求与土壤钙养分的相关性,合理施加适量钙肥,使农作物和果蔬更好生长[13].钙含量过高或过低均对植物生长发育不利.我国缺钙土壤主要为南方的酸性红土壤和交换量较低的砂质土壤,包括西南地区的广西、云南、四川西南部和贵州局部等.文献显示,在上述地区种植的藜麦籽粒偏小.笔者推测,土壤中的钙含量对藜麦灌浆发育影响较大.该实验研究钙离子对灌浆期藜麦籽粒淀粉合成的影响,这对推广藜麦种植、指导藜麦耕作和栽培具有实际意义.
1 实验
1.1 材料
该实验以陇藜-3(LL-3)和黑藜-1(H-1)为研究对象,种子由成都大学农业农村部杂粮加工重点实验室提供.种植基质为体积比为1∶1∶1的珍珠岩、蛭石和河沙的混合物.将藜麦种子均匀播撒于塑料花盆中,每盆浇等量的超纯水,再用1~2 cm的混合基质覆盖.然后将盆栽置于实验室人工气候培养箱中进行培养(光照、黑暗的时间分别为8, 16 h;昼夜的温度分别为22,20 ℃,湿度为70%).当苗长出第4,8片真叶时进行间苗,每盆选3株.
2种藜麦均分为3组:对照组,通过Hoagland全营养液进行根部浇灌处理;高钙处理组,通过Hoagland全营养液与10 mmol/L的硝酸钙溶液的混合溶液进行根部浇灌处理;低钙处理组,通过缺钙的Hoagland全营养液与5 mmol/L的EGTA溶液(钙离子螯合剂)、1 mmol/L氯化镧溶液(钙离子通道抑制剂)以及20 μmol/L氯丙嗪溶液(CaM拮抗剂)进行藜麦根部浇灌处理.每隔3 d每盆浇灌200 mL营养液直至收获.待花后10 d开始每隔10 d取样测定淀粉含量及其合成相关酶的活性(测3次).取主穗中下部籽粒为实验材料(3次重复),一部分籽粒,于105 ℃杀青20 min,70 ℃烘至恒重,磨粉,用于测定淀粉的含量;另一部分籽粒,经液氮速冻后放置-80 ℃冰箱中,用于测定淀粉合成关键酶的活性.
1.2 仪器与试剂
RXM智能人工气候箱(宁波市科技园区新江南仪器有限公司);分析天平(美国OHAUS公司);UPH-I-10T超纯水机(西安优普仪器设备有限公司);DGG-9246A电热恒温鼓风干燥箱(上海齐欣科学仪器有限公司);H1850R高速冷冻离心机(湖南湘仪有限公司);IMS-70全自动雪花制冰机(常熟市雪科电器有限公司);涡旋混合器(德国IKA公司);HH-6数显恒温水浴锅(常州澳华仪器有限公司);酶标仪(美国Biotek公司).
硝酸钙、乙二醇-双-(2-氨基乙醚)四乙酸(EGTA)、氯化镧、氯丙嗪、考马斯亮蓝G250、牛血清蛋白、乙醚均为分析纯,购自成都科隆化学品有限公司.直链淀粉含量的测定、支链淀粉含量的测定、蔗糖合成酶(sucrose synthase,SS)活性的测定、可溶性淀粉合成酶(soluble starch synthase,SSS)活性的测定、结合态淀粉合成酶(granule binding starch synthase,GBSS)活性的测定、淀粉分支酶(starch branching enzyme,SBE)活性的测定试剂盒均购自北京索莱宝科技有限公司.
1.3 淀粉及其合成关键酶的测定
直链淀粉的含量、支链淀粉的含量、SS的活性、SSS的活性、GBSS的活性、SBE的活性均通过试剂盒进行测定.总淀粉的含量等于直链淀粉的含量与支链淀粉的含量之和.通过考马斯亮蓝G-250染色法测定蛋白质的含量[14],所有指标均测定3次.
1.4 数据处理与分析
通过Excel 2013、SPSS 21.0进行数据分析;通过Origin 9.0进行数据分析与绘图.
2 结果与分析
2.1 钙离子对藜麦籽粒中直链淀粉含量的影响
通过直链淀粉含量检测试剂盒方法,采用双波长(550,485 nm)法测定直链淀粉的含量,结果如图1所示.对于LL-3,正常组、高钙处理组籽粒中的直链淀粉含量,在灌浆前中期快速积累,在花后20~30 d趋于稳定,而低钙处理组的直链淀粉含量在灌浆中期后呈降低趋势,其中,高钙处理组的直链淀粉峰值最高,低钙处理组的峰值最低.与正常组相比,在高钙处理下,花后30 d的直链淀粉含量增加37.22%,而低钙处理下花后30 d的直链淀粉含量减少42.70%.高钙处理组、低钙处理组与对照组间都达到差异显著水平.对于H-1,3个处理组的直链淀粉含量均呈现先增加后降低的趋势,直链淀粉在灌浆前中期快速积累.与对照组相比,高钙处理下的在花后30 d时直链淀粉的含量增加3.41%,而低钙处理下的在花后30 d时直链淀粉的含量减少26.60%.低钙处理组与对照组之间达差异显著水平.
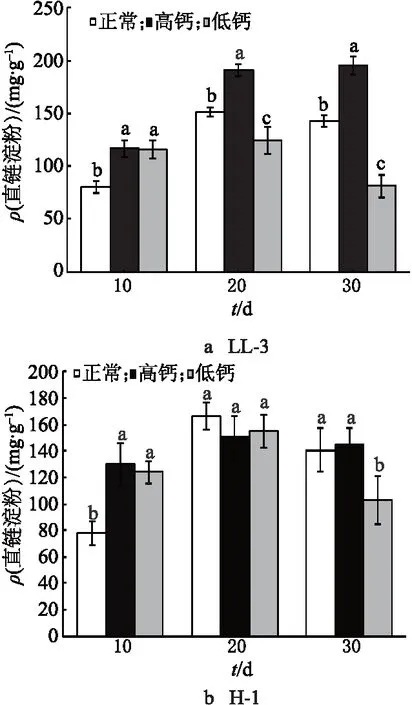
注:图中不同小写字母表示处理间的差异显著性(P<0.05),图2~7中的含义相同.
2.2 钙离子对藜麦籽粒中支链淀粉含量的影响
参考支链淀粉试剂盒方法,通过双波长(530,755 nm)法测定支链淀粉的含量.以支链淀粉标准溶液的质量浓度(mg/mL)为x轴,以标准溶液对应的光密度变化(ΔD)为y轴,建立标准曲线,得到支链淀粉的标准方程y=0.271 1x+0.001 2,R2=0.999.支链淀粉含量的测定结果如图2所示.对于LL-3,3个处理组的支链淀粉含量在灌浆前期迅速增加,10 d后均呈逐渐下降趋势.支链淀粉含量呈降低趋势可能是由于籽粒中其他组分积累的影响.与对照组相比,高钙处理下的在花后30 d时支链淀粉含量增加30.03%,而低钙处理下的在花后30 d时支链淀粉含量减少1.34%,其中,高钙处理组与正常组之间达差异显著水平.对于H-1,3个处理组的支链淀粉含量均呈现先增加后降低的趋势,在花后20 d达到最高值,与LL-3相比,峰值明显延后,3个处理间峰值均未达差异显著水平.与对照组相比,高钙处理下的在花后30 d时支链淀粉的含量增加3.44%,而低钙处理下的在花后30 d时支链淀粉的含量减少26.88%,其中,低钙处理组与对照组之间达差异显著水平.
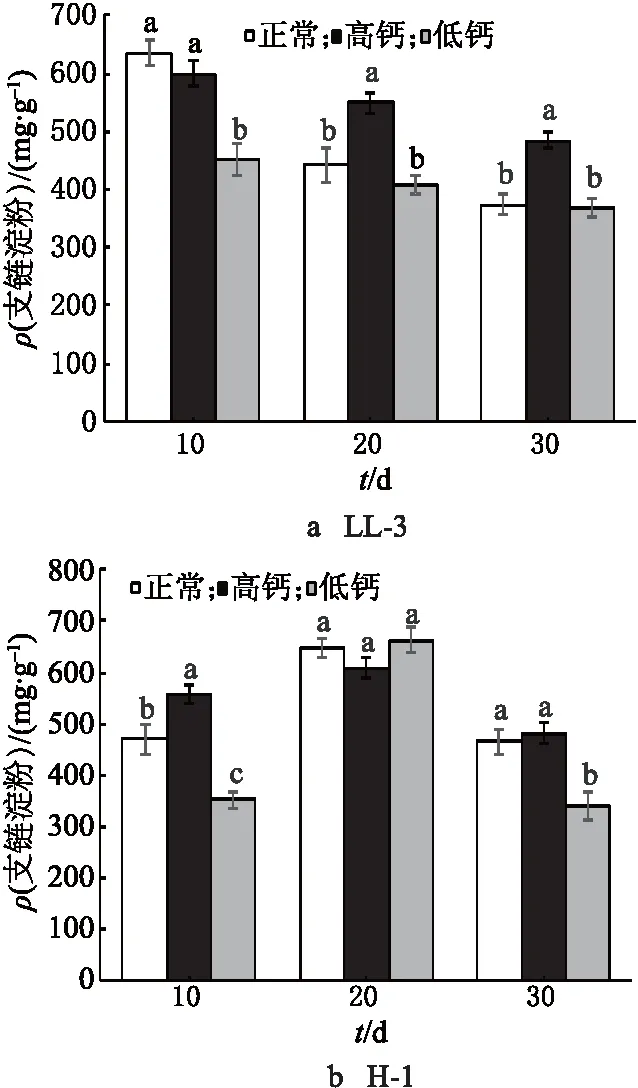
图2 钙离子对藜麦籽粒中支链淀粉含量的影响
2.3 钙离子对藜麦籽粒中总淀粉含量的影响
在3种处理下,LL-3中的总淀粉含量均在灌浆前期快速积累,中后期趋于稳定(图3).LL-3籽粒中总淀粉的含量由大到小为高钙处理组、对照组、低钙处理组.与对照组相比,高钙处理下的在花后30 d时淀粉含量增加32.01%,而低钙处理下的在花后30 d时淀粉含量减少12.77%,其中,高钙处理组与对照组之间达差异显著水平.在3种处理下,H-1中总淀粉含量均呈先增加后降低的趋势.H-1籽粒中总淀粉含量由大到小为高钙处理组、对照组、低钙处理组.与对照组相比,高钙处理下的在花后30 d时淀粉含量增加3.43%,而低钙处理下的在花后30 d时淀粉含量减少26.82%.低钙处理组与对照组之间达差异显著水平.
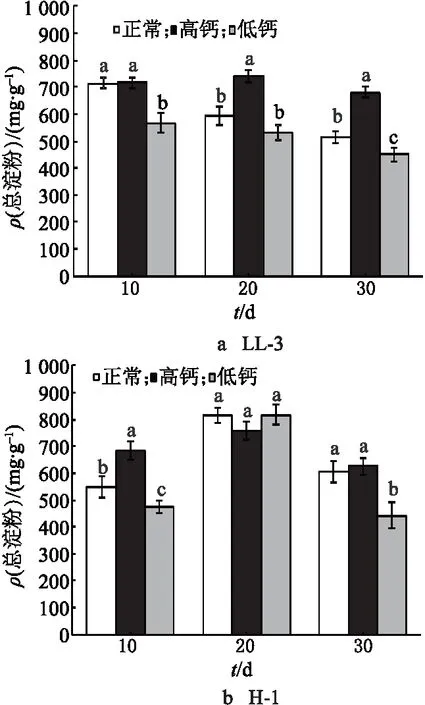
图3 钙离子对藜麦籽粒中总淀粉含量的影响
由此可见,适量钙离子对植物叶片等同化器官中α-淀粉酶等起活化作用,可促进光合产物的运输与转化,从而影响植物中淀粉和蛋白质的合成[15].
2.4 钙离子对藜麦籽粒中蔗糖合成酶(SS)活性的影响
2种藜麦的SS活性明显不同(图4).对于LL-3,高钙处理下和对照处理下的籽粒SS活性呈现先增后降的单峰型变化规律,花后前10 d酶活性快速增加,10~20 d时增长速度变缓,在花后20 d达到峰值.低钙处理组的SS活性峰提前,在花后10 d达到峰值,达到峰值后呈现降低的趋势.由图4可知,平均酶的活性由大到小为高钙处理组、对照组、低钙处理组.对于H-1,对照组、高钙处理组的SS活性呈增长趋势,对照组的增长速率缓慢,高钙处理组的在灌浆中后期趋于稳定.高钙处理组、低钙处理组与对照组相比,酶活性增长速率较快.低钙处理组的SS活性呈现先增加后降低的单峰型变化规律,且峰值提前,并在花后20 d达到峰值.
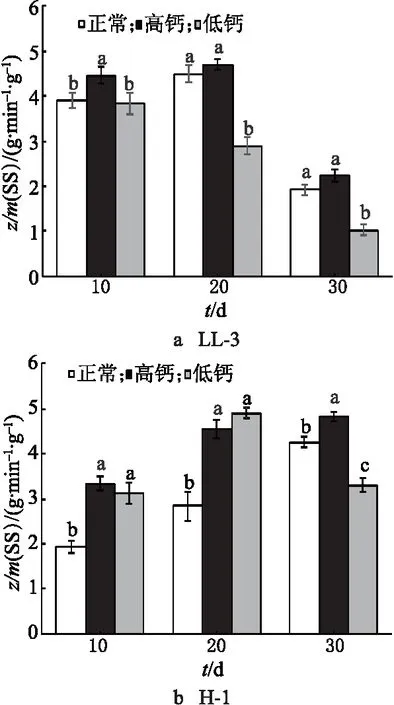
图4 钙离子对藜麦籽粒中SS活性的影响
2.5 钙离子对藜麦籽粒中可溶性淀粉合成酶(SSS)活性的影响
对于LL-3,对照组和高钙处理组的SSS活性均呈现先增加后降低的趋势,在花后20 d达到峰值,而低钙处理组的峰值提前,在花后前10 d酶的活性快速增加至峰值,达到峰值后酶的活性迅速降低.H-1中的SSS活性与LL-3中的变化一致(图5).这可能是由于藜麦在初受低钙处理时有自我调节的应激反应.随着灌浆时间的延长、胁迫程度的加剧,当超过了藜麦自体调节的范围,低钙处理下的 SSS 活性开始迅速降低,并显著低于对照组中的.
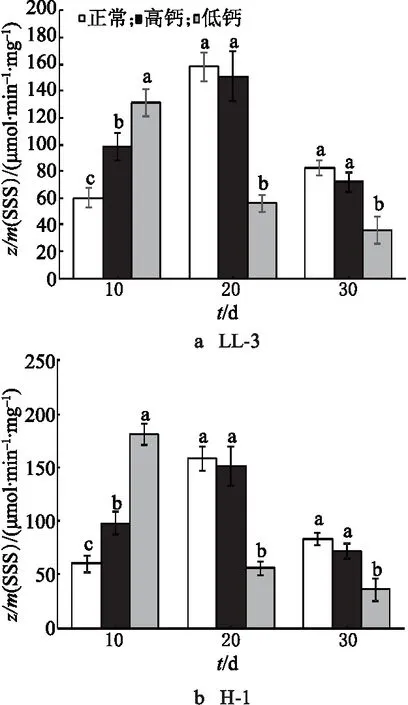
图5 钙离子对藜麦籽粒中SSS活性的影响
2.6 钙离子对藜麦籽粒中结合态淀粉合成酶(GBSS)活性的影响
LL-3在3个处理下的GBSS活性呈现先增加后降低的趋势(图6).对照组的GBSS活性在花后前10 d快速增加,在花后10~20 d趋于稳定后又快速降低.在灌浆前中期,高钙处理组、低钙处理组的GBSS活性持续增加,并在花后20 d达到峰值. 高钙处理组中的GBSS活性大于低钙处理组中的.对于H-1,GBSS活性,在对照组呈现先增加后降低的趋势,在花后20 d达到峰值;而高钙处理组、低钙处理组的在花后前10 d快速增加,且峰值提前,在花后10 d达到峰值.高钙处理组的GBSS活性达到峰值后,GBSS活性降低的速率与低钙处理组相比较慢.

图6 钙离子对藜麦籽粒中GBSS活性的影响
2.7 钙离子对藜麦籽粒中淀粉分支酶(SBE)活性的影响
对于LL-3,各组处理下的SBE活性均呈现先增加后降低的趋势(图7),并在花后20 d达到峰值,低钙处理组、高钙处理组与对照组相比,SBE活性达到峰值后降低的速率减慢.对于H-1,SBE活性均呈先增加后降低的单峰曲线变化,并在花后20 d达到峰值.对照组在花后前10 d的SBE活性迅速增加,在花后10~20 d时增长速度变缓.高钙处理组、低钙处理组,在花后前10 d的SBE活性均处于较低水平.高钙处理组的SBE活性在花后10~20 d快速增加达到峰值,然后缓慢降低,而低钙处理组的SBE活性在花后10~20 d迅速增加后又迅速降低.
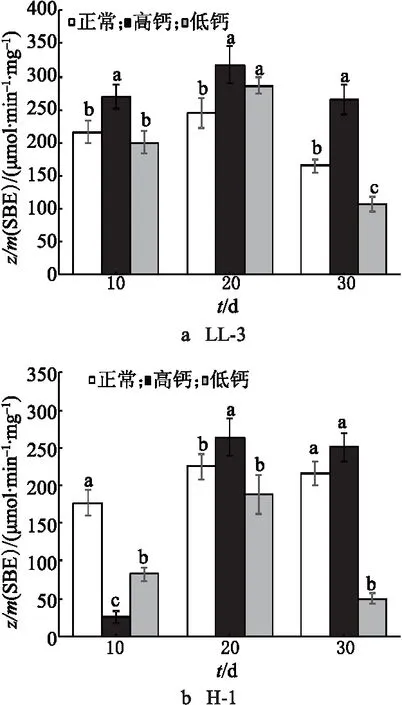
图7 钙离子对藜麦籽粒中SBE活性的影响
2.8 藜麦籽粒中淀粉合成关键酶活性与淀粉含量的相关性分析
LL-3,H-1在不同灌浆时期的淀粉含量与淀粉形成关键酶的相关系数见表1~2.由表1可知,LL-3在灌浆前期,总淀粉含量与支链淀粉含量呈极显著正相关;在灌浆中后期,总淀粉含量与支链淀粉、直链淀粉含量均呈极显著正相关.在灌浆前期,直链淀粉含量只与GBSS活性呈极显著正相关关系,而支链淀粉含量与SSS活性呈显著正相关,与GBSS活性呈极显著正相关.在灌浆前中期,GBSS活性与淀粉含量呈极显著正相关,在灌浆后期的相关性不明显.灌浆中期的总淀粉含量与SBE呈显著正相关,与直链、支链淀粉含量以及其他酶活性呈极显著正相关;直链淀粉含量除与SBE活性外,与其他酶活性均呈极显著正相关;支链淀粉含量与SBE活性呈显著正相关,与其他酶活性呈极显著正相关.灌浆后期的淀粉含量与SS,SSS,SBE活性均呈极显著正相关,与GBSS活性无显著相关性.
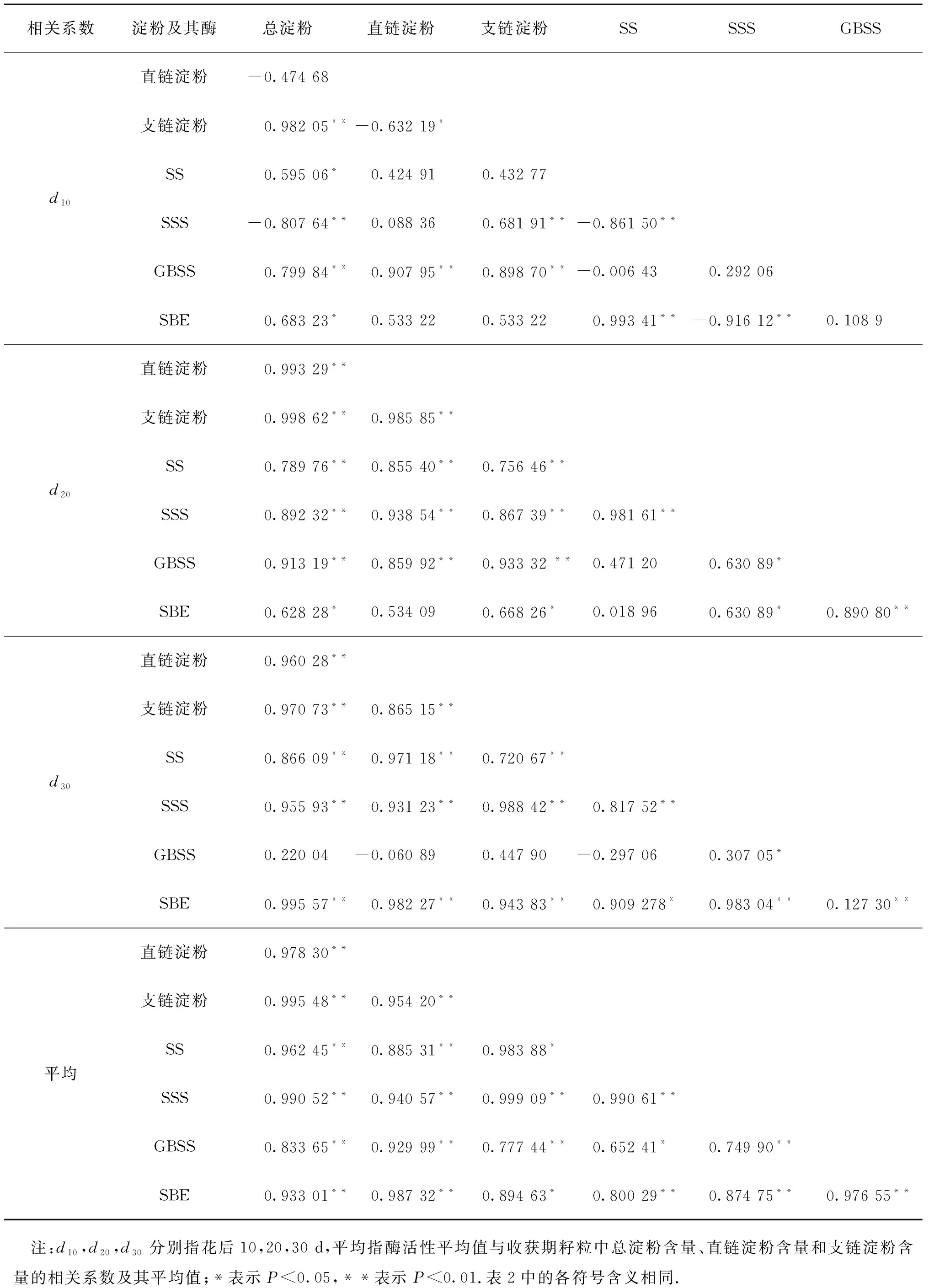
表1 灌浆期LL-3中各参数的相关系数
由表2可知,在灌浆期,H-1中的总淀粉含量与直链淀粉、支链淀粉含量均呈极显著正相关.灌浆前期的支链淀粉含量与SSS活性呈显著相关.在灌浆中期,总淀粉和直链淀粉含量除与SS活性外,与其他酶活性均呈极显著正相关;支链淀粉含量与SSS,SBE活性呈极显著正相关.在灌浆后期,淀粉含量与SS,GBSS活性呈极显著正相关,与SSS,SBE活性呈显著正相关;直链淀粉含量与SS,GBSS活性呈极显著正相关;支链淀粉含量与SS,GBSS活性呈极显著正相关,与SSS活性呈显著正相关.灌浆中前期的酶活性与总淀粉含量相关性不显著,说明灌浆前期的酶活性对藜麦籽粒中淀粉积累的调节作用不明显,随着灌浆时间的增加,总淀粉、支链淀粉、直链淀粉含量与淀粉合成相关酶之间的相关性增强.
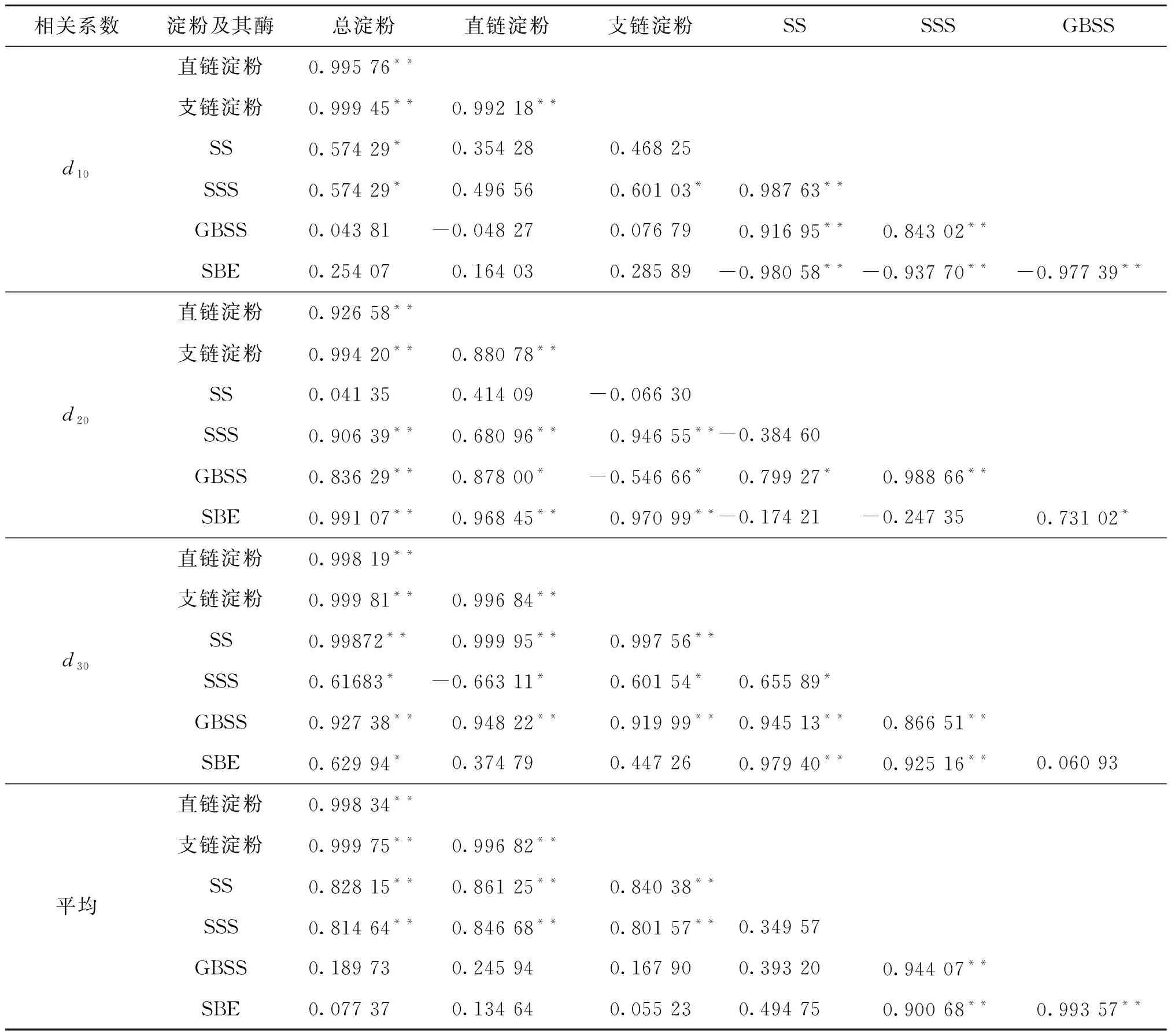
表2 灌浆期H-1中各参数的相关系数
3 讨论与总结
藜麦籽粒中淀粉的形成由一系列复杂的酶反应体系控制.关于藜麦中钙元素的研究,目前停留在藜麦品种间籽粒钙含量的差异,有关钙离子对藜麦灌浆期淀粉的合成影响较少.钙是植物生长发育必需的营养元素,钙离子参与胞内系统的稳定和生长发育的调节,在细胞内起第二信使作用[16].作为第二信使,钙离子对环境信号和内源激素信号等均具有灵敏反应,能引起细胞内钙离子含量的改变.然后与钙调蛋白(calmodulin,CaM)结合,通过下游功能蛋白如钙依赖蛋白激酶(calcium-dependent protein kinase,CDPK)、胞外信号调节激酶(mitogen-activated protein kinase,MAPK)等对信号进行放大,并将信号传递至细胞核,作用于相关基因的表达,从而引起相应生理效应的改变[17—18].目前,有关水稻、马铃薯等作物中钙离子与淀粉合成的研究较多[19—20].丁洪瑾等的研究表明[21—23],对马铃薯进行适量施钙处理,可降低块茎中淀粉酶的活性,使其分解淀粉的能力减弱,且收获期块茎中的淀粉含量、蛋白质含量及VC含量均提高,从而大大改善了马铃薯块茎的品质.
1)高钙处理可显著增加藜麦粒籽中淀粉合成相关酶的活性.在高钙溶液处理下,作物的开花数显著增加,因此高钙处理可提高作物的产量[24].在低钙营养液中添加EGTA、氯化镧及盐酸氯丙嗪溶液后,作物体内的钙离子被专一性的螯合,氯化镧拮抗钙离子,而盐酸氯丙嗪溶液作为钙离子通道抑制剂.在这3种试剂的作用下,作物体内的钙离子极度亏缺,从而产生了缺钙的症状.文献显示,小麦干物质累积量随EGTA溶液浓度的增大而显著降低.同时,EGTA的存在又影响植株对氮元素的吸收,影响氨基向蛋白质的转化,因此,蛋白质含量明显下降[25],从而影响了作物的产量.
2)高钙处理可显著延长藜麦的灌浆时间,而低钙处理则降低.在高钙溶液处理下,其平均酶活性与对照组相比有明显提高,大大促进了淀粉合成;在低钙溶液处理下,淀粉合成相关酶峰值出现时间有不同程度的提前或无明显变化,因此缩短了籽粒的灌浆时间,从而造成减产,这与文献报道基本一致:若植物在养分充足的立地条件下生长得好,外源养分的添加能够提高植物的生产力或品质.适量钙的加入能促进植物对营养元素(Mg,Fe等)的吸收,增加叶片RuBP-case活性和羧化效率,进而增强叶片的光合效率[26—28].另外,钙离子还通过钙调蛋白(CaM)调节植物叶片等同化器官中的淀粉酶和ATP酶等关键酶活性,进而影响植物淀粉和蛋白质等的合成[29].
3)由淀粉合成酶及淀粉含量变化可知,2种藜麦材料在相同钙离子影响下表现不同,对钙元素的需求量也不同.LL-3源于甘肃,而H-1虽不是认定品种,但在实际栽培中发现,H-1籽粒中的淀粉含量及籽粒的千粒重较LL-3高,这可能是2种藜麦存在明显种质差异的原因.
综上所述,在藜麦栽培实践中,应根据不同藜麦对钙元素需求的不同,在不同生育期进行适量的钙肥添加,这样有助于藜麦淀粉的合成,从而提高藜麦籽粒的品质以及产量.由藜麦中的淀粉含量及淀粉合成关键酶活性的相关性分析可知,钙离子含量可影响2种藜麦在灌浆期的淀粉含量与淀粉合成关键酶的活性,而淀粉合成关键酶的活性与淀粉含量有极显著的相关性.因此,钙离子含量对2种藜麦籽粒淀粉积累具有重要的调节作用.这也可能是钙离子通过一系列的信号传递影响藜麦籽粒中淀粉合成时相关酶基因的表达,具体原因有待进一步研究.

