发作性意识模糊,心悸10年余
陈国榕,阳洪波,罗亚平,吴文铭,孟芝兰,李海龙,张 遥,吴 东,吴 晰,杨爱明
中国医学科学院 北京协和医学院 北京协和医院 1消化内科 2内分泌科 3核医学科 4基本外科 5病理科 6临床营养科 7神经科 8疑难重症及罕见病国家重点实验室,北京 100730
1 病例简介
患者男性,70岁,因“发作性意识模糊、心悸10年余”于2018年1月24日收住北京协和医院消化内科。
1.1 现病史
2008年夏,患者饥饿时突发反应迟钝,伴心悸、大汗、乏力、视物模糊,无意识丧失、抽搐、大小便失禁,进食后上述症状缓解。一年后,患者晨起出现胡言乱语、不能正确对答,进食后神志转清。此后间断出现上述症状,约1~2个月发作1次,多于空腹时出现,进食后缓解。2011年9月1日,患者因晨起意识模糊于外院就诊,测血压225/114 mm Hg(1 mm Hg=0.133 kPa);肌酐(creatinine,Cr)77.1 μmol/L,血糖2.5 mmol/L,胰岛素(insulin, INS)19.26 μIU/mL(参考范围:5~15 μIU/mL),C-肽3.98 ng/mL(参考范围:0.77~1.23 ng/mL);饥饿试验(﹢),见表1。

表 1 患者饥饿试验结果
未明确反复低血糖病因,予降压、饮食等对症治疗后仍间断复发,发作时血糖波动范围为2.1~2.7 mmol/L。2013年8月起发作频率增至每1~2周1次。2013年9月收住北京协和医院内分泌科,入院后查肝功能正常,Cr 131 μmol/L,尿酸426 μmol/L;口服葡萄糖耐量试验(oral glucose tolerance test,OGTT)见表2;同步测定血糖1.9 mmol/L,INS 11.76 μIU/mL,C-肽3.4 ng/mL。1型糖尿病自身抗体:包括抗胰岛细胞抗体、抗胰岛素抗体、抗酪氨酸磷酸酶抗体均(-)。多发性内分泌腺瘤病(multiple endocrine neoplasia,MEN)筛查:胰岛素样生长因子1232 ng/mL;促肾上腺皮质激素32.8 pg/mL;促卵泡激素22.28 μg/dL。甲状腺功能:血清游离三碘甲腺原氨酸3.26 pg/mL,血清游离甲状腺素1.091 ng/dL,促甲状腺激素1.519 μIU/mL。甲状旁腺素61.2 pg/mL,降钙素23.09 pg/mL。肿瘤指标:甲胎蛋白、癌胚抗原、糖类抗原19-9、糖类抗原242、糖类抗原72-4未见明显异常。生长抑素受体显像未见异常。超声内镜(endos-copic ultrasonography,EUS)显示:胰腺实质多发点片状强回声,胰头部胰管轻度扩张,未见明确占位。胰腺增强CT+灌注显示:胰尾部饱满,未见异常灌注灶。基本外科会诊考虑“内源性高胰岛素血症所致低血糖症”定性诊断基本明确,但胰岛素瘤定位诊断不明,暂无法手术。嘱患者调整加餐时间,密切随访。
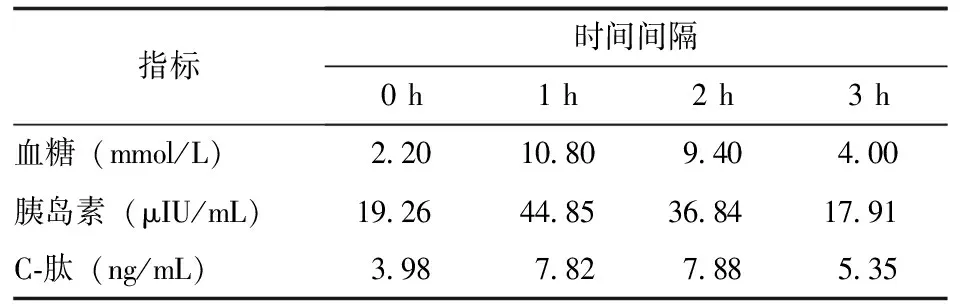
表 2 患者口服葡萄糖耐量试验结果
患者出院后每天23∶00~24∶00加餐,低血糖发作频率减少,体重较之前逐渐增加。2016年11月,患者再次收住北京协和医院内分泌科,查糖化血红蛋白为5.0%。血糖2.2 mmol/L时,同步测定INS 14.52 μIU/mL,C-肽 4.57 ng/mL。复查生长抑素受体显像未见明显异常。68Ga-exendin-4 PET/CT显示:胰体尾交界处可见一放射性摄取异常增高结节,大小约1.1 cm×1.3 cm,符合胰高血糖素样肽-1受体(glucagon-like peptide-1 receptor,GLP-1R)过度表达,其余胰腺组织可见弥漫性放射性摄取,考虑胰岛素瘤(图1)。EUS显示:胰体尾交界处片状低回声病变,边缘不规则,边界欠清晰,大小约2.0 cm×1.1 cm,考虑胰岛素瘤可能性大。北京协和医院胰腺疑难病会诊中心集体会诊后,认为胰岛素瘤诊断成立,考虑患者存在高龄、慢性肾脏病(chronic kidney disease,CKD),外科手术风险较高,结合68Ga-exendin-4 PET/CT及EUS结果,建议首选EUS引导下无水乙醇注射治疗。2017年3月13日,EUS显示胰体尾交界处可见一类圆形实性团块,呈中等偏低回声,边界清楚,大小约2.0 cm×1.3 cm,内部回声均匀(图2),EUS引导下行22 G穿刺针穿刺病变组织,向病灶内注入1.5 mL无水乙醇,过程顺利。超声内镜引导下细针穿刺细胞学检查(endoscopic ultrasound-guided fine-needle aspiration biopsy, EUS-FNA)发现肿瘤细胞,形态符合神经内分泌肿瘤(图3)。

图 3 患者超声内镜引导下细针穿刺细胞学检查可见肿瘤细胞,形态符合神经内分泌肿瘤

图 2 患者超声内镜下胰岛素瘤表现
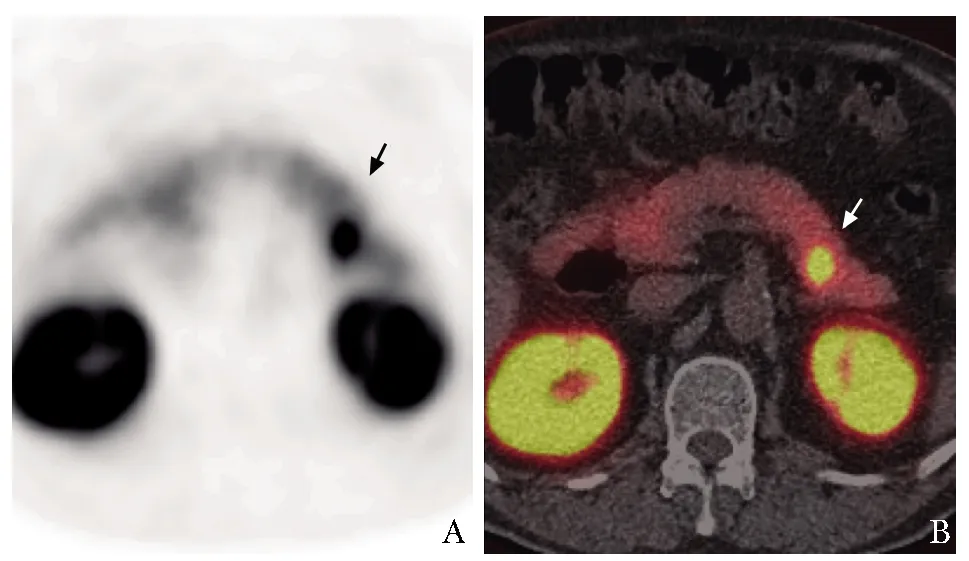
图 1 2016年11月,患者68Ga-exendin-4 PET/CT显像示胰体尾交界处可见一放射性摄取异常增高结节(箭头)
患者出院后于门诊规律随诊,低血糖症基本消失。2017年4月25日,同步测定血糖3.1 mmol/L,INS 14.89 μIU/mL,C-肽4.55 ng/mL。2017年10月,患者低血糖症复发。2017年11月16日行第2次EUS引导下肿瘤内注射治疗,镜下可见胰体尾交界处一类圆形实性团块,呈中等偏低回声,边界清楚,大小约1.5 cm×1.1 cm,内部回声均匀,EUS引导下向病灶内注入无水乙醇2.0 mL,术后症状缓解,空腹血糖4 mmol/L左右。出院后继续饮食治疗,每月仍有2~3 次低血糖症发作,体重较前无明显改变。为进一步评估病情、再次行无水乙醇注射治疗,患者于2018年1月24日收住北京协和医院消化内科。
1.2 既往史、个人史、家族史
否认降糖药物应用史,否认含巯基类药物应用史;30余年前曾诊断为支气管哮喘,否认糖皮质激素应用史;高血压20余年,最高血压达225/114 mm Hg,近3个月服用控释硝苯地平,未规律监测血压;高脂血症7年余,口服阿托伐他汀降脂治疗;2008年起反复心悸,2011年9月诊断为“室上性心动过速”,2012年5月于外院行射频消融治疗;2011年头颅CT示颅内多发缺血梗死灶、脑萎缩,未行治疗;CKD 4期,目前采取非透析治疗;2016年6月因外伤行左侧髂骨骨折复位+钢板内固定术。长期大量吸烟、饮酒。家族史无特殊。
1.3 入院查体
体温36.7 ℃,脉搏84次/min,呼吸20次/min,血压162/84 mm Hg,SpO298%。腰围102 cm,体质量指数27.4 kg/m2,躯干部可见多发色素沉着。双肺呼吸音清,未闻及明显干、湿啰音。心律齐,各瓣膜听诊区无杂音。腹稍膨隆;腹软,无压痛、反跳痛、肌紧张,未触及包块,肝、脾肋下未触及;腹部叩诊鼓音,移动性浊音(-)。下肢轻度凹陷性水肿。
1.4 实验室检查
(1)血常规:红细胞2.17×1012/L,血红蛋白(hemoglobin,Hb)72 g/L,红细胞压积 22.0%,平均红细胞体积101.3 fl,白细胞 6.96×109/L,血小板 269×109/L。
(2)血液生化:谷丙转氨酶24 U/L,Cr 394 μmol/L,血尿素氮 21.34 mmol/L。
(3)糖代谢:糖化血红蛋白4.4%;血糖1.3 mmol/L,同步测定INS 10.11 μIU/mL、C-肽 5.62 ng/mL。
1.5 影像学检查
68Ga-exendin-4 PET/CT:胰体尾交界处可见一放射性摄取异常增高结节,大小约1.3 cm×1.5 cm,平均标准摄取值(standard uptake value,SUV)为6.9,最大SUV为10.7;其余胰腺组织可见弥漫性放射性摄取。与2016年11月28日的PET/CT结果相比,胰体尾交界处胰岛素瘤病灶未发生明显变化,放射性摄取较之前减少,考虑病灶部分缓解。
2 多学科讨论
2.1 内分泌科
患者老年男性,病程10年余,具有典型的Whipple三联征症状,表现为反复发作的低血糖症、发作时血糖低于2.8 mmol/L、进食或补充葡萄糖后症状缓解。于患者低血糖发作时多次同步检测INS>3 μIU/mL,C-肽>0.6 ng/mL,支持内源性高胰岛素血症所致低血糖症[1]。定位诊断方面,68Ga-exendin-4 PET/CT显像及EUS-FNA病理证实存在胰腺神经内分泌肿瘤(pancreatic neuroendocrine neoplasms,pNENs)。胰岛素瘤可能为多发性内分泌腺瘤病-1型(multiple endocrine neoplasia-1,MEN-1)的组成之一,但患者无MEN-1家族史,起病年龄大,已多次筛查相关激素指标及影像学检查,目前无 MEN-1的充足证据。
2.2 核医学科
2013年,患者首次就诊于北京协和医院时,腹部超声、CT及EUS等均未能定位病灶。胰岛素瘤主要由胰腺β细胞构成,具有高表达GLP-1R的特点。基于此原理,以胰腺β细胞为靶点的GLP-1R显像(68Ga-exendin-4 PET/CT)技术被用于胰岛素瘤的定位诊断。北京协和医院自2014年开展此项技术,其诊断灵敏度达95%以上,特异度达100%,极大提高了隐匿性胰岛素瘤的检出率[2]。2016年,患者首次被检出病灶,显示胰体尾交界处GLP-1R高表达,从而明确了肿瘤位置,为治疗提供了准确的定位诊断。
2.3 消化内科
患者首次行EUS检查未见病灶,随着病情进展于胰体尾交界处发现病变,且与核医学检查相符。2006年,国外报道了第1例存在严重合并症的78岁胰岛素瘤患者在EUS引导下接受无水乙醇注射治疗,疗效明确,且随访34个月无复发[3],此后该技术逐渐得以推广应用。但与手术相比,内镜治疗不能完全清除肿瘤组织,且存在注射性胰腺炎等并发症的发生风险,因此需严格把握指征。该患者基础疾病较多,手术、药物及核素等治疗方式均不适合,若再次复发,仍建议内镜治疗。除无水乙醇注射治疗外,超声内镜引导下射频消融(endoscopic ultrasound-guided radiofrequency ablation,EUS-RFA)治疗胰岛素瘤亦有成功的病例报道,必要时可考虑[4]。
2.4 神经科
该患者主要临床表现为意识模糊、谵妄,定位于广泛的大脑皮层。症状发生时血糖显著降低,且症状随血糖水平的改变呈现明显的波动性,符合低血糖相关急性代谢性脑病的表现。低血糖相关的神经系统损害如不及时治疗,将对神经元产生不可逆性损伤,可引起脑部永久性的结构损害;脑部对低血糖感知能力下降,更易发生低血糖昏迷。此外,患者有高血压病史,既往血压控制不佳,需警惕高血压引起的颅内病变,如脑出血、高血压脑病、短暂性脑缺血发作等,但通常有其他神经系统定位表现,进食后症状不能迅速缓解,故不考虑。
2.5 基本外科
此患者病灶单发,肿瘤直径约2 cm,位于胰体尾部,但无法得知肿瘤与主胰管之间的位置关系以及脾脏血供情况,需术中探查。胰岛素瘤可选择肿瘤摘除术、胰体尾切除术、保留十二指肠的胰头切除术、保留幽门的胰十二指肠切除术或胰十二指肠切除术等术式[5]。腹腔镜下pNENs切除术与开腹手术相比,具有创伤小、恢复快等优点;但对术前及术中病灶定位要求较高,且术后胰瘘等并发症的发生率未明显降低[5]。尽管手术可以达到根治目的,但需结合患者的具体情况选择合适的治疗方法。随着微创诊疗技术的发展,治疗向精准化和个体化发展,更需多学科协作,综合把握手术指征。本例患者高龄,合并症较多,手术及麻醉风险较大,综合患者及家属意愿,结合既往EUS引导下无水乙醇注射治疗有效,建议继续尝试EUS微创治疗,若不能控制病情,再考虑手术。
2.6 临床营养科
患者腰围102 cm,体质量指数27.4 kg/m2,为腹型肥胖;此外有多年高血压、CKD等合并症。原发病方面,患者常于晨起空腹时低血糖症发作,因此可于夜间或凌晨1∶00~2∶00点适时加餐,以碳水化合物为主,平日规律进食,少食多餐,避免剧烈活动;定期监测空腹及餐后血糖,根据具体情况及时调整。此外,患者INS水平较高,低血糖症反复发作,需额外进食较多碳水化合物,易造成肥胖。因此,平日可行低脂饮食,增加新鲜果蔬及膳食纤维的摄入量。反复发生低血糖可引起脑功能改变,可适量补充维生素B1。合并症方面,可行低盐、低蛋白饮食;戒除不良生活习惯,如吸烟、饮酒等。
3 多学科讨论后处理
考虑前次治疗未完全灭活胰岛素瘤,于2018年1月29日行第3次EUS引导下肿瘤内注射治疗,镜下胰体尾部可见一不规则形实性团块,呈中等偏低回声、中央高回声,边界清楚,大小约1.6 cm×1.5 cm,EUS引导下行22 G穿刺针进入病变组织,于病灶内缓慢注入无水乙醇2.3 mL,过程顺利。
内镜治疗术后当晚,患者出现烦躁、腹胀、腹痛。查体:生命体征平稳,中上腹压痛明显,无肌紧张、反跳痛;血清淀粉酶 3900 U/L,血清脂肪酶104 180 U/L。考虑急性胰腺炎,予补液、吸氧、镇痛等对症治疗后,次日患者腹痛消失,逐渐恢复经口进食。出院前对患者进行健康宣教,嘱其戒烟戒酒,低盐、低脂、低蛋白饮食,少食多餐,补充维生素,继续睡前加餐。
4 最终诊断
胰岛素瘤;CKD(4期);高血压3级(极高危)
5 治疗与转归
患者经治疗后,低血糖症缓解,出院后定期于北京协和医院消化内科和内分泌科门诊随诊。2020年2月20日电话随访,患者仍行饮食治疗,近一年内低血糖症未再发作。
6 讨论
胰岛素瘤是最常见的功能性pNENs,约占pNENs的70%~80%,其中恶性不超过10%,发病率约为5.25/10万[6]。胰岛素瘤来源于胰岛β细胞,哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)通路可能参与疾病的发生与发展。因分泌大量INS且不受低血糖负反馈调节,99%的患者表现为反复发作性低血糖症,Whipple三联征为其最典型的表现。低血糖相关神经系统损害除意识模糊、谵妄外,还可出现幻觉、癫痫发作、记忆力损害等,重者可致昏迷。患者多伴有肾上腺素释放增加相关交感神经过度兴奋的表现,如震颤、心悸、面色苍白、大汗等。胰岛素瘤导致的低血糖症为少见病,发病率低,易漏诊、误诊[7]。有研究报道,手术根治胰岛素瘤1年后患者认知功能得到改善,部分可恢复正常[8]。因此,对于低血糖症患者,应注意与其他功能性及器质性疾病相鉴别。当患者表现为典型的Whipple三联征时,需及时监测发作情况,同步测定空腹血糖、INS、C-肽等,尽早识别并治疗。
胰岛素瘤需要定性和定位诊断,前者的难点在于进食后症状可迅速缓解,加之低血糖临床表现不典型,易误诊、漏诊;后者的难点在于目前常规的影像学检查方法(如腹部超声、CT、MRI等)对胰岛素瘤的灵敏度及特异度均较低,易漏诊。EUS对pNENs的诊断灵敏度在80%~90%之间,且可检出较小病灶(直径﹤1 cm);与其他影像学检查相比,EUS可在定位的同时,通过EUS-FNA获取病理组织;但由于胰尾部邻近器官较多、结构复杂,其肿瘤检出率不足50%[9]。此外,EUS为有创检查,且受操作者技术和经验影响。pNENs细胞表面常过表达生长抑素受体(somatostatin receptor,SSTR),而良性胰岛素瘤表达SSTR的几率不足50%,资料显示SSTR显像检出胰岛素瘤的灵敏度仅约50%~60%,对于直径小于1 cm的病灶灵敏度则更低[10]。68Ga-exendin-4 PET/CT灵敏度及特异度均较高,除明确定位外,在胰岛素瘤的疗效评估方面,该项检查亦发挥重要作用。通过监测病灶处GLP-1R表达的变化,比较治疗前后病灶的大小、摄取度等,从而反映其功能改变,为评估病情缓解程度提供客观依据,也利于后续制定治疗方案,但目前尚未在全国范围内普及。其他侵入性检查方式如选择性血管造影、经皮肝门静脉采血测定INS等,现基本不再使用。
此患者的定性和定位诊断明确。根据2016年中国胃肠胰神经内分泌肿瘤专家共识[6],此患者病灶局限、单一、直径小,无影像学转移证据,EUS-FNA病理结果与临床判断一致,肿瘤分级为G1/G2,恶性潜能低,原则上首选根治性手术治疗。但患者高龄,同时存在多种合并症,手术风险较大。EUS引导下无水乙醇注射治疗是治疗胰岛素瘤的一种新方法[11],将无水乙醇注入肿瘤内部,从而达到破坏肿瘤组织的目的。与传统外科手术相比,具有微创安全、术后并发症少、症状缓解迅速等特点,但需注意注射后胰腺炎的发生,已有炎症造成周围脏器组织粘连甚至坏死的报道[12]。因此,无水乙醇注射治疗适于直径小于2 cm的病灶,以及有手术禁忌证、多发病灶及术后复发的患者[13]。本例患者经多次小剂量无水乙醇注射治疗后,病情得以缓解,但仍有复发。与手术治疗相比,内镜治疗难以完全消除病灶,其疗效与肿瘤大小、操作者的经验、注射方式、无水乙醇单次注射量等有关,但目前缺乏多中心大样本随机对照试验,其疗效有待进一步验证。此外,EUS引导下无水乙醇注射治疗可作为胰岛素瘤的术前辅助治疗,有助于缓解病情、改善一般状况、缩小病灶等,为手术创造更好的条件[14]。患者在第3次治疗后出现了急性胰腺炎,也是该操作的常见并发症之一。目前通常采用95%~99%的无水乙醇注射治疗,有研究将碘化油与99%无水乙醇按1∶1混合后进行肿瘤内注射治疗,其术后并发症的发生率低于先前报道(3.6%比27%),而疗效相当[15]。此外,术后并发症还与单次注射量、肿瘤大小、操作方式和操作者经验有关[16],但均缺乏大样本研究证实。因此,目前建议小剂量(无水乙醇单次注射量不超过肿瘤体积的1/2)、重复注射,以减少并发症的发生。
7 专家点评
北京协和医院消化内科 杨爱明教授
1935年1月2日,北京协和医院刘士豪教授、娄克斯教授等成功诊断并切除中国第1例胰岛素瘤(世界第18例),并详尽研究了该病的代谢和临床要点[17]。这不仅确立了日后胰岛素瘤诊治的若干原则,且利用手术标本测定INS生物活性,推动了INS相关系列基础研究的开展。80余年前缺乏先进的医疗技术,但刘士豪教授等通过细致的临床观察、缜密的医学思维和先进的医学理念,对该病进行了详细研究,至今令我们受益匪浅。本例患者胰岛素瘤症状表现虽典型,但早期定位诊断困难,加之存在多种合并症,无法选择一线手术治疗方案,因此最终选取目前新兴的内镜治疗技术进行治疗。回顾整个诊疗病程,很多经验值得总结。
(1)多学科协作的重要性。该患者一般状况较差,合并症多,手术风险高,通过多学科会诊讨论,确定了基于EUS的微创治疗方案,以较小的代价使病情得以控制。提示临床医师,当诊疗遇到困难时,除需本学科内部讨论外,还应邀请其他学科专家会诊,通过多学科协作为疾病诊疗提供新思路,为患者提供最佳的治疗选择。
(2)形成开阔的诊疗思路。胰岛素瘤主要引起低血糖症,而神经系统症状是低血糖症的突出表现。此患者首诊于外院神经内科,并按照神经系统疾病进行诊治,但效果欠佳。在北京协和医院报告的404例胰岛素瘤患者中,44.3%(179例)的患者曾被误诊为癫痫、中枢神经系统病变或精神疾病,少数患者甚至长期接受抗癫痫治疗[7]。提醒临床医师,不仅要掌握本学科的理论知识,同时要关注和学习其他学科的代表性疾病,临床诊治中要综合所学的多学科知识,善于分析问题,最终形成完整的诊疗模式。
(3)重视医患沟通和健康宣教。医生要耐心与患者沟通,向患者阐释治疗的原理和相关检查的重要性,增加患者的依从性;患者出院后,应嘱其规律随访,结合最新病情,及时调整治疗方案。医患共同决策才能实现更好的预后。
作者贡献:陈国榕负责文章撰写及修订;吴东负责提供病例资料、文章构思及修订;阳洪波、罗亚平、吴文铭、孟芝兰、李海龙、张遥、吴晰、杨爱明负责文章修订。
利益冲突:无

