骨髓间充质干细胞源外泌体对大鼠颈动脉球囊损伤后circRNA和microRNA差异表达的影响
周 涵,邓文文,王冬梅,龙仙萍,蒋礼祥,杨双亚,郭鸿浩,陈文明,石 蓓
0 引 言
经皮冠状动脉介入治疗(percutaneous coronary intervention, PCI)已成为治疗冠状动脉粥样硬化性心脏病的一种重要手段,虽然药物涂层球囊导管和药物洗脱支架降低了冠状动脉支架内再狭窄的发生率,但这一并发症仍旧严重影响远期疗效[1-2]。越来越多的证据表明,炎症、血管损伤等因素刺激平滑肌细胞的增殖、迁移,在支架内再狭窄的发生、发展中发挥着重要的作用[3]。研究表明,骨髓间充质干细胞(bone marrow mesenchymal stem cells, BMSCs)可通过调节免疫、炎症反应、细胞分化调控内皮细胞、平滑肌细胞的增殖、凋亡等在多种心血管疾病中发挥重要作用[4-5]。目前研究认为,BMSCs主要通过旁分泌机制发挥生物学功能。外泌体是一种纳直径在30~150 nm之间的微囊泡,能够通过运输细胞活性物质来介导细胞间的通讯,其中,非编码RNA(non-coding RNA,ncRNA)含量丰富[6]。
在支架内再狭窄过程中,ncRNA表达谱发生变化。其中,某些ncRNA通过抑制平滑肌细胞增殖、迁移及新生内膜形成,可以减少的新生内膜过度增殖[7]。部分circRNA被证明可以充当“海绵”,通过吸附microRNA和蛋白质发挥作用[8]。此外,某些circRNA还可以作为支架来促进、定位和调节蛋白质的功能[9]。而miRNAs能够在转录水平上调节基因表达,或者同时抑制转录和翻译,circMACF1能通过miR-500b-5p及减轻心肌细胞凋亡[10]。但BMSCs源外泌体在支架内再狭窄中发挥作用以及其中circRNA和microRNA作用尚未完全阐明。
因此,本研究拟采用构建颈动脉球囊损伤大鼠模型模拟PCI术后再狭窄的病理过程,通过Arraystar大鼠circRNA和microRNA芯片检测大鼠颈动脉球囊损伤模型中circRNA和microRNA表达的变化,对其差异进行生物信息学分析,探索BMSCs源外泌体调控受损血管circRNA和microRNA表达变化,及其在大鼠颈动脉球囊损伤后可能发挥的作用和机制。
1 材料与方法
1.1 材料Arraystar大鼠CircRNA V2.0芯片、Arraystar大鼠MicroRNA V2.0芯片(上海康成);逆转录试剂盒、Real-Time PCR试剂盒、SYBR Premix Ex TaqTMII(日本Takara公司);苏木精、伊红、DCFH-DA探针(美国sigma公司);兔抗大鼠的CD63、HSP70、Alix、GAPDH一抗及羊抗兔二抗(博士德生物公司);2.0 mm×12.0 mm球囊导管(美国Baxter Healthcare公司);倒置荧光显微镜、正置显微镜(日本Olympas公司);Real-time PCR仪、凝胶成像系统(美国BIO-RAD公司)。
1.2实验动物与分组SPF级雄性SD大鼠46只,体重(200±20)g,由第三军医大学大坪医院实验动物中心提供,动物使用合格证号:SCXK(渝)2017-0005,小鼠饲养与温度:23~25 ℃,相对湿度(55±10)%,40 W日光灯照射,维持12 h光照和12 h黑暗的昼夜交替光照。10只大鼠用于BMSCs源外泌体的提取,36只采用随机数字表法等分为3组(n=12):假手术组,损伤组,外泌体组(400 μL)。假手术组大鼠只分离颈左总动脉血管,其余各组大鼠的左颈总动脉均行球囊损伤,外泌体组行球囊损伤后立即原位注射400 μL BMSCs源外泌体并用微型血管夹夹闭血管5 min。建模14 d后取颈动脉组织进行后续试验。
1.3实验方法
1.3.1 BMSCs源外泌体的提取将胎牛血清通过4 ℃、100 000×g超速离心过夜去除其所含外泌体。大鼠 BMSCs 分离培养具体步骤参考本实验室前期研究方法[12]。无外泌体血清培养BMSCs 24 h后,收集BMSCs上清液,4 ℃、300×g离心10 min,弃上清,2000×g离心10 min,去除死细胞,10 000×g离心30 min,去除细胞亚结构,4 ℃、100 000×g离心140 min后弃上清,PBS重悬沉淀,再以4 ℃、100 000×g离心140 min,洗涤1次,PBS重悬,-80 ℃保存。
1.3.2透射电镜观察外泌体形态将外泌体悬液按照1∶10的比例稀释,用2.5%~3%戊二醛4 ℃固定于超薄碳膜铜网,室温静置5 min后吸干,1%磷钨酸(PTA)负染,干燥后透射电镜下拍照。
1.3.3WB检测外泌体表面标记蛋白提取细胞碎片(Cell Lysis)及外泌体蛋白,100 ℃煮沸变性8 min。等量上样至SDS-PAGE凝胶,150 V,50 min电泳,300 mA,1 h转膜,5%脱脂奶粉封闭1 h,一抗(CD63 1∶300;Alix1∶300;HSP70 1∶300)4℃孵育过夜,辣根过氧化氢酶标记二抗(1∶2000)室温孵育1 h,滴加增强型发光试剂(ECL)后用Bio-blot曝光仪检测灰度值。
1.3.4球囊损伤模型SD大鼠腹腔注射2%戊巴比妥钠(55 mg/kg),尾静脉注射100 U/kg肝素钠抗凝。头颈部备皮,取颈部正中切口,充分暴露左颈总动脉并分离至远端颈内动脉及颈外动脉分叉处,用6-0丝线结扎颈外动脉,微型血管夹夹闭颈内动脉及颈总动脉。用眼科剪于颈外动脉近段剪一小口,将2.0 mm×12.0 mm球囊从切口插入颈总动脉。松开颈总动脉处血管夹,将球囊充盈至3.0个大气压,顺时针、逆时针反复旋转球囊180°,来回抽动3次以剥脱颈总动脉内膜。结扎颈外动脉切口近端,并松开颈内动脉处的血管夹恢复血流。查看颈总动脉及颈内动脉搏动良好后逐层缝合肌肉与皮肤。术后肌肉注射青霉素20万U/d,连续3 d,单笼饲养。
1.3.5HE染色将各组术后14 d颈动脉组织进行石蜡切片常规脱蜡至水后苏木精染色5 min,盐酸乙醇分化40 s,ddH2O冲洗,伊红染色3 min,脱水、透明、封固及干燥后用光学显微镜拍照。采用Image J14.9软件测量颈动脉内膜、中膜横断面面积,计算内膜/中膜面积比值。
1.3.6DCFH-DA染色按1∶1000比例稀释DCFH-DA储存液,制成10 μmol/L DCFD-DA工作液(避光),将3组冰冻切片置于10 μmol/L DCFD-DA工作液中,37 ℃避光孵育30 min,4 ℃预冷的PBS清洗1 min×2次,封固后用荧光显微镜拍照。用Image J14.9软件分析各组颈动脉组织平均荧光强度。
1.3.7circRNA和microRNA芯片球囊损伤后14 d,取假手术组及损伤组颈动脉组织行circRNA和microRNA芯片分析,每组各3次重复实验。Arraystar大鼠CircRNA V2.0、MicroRNA V2.0芯片筛查部分的RNA提取、探针设计和数据分析由上海康成生物有限公司完成。
1.3.8生物信息学分析使用Agilent Feature Extraction软件(v11.0.1.1)读值为原始数据。使用Gene Spring GX v12.1软件(Agilent Technologies)对原始数据进行Quantile标准化和随后的数据处理。原始数据标准化后经过筛选高质量探针进行进一步分析。两组样品间差异表达circRNA和microRNA通过P-value及FoldChange筛选。利用mirdbV5进行microRNA靶基因预测,采用GO分析对基因进行注释和分类;采用KEGG对靶基因进行通路分析。应用Cytoscape软件(version3.1.1)构建网络图,将筛选出的BMSCs源外泌体调控球囊损伤后血管内膜增殖及炎症的microRNA、circRNA;使用Arraystar的基于TargetScan和miRanda的miRNA靶标预测软件预测出与circRNA有结合位点的microRNA;在预测与microRNA结合的靶基因中选取targetScore前20的靶基因通过STRING预测靶基因间结合关系,按照medium confidence=0.4得到mRNA-mRNA结合关系144对,纳入CircRNA-microRNA-mRNA共表达网络。
1.3.9实时聚合酶链反应(qRT-PCR)采用primer5.0软件设计8个circRNAs和7个microRNA引物,由广州锐博公司验证并合成,选取GAPDH及U6作为内参基因进行qRT-PCR。收集3组颈动脉组织(n=3),提取总RNA,逆转录为cDNA,制成20μL扩增体系。反应条件:95 ℃:30 s;95 ℃:5 s;62 ℃:30 s;55~95 ℃:每0.5 ℃10 s(81cycle)。用Image Lab软件计算结果,所有样本的circRNA归一化为GAPDH产生的信号,microRNA归一化为U6产生的信号。数据通过2-ΔΔCT法计算。
1.4统计学分析生物信息学分析以circRNA和microRNA芯片检测结果为基础,两组样本间差异表达的circRNA和microRNA按照P<0.05及FoldChange≥2的标准进行筛选。使用GraphPad Prism软件(version 8.3)进行统计分析。定量资料以均数±标准差(x±s)表示,两组独立样本的比较采用t检验,多组间比较采用单因素方差分析,LSD法进一步行两两比较。以P≤0.05为差异具有统计学意义。
2 结 果
2.1 大鼠BMSCs源外泌体鉴定在透射电镜下可见圆形或椭圆形,有脂质膜结构的囊状小泡,呈“茶托盘状”,直径30~150 nm。Western blot结果显示:标记物CD63、Alix及HSP70均为阳性表达,见图1、图2。

BMSCs源外泌体呈现茶托盘状的囊泡状结构
2.2BMSCs源外泌体可抑制球囊损伤后新生内膜增殖HE染色结果显示:损伤组较假手术组新生内膜增殖明显,其内膜/中膜面积比(1.902±0.217)较假手术组(1.000±0.000)显著增加(P<0.05);外泌体组较损伤组新生内膜增殖程度有所减低,其内膜/中膜面积比(0.982±0.067)较损伤组明显减低(P<0.05)。见图3。
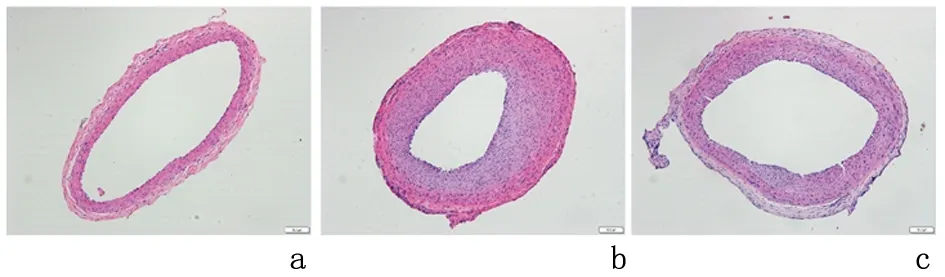
a:假手术组; b:损伤组; c:外泌体组
2.3BMSCs源外泌体抑制颈动脉球囊损伤后ROS的释放DCFH-DA染色结果显示:与假手术组DCFHA红色荧光强度(4.730±0.104)相比,损伤组(16.800±0.380)明显增强(P<0.05);与损伤组相比,外泌体组DCFHA红色荧光强度(12.810±0.094)明显减弱(P<0.05)。见图4。
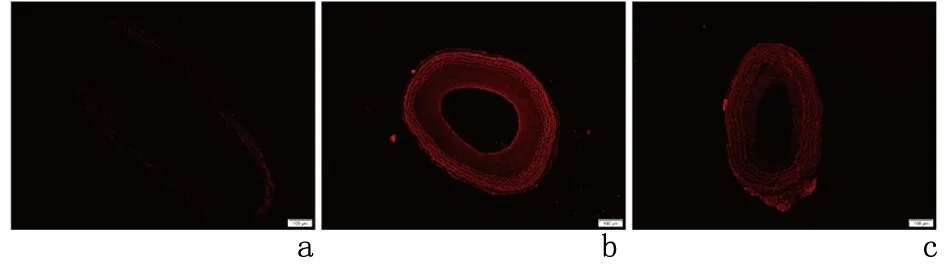
a:假手术组; b:损伤组; c:外泌体组
2.4circRNA、microRNA表达谱对于circRNA,聚类图、散点图和火山图显示,circRNA的表达水平有差异,见图5。与假手术组相比,损伤组动脉组织中有差异circRNA共1683个(Foldchange≥2,P<0.05),其中上调者631个,下调者1052个。
对于microRNA,聚类图、散点图和火山图显示,与假手术组相比,损伤组颈动脉组织中有差异microRNA共44个(Foldchange≥2,P<0.05),且均在损伤组上调,见图6。
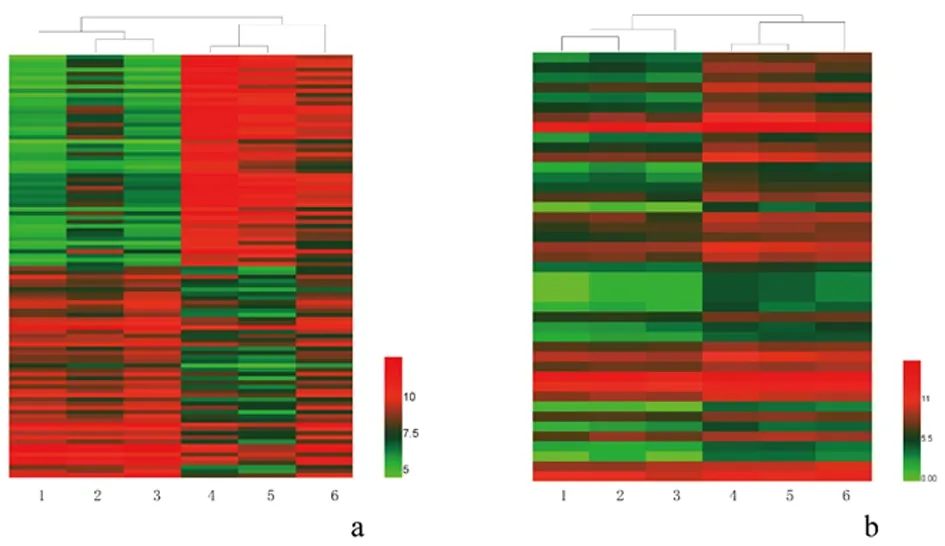
1-3:假手术组; 4-6:损伤组
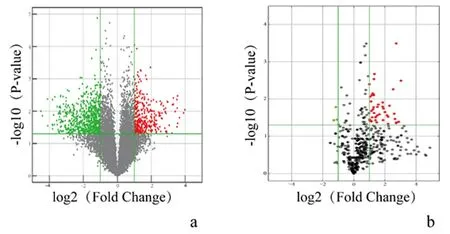
a:circRNA; b:microRNA
2.5对差异microRNA靶基因进行生物信息学分析
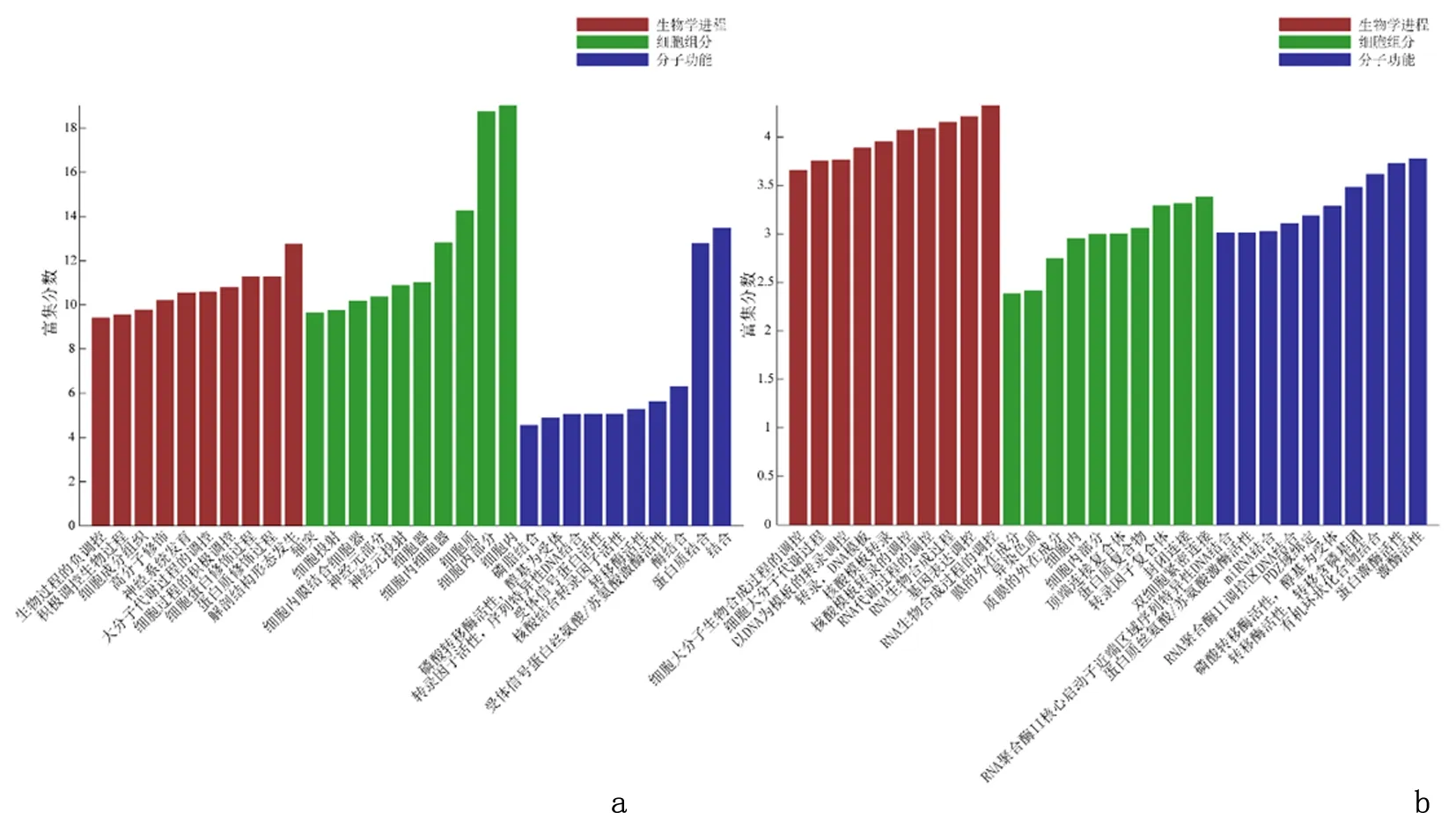
2.5.1 GO分析差异microRNA靶基因在3个Gene ontology的富集情况为:3168个富集于生物学进程(Biological Process);4325个参与细胞组分(Cellular Component);1762个参与分子功能(Molecular Function)。差异miRNA的表达上调的靶基因mRNA在生物学进程方面主要富集在细胞生物学进程正向调控、细胞组分、大分子代谢调节等方面。差异microRNA的表达下调的靶基因mRNA在生物学进程方面,主要富集在RNA生物合成过程的调控、基因表达的调控、RNA代谢过程的调控等方面;在细胞组分方面主要富集在细胞间紧密连接、转录因子复合体、蛋白质复合体等方面;在分子功能方面主要富集在激酶活性、结合有机环化合物、结合microRNA等中,见图7。
2.5.2KEGG Pathway分析结果显示差异microRNA的靶基因中有221个分别富集到了KEGG Pathway数据库的63条生物学通路中。KEGG分析发现,在预测到的差异表达的microRNA的靶基因mRNAs中,上调的mRNA其KEGG pathway主要富集在MAPK信号通路、肌动蛋白细胞骨架的调节、癌症中的胆碱代谢、背腹轴形成、内分泌抵抗、胞吞作用、缝隙连接、癌症中的中央碳代谢、癌症中的转录失调、癌症中的蛋白聚糖等过程中。下调的mRNA其KEGG pathway主要富集在乙型肝炎、Ras信号通路、Hippo信号通路、轴突引导、胞吞作用、大肠癌、甲型流感、鞘脂信号通路、神经营养蛋白信号通路、丙型肝炎等过程中。
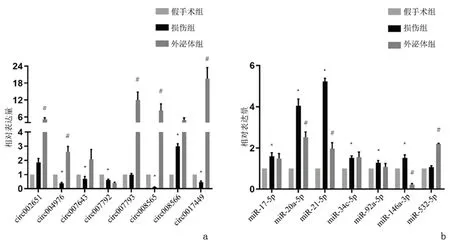
2.6qRT-PCR检测相比假手术组,损伤组中circRNA_008566、circRNA_002651表达上调(P<0.05),circRNA_004976、circRNA_007792、circRNA_007643、circRNA_008565、circRNA_017449表达下调(P<0.05),circRNA_007793在两组间表达差异无统计学意义(P>0.05),与芯片结果基本一致。相比损伤组,外泌体组中circRNA_004976、circRNA_007793、circRNA_008565、circRNA_008566、circRNA_017449、circRNA_002651表达上调(P<0.05)。结合生物信息学分析,选取差异上调5倍以上且与内膜增生、炎症相关的7个作为候选microRNA(miR-34c-5p、miR-20a-5p、miR-17-5p、miR-92a-3p、-miR-146a-5p、miR-21-5p、miR-532-5p)。结果显示:与假手术相比,损伤组miR-34c-5p、miR-20a-5p、miR-17-5p、miR-92a-3p、miR-146a-5p、miR-21-5p均存在差异表达(P<0.05),miR-532-5p在两组间表达差异无统计学意义(P>0.05)。与损伤组相比,外泌体组中miR-532-5p上调(P<0.05),miR-20a-5p、miR-146a-5p、miR-21-5p均发生下调(P<0.05),见图8。
2.7circRNA-microRNA-mRNA共表达网络circRNA-microRNA-mRNA共表达网络展示了circRNA-microRNA、microRNA-mRNA、mRNA-mRNA之间的结合关系,见图9。
a:差异上调; b:差异下调
与假手术组相比,*P<0.05; 与损伤组相比,#P<0.05

绿色矩形代表circRNA,红色矩形代表microRNA,蓝色矩形代表mRNA
3 讨 论
虽然PCI的广泛应用极大地提高了冠心病患者的生存率和生活质量,但PCI术后支架内再狭窄仍旧困扰着人们的身心健康。对PCI术后血管再狭窄的机制进行研究,结果显示血管内膜产生机械性损伤、平滑肌细胞增生、细胞外基质分泌增多以及炎症反应均参与支架内再狭窄的发生发展[13]。本实验采用球囊损伤大鼠颈动脉内膜的方法建立血管内膜增生的动物模型。术后14 d,通过HE染色显示大鼠颈动脉内膜增生明显,DCFH-DA染色显示大鼠颈动脉内膜ROS释放增加,进一步验证了新生内膜增生在支架内再狭窄病理生理过程中的重要地位。
BMSCs能够在多种心血管疾病病理过程中调节内皮细胞、平滑肌细胞和免疫细胞的功能发挥强大的抗炎和免疫调节作用[14]。BMSCs能够通过激活eNOS系统改善内皮细胞的功能,并通过激活Wnt信号通路,减少氧化应激来减少内皮细胞的凋亡[15-16]。其中外泌体因具有和源细胞相似功能而被在各种疾病模型中广泛研究。研究表明,人脐静脉内皮细胞源外泌体介导的circRNA-0077930通过下调miR-622的表达,上调Kras、p21、p53和p16诱导血管平滑肌细胞衰老[17];在动脉粥样硬化早期,BMSCs通过外泌体传递let-7a激活STAT3/BMPR2信号通路抑制平滑肌细胞的增殖[18];来自脂肪干细胞的外泌体miR-320d可以通过靶向STAT3来保护心肌细胞,从而减少凋亡并提高细胞存活率[19];内皮细胞来源的外泌体分泌的miR-214能刺激心肌细胞迁移和血管生成[20]。那么,BMSCs源外泌体中非编码RNA在支架内再狭窄的过程中是否发挥作用呢?目前鲜有报道。而我们的结果表明,BMSCs源外泌体处理后14d受损动脉的内膜增生程度明显减弱,且颈动脉ROS的释放被抑制,提示BMSCs源外泌体对球囊损伤后的内膜起到了一定的保护作用。而BMSCs源外泌体是如何发挥其保护损伤内膜作用的呢?
本研究中,与假手术组相比,损伤组颈动脉中差异表达的circRNA共1683个,其中361个表达上调,1052个表达下调。其中10个circRNA(circRNA_007697、circRNA_36302、circRNA_42809、circRNA_004906、circRNA_000370、circRNA_004214、circRNA_005456、circRNA_008895、circRNA_36887)表达上调达10倍以上;下调的circRNA数量远大于上调的circRNA,倍数变化幅度也进一步增大,其中4个circRNA(circRNA_008565、circRNA_011144、circRNA_23525、circRNA_017449)表达下调达15倍以上,其中circRNA_017449表达下调甚至达到22.5倍。结合聚类分析及qPCR验证,进一步筛选出外泌体处理后有差异性表达的circRNA:circRNA_004976、circRNA_008565、circRNA_017449。由于上述circRNA表达均在外泌体处理后表达上调,我们猜测这种现象可能与BMSCs源外泌体摄入释放相关,可能是由于BMSCs源外泌体富含该circRNA并释放至受损组织中,调控相关microRNA及mRNA,进而抑制球囊损伤后内膜增生的发生发展。
我们还发现,与假手术组相比,44个microRNAs在球囊损伤大鼠颈动脉中显著上调,其中7个microRNA(miR-34c-5P、miR-20a-5p、miR-17-5p、miR-532-5p、miR-92a-3p、miR-146a-5p、miR-21-5p)显著上调5倍以上,miR-34c-5p上调超过8倍。选择上述7个microRNA作为候选microRNA,结合芯片结果并通过采用qPCR进一步筛选出外泌体处理后有差异性表达的microRNA:miR-20a-5p、miR-146a-5p、miR-21-5p,表明这些microRNA可能参与支架内再狭窄的病理生理过程。为了探索这些差异表达的microRNA的功能,通过GO分析及KEGG等生物信息学方法分析靶基因富集的生物学过程及可能参与的通路。GO分析结果显示,上调的mRNA多与细胞生物学进程正向调控、细胞内、结合等方面有关。下调的mRNA多与RNA生物合成过程的调控、细胞间紧密连接、激酶活性等方面有关。KEGG通路结果表明它们可能通过MAPK、FoxO、Ras、GnRH、Prolactin、TNF、Hippo、Sphingolipid、Neurotrophin、AGE/RAGE、FcepsilonRI等通路参与支架内再狭窄的病理生理进程。其中MAPK信号通路(28个靶基因)、Ras信号通路(9个靶基因)、Hippo信号通路(7个靶基因)等广泛报道的与球囊损伤后内膜增生、炎症相关[21-23]。
在靶基因中检索与大鼠血管内膜增生有生物学作用的基因。Cav1是一种细胞表面的穴样内陷中的主要膜内在蛋白,可抑制平滑肌细胞增殖、迁移并抑制平滑肌细胞表型转化[24-25]。Fgf1是成纤维细胞生长因子家族的成员,可促进平滑肌细胞增殖[26]。Clock与Bmal1均为昼夜节律基因,可形成异源二聚体,激活Bmal1转录促进平滑肌细胞增殖[27]。Tiam1是一种特异性的核苷酸交换因子,可调节细胞周期进程促进平滑肌细胞增殖[28]。结合CircRNA-microRNA-mRNA共表达网络筛选出能够通过miR-7a-2-3p、miR-107-5p调控靶基因Cav1、Fgf1的表达的circRNA:circRNA_004976、circRNA_008565及能够与Clock、Tiam1相互作用的microRNA:miR-20a-5p、miR-21-5p。
综上所述,我们认为BMSCs能够通过外泌体调控circRNA_004976、circRNA_008565以及miR-20a-5p、miR-21-5p等的表达,调控细胞增殖、迁移,最终起到抑制大鼠颈动脉球囊损伤后的血管内膜过度增生的生物学功能。这可能有助于揭示circRNAs和microRNAs参与球囊损伤后血管再狭窄的分子机制及病理过程,为支架内再狭窄的防治提供新的靶点及分子标志物。但我们筛选出的circRNA和microRNA中具体通过何种通路作用于下游靶基因?有待进一步探索。
- 医学研究生学报的其它文章
- NLRP3炎性小体在创伤性脑损伤中的作用

