不同耐药表型肺炎克雷伯菌生物膜形成能力与RyhB基因的关联性
熊流新,陆丽苗,梁启兰,黄志伟,李淑英,盘国雄,钟建辉,陈亚宽
广东省肇庆市第二人民医院:1.检验科;2.呼吸科,广东肇庆 526060
肺炎克雷伯菌(KP)是引起医院内感染和社区感染的重要条件致病菌,可导致多个系统尤其是呼吸系统感染[1]。高毒力肺炎克雷伯菌(HvKP)的特征为高黏性、拉丝试验阳性,可导致社区型肺炎,感染人群主要为青壮年[2]。随着三代头孢的广泛使用,KP的耐药率逐年上升,且出现了产超广谱β-内酰胺酶肺炎克雷伯菌(ESBLsKP)、多重耐药肺炎克雷伯菌(MDRKP)和耐碳青霉烯类肺炎克雷伯菌(CRKP),这类KP引起的呼吸道感染已成为临床关注的热点[3-4]。研究表明自然界中绝大多数细菌可以产生生物膜,其细胞外基质参与细菌的黏附、定植过程,生物膜包含的大量黏性基质能形成物理屏障,限制抗菌药物和炎症细胞的有效杀伤,生物膜的形成与KP的耐药性和致病性密切相关[5-6]。RyhB基因属于非编码小RNA,研究表明RyhB可以被转录但不能被直接翻译为蛋白,可通过影响细菌生物膜的合成来调节和影响细菌致病性[7-8]。本研究通过分析本院呼吸道感染分离的46株KP的耐药性和生物膜形成能力,同时检测RyhB基因,探讨不同耐药表型KP生物膜形成能力与RyhB基因的相关性及其临床意义。
1 材料与方法
1.1菌株来源 收集本院2018年10月至2019年10月不同耐药表型的46株KP(剔除同一患者的重复菌株),对其进行细菌培养、分离和纯化,根据脉冲场凝胶电泳(PFGE)试验,剔除型别相似度>85%的菌株。
1.2仪器与试剂 Biofosun微生物鉴定药敏系统、数字显示比浊仪购自上海复星公司;超净工作台购自苏州安泰公司;实时荧光定量PCR(qPCR)仪购自美国Bio-Rad公司;全功能微孔板检测仪购自美国Bio-Tek公司;qPCR试剂盒购自日本Takara公司;细菌总RNA提取试剂盒购自北京天根生化科技有限公司;液体LB培养基和血平板购自广州迪景公司;结晶紫购自美国Sigma公司;96孔聚苯乙烯灭菌板购自美国Corning公司;RNA引物购自上海生工公司;质控菌株肺炎克雷伯菌ATCC700603和大肠埃希菌ATCC25922均购自广东省临床检验中心。
1.3药敏方法与分组 采用Biofosun微生物鉴定药敏系统进行细菌鉴定并使用配套药敏板测定18种抗菌药物的最小抑菌浓度,依据美国临床和实验室标准协会M100-S27药敏折点判读结果。KP耐药分组参考苏乐斌等[9]的研究,根据抗菌药物的不同耐药谱将菌株分为4个耐药表型。具体分组方法如下:用接种环轻触血平板过夜培养的新鲜菌落并向外牵拉,重复2次,若2次均有黏液丝生成并且长度>5 mm为拉丝试验阳性,判断为HvKP;按标准纸片扩散法同时使用头孢噻肟、头孢他啶、头孢噻肟/克拉维酸、头孢他啶/克拉维酸,任一药敏纸片加克拉维酸与不加克拉维酸抑菌环直径之差>5 mm,判断为产ESBLsKP;对亚胺培南耐药菌株,参考文献[8]进行改良碳青霉烯酶灭活(mCIM)试验,结果阳性判读为CRKP;对3类或以上抗菌药物耐药,不同于HvKP、产ESBLsKP、CRKP分组标准的菌株归类为MDRKP。
1.4KP生物膜形成能力的检测 采用96孔聚苯乙烯灭菌板构建KP感染模型,通过结晶紫染色法定量4种不同耐药表型的吸光度(A),具体方法参考文献[10]进行。(1)将46株KP转种血平板,挑取单个菌落于LB培养基中35 ℃培养24 h;(2)吸取10 μL至LB培养基中进行传代培养后把菌液调至0.5麦氏浊度,将10 μL菌液接种于含190 μL LB培养液的96孔聚苯乙烯灭菌板(每株设3个复孔),设置未加菌液的LB培养基为空白对照;(3)35 ℃培养48 h后分离上清液,加入200 μL 1%结晶紫染色液染色20 min,采用ddH2O缓慢冲去未结合结晶紫,每孔加200 μL无水乙醇溶解后采用酶标仪测定590 nm处A值(平行测定3次,取平均值);(4)结果判读标准:AC等于空白孔平均A值加其3倍标准差,当A样≤AC时,结果为阴性无生物膜产生;当AC
1.5qPCR扩增RyhB基因 依照细菌总RNA提取试剂盒使用说明书提取RNA作为模板。参考文献[11]设计RyhB基因引物序列(GT44:5′-GGA TCC GCA AGG GTC TCC CTG-3′,GT45:5′-AGA TCT CGG TTC AGC ATG GCG TAT C-3′)和设定PCR反应条件。qPCR扩增RyhB基因过程具体如下:将RNA模板、引物、2×qPCR buffer、Taq Mix溶解后冰上备用,反应体系为25 μL:2×qPCR buffer 12.5 μL,正义引物1 μL,反义引物1 μL,RNA模板1 μL,Taq Mix 0.5 μL,ddH2O加至25 μL。震荡混匀后短暂离心使溶液收集至管底,将热循环仪预热至45 ℃,qPCR反应条件为:反转录温度45 ℃,30 min;95 ℃预变性2 min;94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸30 s,35个循环;72 ℃延伸5 min。qPCR产物经10 g/L琼脂糖凝胶电泳鉴定,阳性产物送上海生工生物工程有限公司进行测序,测序结果在美国国家生物信息中心(NCBI)数据库进行比对分析。
1.6统计学处理 使用SPSS23.0软件进行数据处理分析。对数据进行正态性检验,计量资料多组间比较采用单因素方差分析,两两比较使用LSD-t检验;计数资料以例数和百分率表示,组间比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结 果
2.1KP的耐药表型分组及临床分布 46株KP根据不同的耐药谱特征可分为4个耐药表型,其中CRKP 6株(占13.0%),产ESBLsKP 18株(占39.1%),MDRKP 13株(占28.3%),HvKP 9株(占19.6%)。46株KP科室来源排名前3为重症监护室(ICU)11株(占23.9%),呼吸科8株(占17.4%),神经外科7株(占15.2%),见表1。

表1 46株KP的科室分布
2.24种不同耐药表型KP生物膜形成能力差异分析 5株CRKP为弱阳性、1株CRKP为中等阳性,9株HvKP生物膜形成能力均为弱阳性,18株产ESBLsKP生物膜形成能力均为中等阳性,13株MDRKP生物膜形成能力均为中等阳性。不同组别的生物膜形成能力差异有统计学意义(F=38.444,P<0.05),CRKP生物膜形成能力低于产ESBLsKP、MDRKP(P<0.05);HvKP生物膜形成能力低于产ESBLsKP、MDRKP(P<0.05);CRKP与HvKP比较,差异无统计学意义(P=0.802);产ESBLsKP与MDRKP比较,差异无统计学意义(P=0.466)。见表2。
2.34种不同耐药表型KP的RyhB基因扩增电泳结果分析 产ESBLsKP和MDRKP 存在特异性条带(大小约200 bp),CRKP 和HvKP不存在特异性条带。qPCR扩增RyhB基因的阳性产物经测序后在NCBI数据库进行比对分析,结果一致,大小为约200 bp,其中包含了完整的RyhB基因编码区(91 bp)位于yhhY和虚拟蛋白ORF之间。见图1。
2.4RyhB基因表达与KP生物膜形成能力关联性分析 以生物膜形成能力为因变量,以组别与基因表达情况的交互项(共4项,其中以组别=MDRKP×RyhB基因表达=阳性为参照层级,其他层级均与此层级进行层内的比较,得出偏回归系数β),建立广义线性回归方程,偏回归系数β用来表示关联程度。对组别=CRKP×RyhB基因表达=阴性,检验P<0.05,说明此交互层级对生物膜形成能力的影响有统计学意义,β=-0.059,说明当组别为CRKP且基因表达阴性时,生物膜形成能力相对于参照层平均下降了0.059个单位,生物膜形成能力呈负向关联;对组别=HvKP×RyhB基因表达=阴性,检验P<0.05,说明此交互层级对生物膜形成能力的影响有统计学意义,β=-0.057,说明当组别为HvKP且基因表达阴性时,生物膜形成能力相对于参照层平均下降了0.057个单位,与生物膜形成能力呈负向关联;对组别=产ESBLsKP×RyhB基因表达=阳性,检验P>0.05,说明此交互层级对生物膜形成能力的影响无统计学意义。结果表明,在CRKP及HvKP菌株中,RyhB基因表达为阴性,其与其他组别基因表达为阳性比较,生物膜形成能力会下降;不同耐药表型与RyhB基因表达的交互作用与生物膜形成能力有关(P<0.05),且RyhB基因阴性表达时,会导致生物膜形成能力下降。见表3。
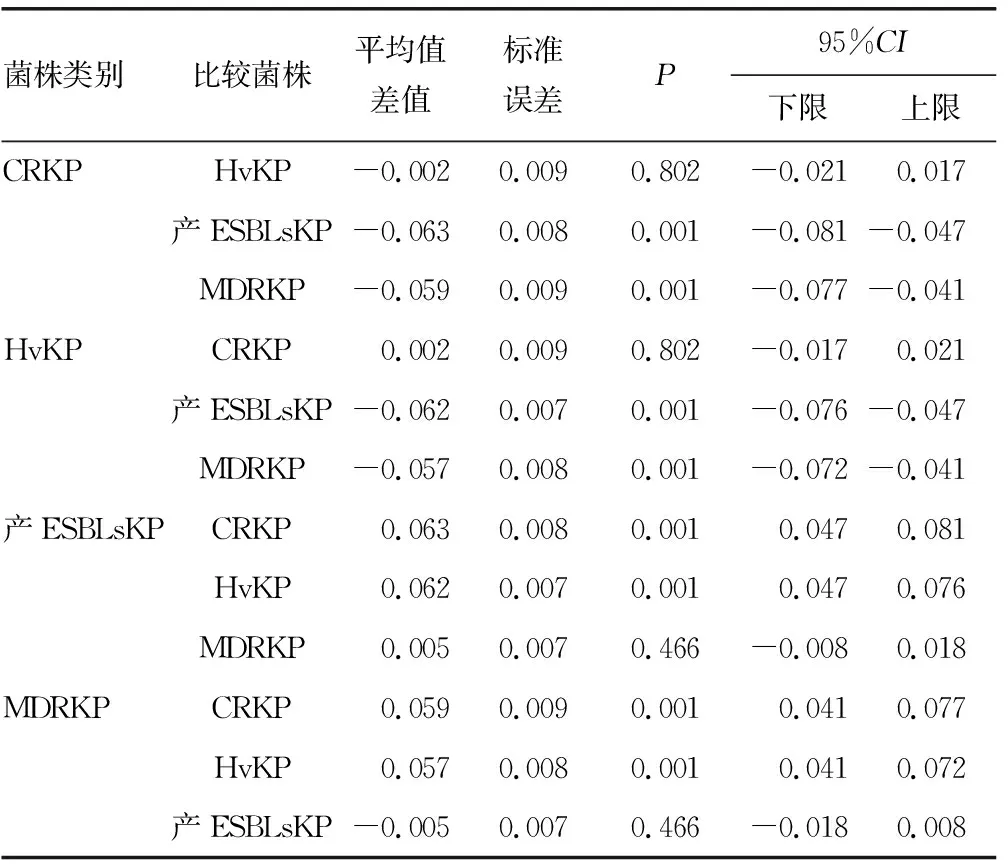
表2 4种不同耐药表型KP生物膜形成能力多重比较
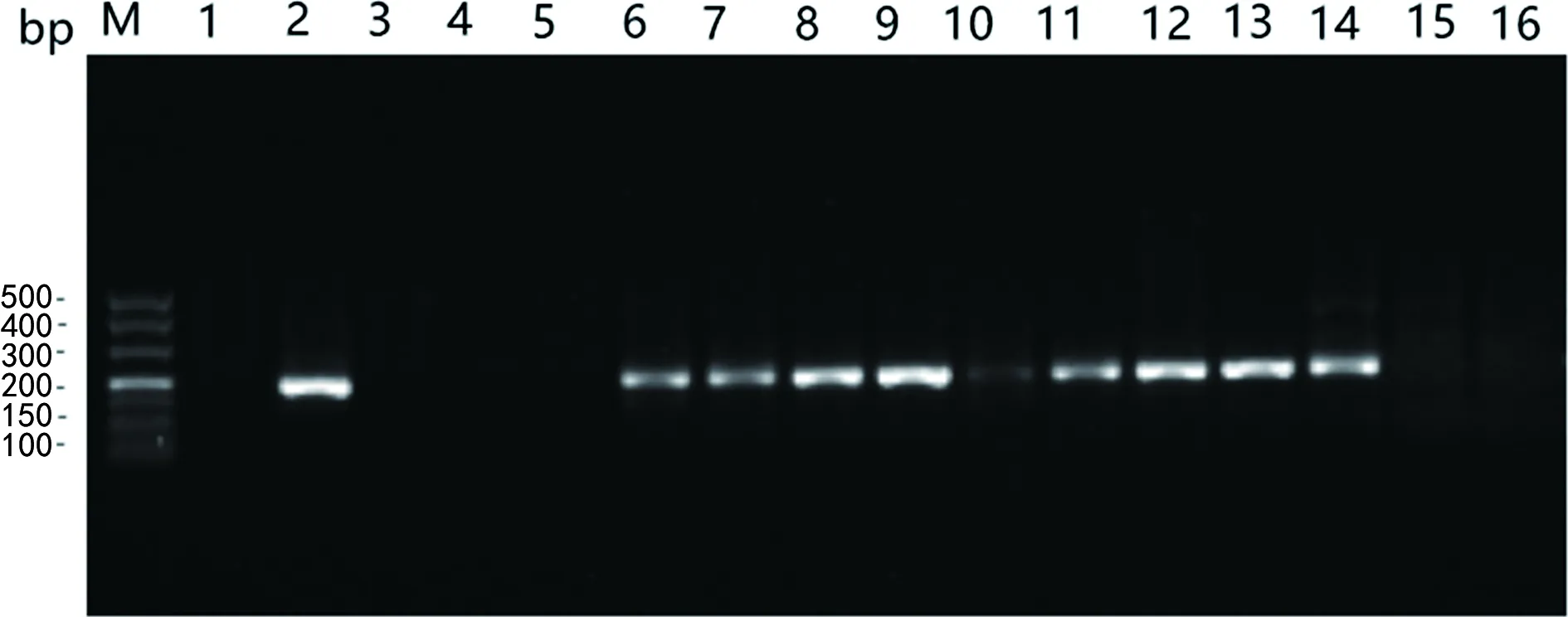
注:M泳道为DNA marker;1泳道为阴性对照;2泳道为阳性对照;3~5泳道为CRKP扩增条带;6~10泳道为产ESBLsKP扩增条带;11~14泳道为MDRKP扩增条带;15~16泳道为HvKP扩增条带。
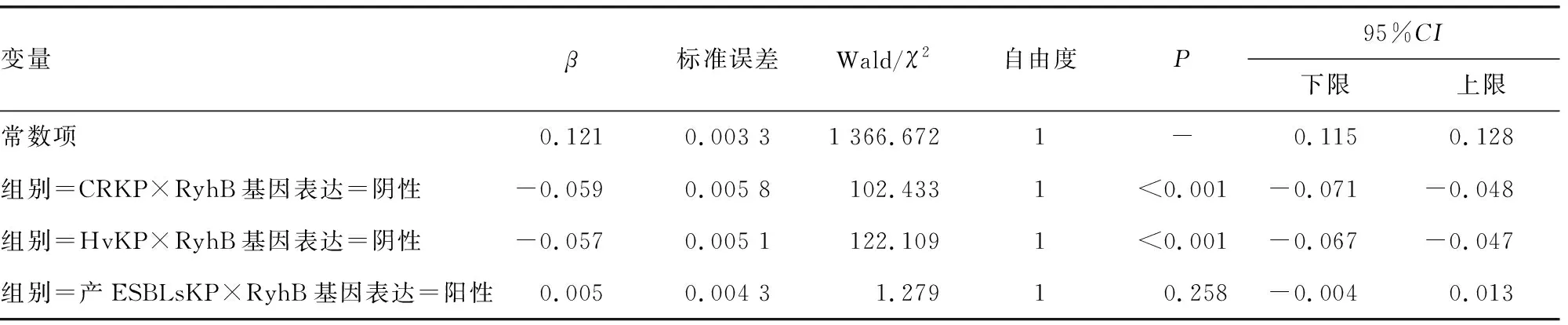
表3 RyhB基因表达与KP生物膜形成能力的广义线性模型
3 讨 论
KP是呼吸道感染最常见的革兰阴性条件致病菌,极易导致院内感染暴发。根据2018年中国细菌耐药监测网结果显示KP耐药率呈逐年上升趋势,特别是对碳青霉烯类抗菌药物的耐药率从2005年的3.0%上升至2018年的27.6%,MDRKP和CRKP引起的抗感染治疗成为临床关注的焦点[12]。
细菌生物膜由多糖、蛋白质等组成,大量的黏性基质将细菌包裹,常规抗菌药物往往难以穿透作用于该类细菌,导致临床抗菌药物治疗效果差[13]。本研究收集的46株KP经过前期的工作,剔除来源同一患者的重复菌株及PFGE型别相似度>85%的菌株,相比卢鸿等[10]研究同一克隆菌株的KP生物膜形成能力更有临床意义。彭蓉蓉等[14]研究表明KP生物膜的形成在ICU发生的概率较高,与本院临床分布主要在ICU、呼吸科和神经外科的结果一致。本研究通过结晶紫染色法对4种不同耐药表型KP生物膜形成能力进行定量检测,结果显示,4种KP均存在生物膜形成能力,其中产ESBLsKP、MDRKP的生物膜形成能力明显强于CRKP和HvKP(P<0.05)。DAVIDO等[15]研究显示,产ESBLsKP和MDRKP是目前医院流行的主要致病菌,这表明生物膜形成能力是适应外界环境的重要方式,产ESBLsKP和MDRKP具有较强的生物膜形成能力,有利于其在医院内定植及传播,大量临床分离菌株的出现与生物膜形成有密切关系。CRKP为4种不同耐药表型中耐药性最强的菌株,但是生物膜形成能力显示5株CRKP为弱阳性、1株CRKP为中等阳性,这表明KP生物膜形成能力与耐药性关系的具体机制仍有待进一步研究。
非编码小RNA基因存在于绝大多数原核生物中,通常位于基因间区,具有特殊的茎环结构,可以被转录但不能被直接翻译为蛋白,通过碱基反向互补调控靶标mRNA分子的表达[16]。细菌在不同温度、营养、酸碱度、铁离子浓度等条件下增殖并适应环境的能力依赖于蛋白质类的调控因子及一些非编码小RNA的调控,RyhB最早是在大肠埃希菌中被发现,属于非编码小RNA[17]。肠杆菌科细菌除沙门菌和鼠疫耶尔森同时存在RyhB1和RyhB2外,绝大多数只有1个RyhB,研究表明,当铁缺乏时RyhB通过下调细胞内非必需铁蛋白的合成,RyhB本身的表达则受到负调控因子Fur的影响以维持体内铁平衡[18]。KP的RyhB大小为91 bp,大肠埃希菌的RyhB大小为90 bp,两者之间的同源性为92.3%,大肠埃希菌RyhB基因位于yhhX和yhhY之间,而KP的RyhB基因位于yhhY和虚拟蛋白ORF之间。目前美国临床和实验室标准协会还未制订检测KP生物膜形成的标准方法,寻找一种快速、灵敏度和特异度均高的可用于临床标本检测的方法,对生物膜相关性感染的治疗和清除生物膜药物的筛选有十分重要的临床意义。本研究采用qPCR法扩增4种不同耐药表型KP的RyhB基因,其中产ESBLsKP和MDRKP 存在特异性条带,CRKP 和HvKP不存在特异性条带,通过RyhB基因表达与KP生物膜形成能力的关联性分析表明,RyhB基因是影响KP生物膜形成的重要调节因子之一。

