白消安纳米给药系统研究进展
杨思琪,夏桂民,刘秀均
白消安是一种抗肿瘤的烷基磺酸盐,化学名为 1,4-丁二醇二甲磺酸酯(图1),白色结晶固体,不溶于水,微溶于丙酮和乙醇。1959年首次用于治疗慢性粒细胞白血病,能有效缓解症状及改善患者状态。现广泛用于造血干细胞移植前的预处理方案中。所谓预处理就是指在输入健康的造血干细胞以前,对患者进行大剂量化疗以清除患者体内的异常细胞及肿瘤细胞,并破坏患者的免疫系统以减少对移植的排斥反应,这是造血干细胞移植的中心环节之一。造血干细胞移植是目前治疗急性髓系白血病、地中海贫血和 NK/T 细胞淋巴瘤等血液学恶性肿瘤和免疫缺陷等疾病不可或缺的治疗手段[1]。白消安对造血干细胞的抑制杀灭作用是骨髓移植成功的重要环节之一。基于白消安和环磷酰胺合用组成的清髓方案由于不需要特定的设备和专业人员操作等原因,具有耐受性好及毒性低等优点成为标准的预处理方案[2]。传统上,大多数骨髓移植方案中使用白消安的标准剂量为4 mg/(kg·d),为期 4 d。由于白消安治疗范围较窄且药动学参数个体差异较大,适宜的血药浓度对其药效的发挥有重要影响。白消安的血浆暴露量过高会发生肝静脉闭塞性疾病、间质性肺炎和细胞因子风暴等致死性不良反应,而系统暴露量不足又会导致移植失败或复发,缩短患者的生存时间[3]。对白消安的药物浓度进行监测可更好发挥其作用并减少不良反应发生的概率。但由于白消安在不同患者体内的吸收清除速率存在较大差异,其不可预测的生物利用度和药代动力学分布对建立普适性的药物浓度检测方法带来困难[4]。目前需要进行更多药效学研究以建立全身暴露白消安和疗效之间的量效关系,尤其是在接受骨髓移植的儿童中,基于已知药理学参数精确且有效的白消安血浆水平监测与剂量调整相结合可改善接受骨髓移植患者的临床治疗效果。
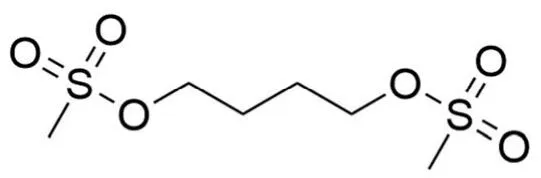
图1 白消安结构式
静脉给药可能是解决患者生物利用度变异性和剂量调整困难等问题的一种方法,由于其特殊的理化性质(在水、油及多种有机溶剂中溶解性极差),白消安在很长一段时间以来只能以口服的形式给药。口服白消安的肠道吸收具有不稳定性和不可预测性使其生物利用度有较大的变化,从而导致肝静脉闭塞性疾病、肺纤维化等一些不良反应的发生。肠胃外给药通过将血浆药物浓度保持在治疗范围内的最小波动来克服口服给药出现的问题,从而显著降低毒副作用。Busulfex®是唯一商业上可获得的白消安肠胃外制剂,用共溶剂法由 33% 的 N,N-二甲基乙酰胺和 67% 的聚乙二醇400 溶解白消安制得。由于白消安非常容易发生水解,其静脉注射液具有较差的物理和化学稳定性,用 5% 葡萄糖注射液或 0.9% 氯化钠注射液重建后仅稳定 7 个小时[5]。且该制剂具有若干缺点,使用高浓度的二甲基乙酰胺具有较高的肝毒性、肾毒性和中枢神经系统副作用,如幻觉、思维混乱和嗜睡等。基于此,通过对白消安进行结构或剂型的改造,可增大其生物利用度,改善药代动力学参数变异性,是解决上述问题的有效方法。另一方面有望改善白消安的体内分布尤其是肿瘤组织的特异分布,使其不仅能作用于血液系统肿瘤,还能对实体瘤发挥疗效。苏消安是白消安的二羟基结构改造物(图2),已在欧洲几个国家被批准用于晚期卵巢癌的治疗[6]。这一应用说明白消安的结构改造物用于实体瘤治疗的可行性,研发白消安的纳米制剂并将其用作实体瘤治疗药物具有很大的可能性。科学家就白消安的新剂型做了诸多探索和研究,纳米递送系统相较传统制剂具有诸多优点,有望成为一种新型高效低毒的制剂。
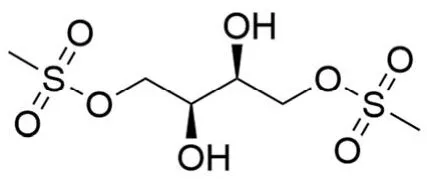
图2 苏消安结构式
使用纳米给药系统将药物靶向到特定的身体部位可能是解决药物体内不稳定、生物利用度差、溶解性差、体内吸收不良等问题的一种有效手段,纳米颗粒能在血液循环系统中停留较长时间,并能缓慢地释放药物,使血浆中药物浓度波动较小,减少不良反应。近年来,根据药物的理化性质选择不同的纳米材料作为载体制备纳米递送系统已取得较快的发展,在设计靶向药物递送系统时,有机、无机纳米结构如胶束、脂质体和金属骨架等常常用作药物载体[7]。溶解度极低的药物具有多种药物传递问题,包括口服后生物利用度有限、外膜扩散能力较小、给药时需要更多的静脉注射量和不必要的补充等,这些限制都可以通过将纳米技术应用于药物传递系统来克服。纳米结构作为载药系统提供药物的方式可概括为两种:一种是药物主要通过疏水效应被结合在结构的内腔中,当纳米结构材料靶向递送到特定的位置时,药物可以从内腔中缓慢释放;另一种方式是药物直接与纳米载体材料结合,在这种方法中药物释放的时间是至关重要的,因为药物可能在未到达靶点时就与载体分离,达不到靶向控释的目的[8]。虽然纳米技术应用于药物递送有诸多优点,但纳米粒子作为载体材料所表现出的毒性问题也是不容忽视的。理想的纳米给药系统是能将药物递送到体内特定器官发挥药效的同时又几乎没有毒副作用,科学家们正在为实现这一目标不断探索。目前已有不少纳米药物上市后在临床运用取得成功的实例,白消安纳米递送系统的研究还处于实验室阶段,相信在不久的将来会取得实质性进展。本文对国内外有文献报道的白消安相关纳米制剂的研究归纳概述如下。
1 白消安脂质体
脂质体是以磷脂为基础的小泡,能将许多药物输送到体内的特定部位。脂质体的分布取决于它们的大小、电荷和组成,这使其能够进入不同的器官。理论上无论药物的溶解度如何,都可以由于其结构的多样性而被纳入脂质体,两性霉素 B、顺铂、甲氨蝶呤和阿霉素是脂质体制剂的临床应用实例。有研究人员早在 1998年就以磷脂酰胆碱(EPC)、1,2-二烯醛基-sn-甘油-3-磷酸(DOPA)和胆固醇(CHOL)为原料制备了包载白消安的单层囊泡脂质体[9]。
继而对制得的白消安脂质体进行大鼠和人体内的药代动力学和对小鼠骨髓的影响等系列体内外活性评价。在大鼠体内研究发现白消安脂质体的药代动力学参数与静脉注射游离白消安相比,白消安脂质体有较高的表观分布体积和较长的消除半衰期。白消安脂质体在(0.5 ± 3.5)mg/kg 范围内显示的药代动力学与游离白消安相当。用14C 标记的白消安体内分布研究结果表明,和游离白消安相比,白消安脂质体在骨髓和脾脏中的放射活性在 18 h 以上,显著升高(P< 0.01)。说明它以骨髓和脾脏为靶点,在肝脏或其他已知的白消安毒性器官中没有蓄积,是一种很有前途的临床试验制剂[10]。Hassan 等[9]对 12 例患者(6 名成人和 6 名儿童)单次给予低剂量白消安脂质体进行人体内的药代动力学研究,结果显示白消安脂质体在人体内的药代动力学在低剂量和高剂量时都呈现良好的线性关系。在低剂量白消安脂质体中,成人和儿童之间在药代动力学参数方面没有显著差异,也未检测到与白消安脂质体相关的毒性现象。实验观察到小鼠静脉注射白消安脂质体后,在没有其他严重副作用的情况下产生了显著和持久的骨髓抑制,作用大于口服白消安,其生物利用度也很高,并具有良好的重现性。静脉给药的白消安脂质体克服了口服给药在婴幼儿和胃肠道并发症患者中的生物利用度低、个体间变异性高和剂量调整困难的问题。同时,适当大小的脂质体可靶向骨髓和脾脏并减少肺和中枢神经系统的药物暴露量[11]。
此外,Chobisa 等[5]使用卵磷脂、胆固醇、吐温 80 和甘露醇通过吸附-超声法制备白消安的前体脂质体制剂。采用 24 次全析因设计优化了囊泡尺寸和包封率,并用差示扫描量热法(DSC)、X 射线单晶衍射(PXRD)和透射电镜(TEM)对其外观及形态进行了表征。DSC 和 PXRD 研究表明,白消安以非晶化的形式存在于磷脂双层中,TEM图像证实了白消安具有多层水泡结构。最终优化后的处方可自发形成(74.0 ± 1.7)nm 大小的微粒,且包封率为(72.9 ±1.5)%,较早年白消安纳米递送系统不高于 10% 的包封率是个良好的突破。前脂质体制剂能显著提高白消安的物理化学稳定性,对 SD 大鼠的体内研究表明,与市售注射液相比,白消安的前脂质体制剂具有相当的免疫抑制活性(110.62%)和相对较好的生物利用度。
2 白消安与白蛋白形成的结合型纳米粒
白蛋白又称血清蛋白,是血浆蛋白中最常见的蛋白,其来源广泛,常见的有卵白蛋白、人血清白蛋白、牛血清白蛋白和基因重组人血清白蛋白,其中基因重组人血清白蛋白具有与血液分离的人血清白蛋白相似的结构和理化性质,能避免由血液分离白蛋白携带的病原体引起的交叉感染,是以白蛋白为纳米载体材料的主要研究热点[12]。白蛋白易溶于水且具有较长的半衰期(约 19 d),其三维结构中含有由疏水性和正电荷基团所组成的袋状结构域,能有效包载疏水性营养物质、维生素和甾体激素等分子[13],且因其自身的低毒性、低免疫原性和良好的生物相容性,是疏水性物质体内递送的天然载体,被广泛应用于多功能纳米递送系统。目前以白蛋白为载体的白消安纳米粒正处于研究阶段。据报道,K-Ras 基因突变的胰腺癌细胞表现出明显增强的巨胞饮功能来满足自身独特的营养需求,利用白蛋白作为巨胞饮介导的药物输送载体,理论上对 K-Ras 基因突变的胰腺癌细胞有较强的活性[14]。这一发现及白蛋白紫杉醇的成功上市使以白蛋白为载体的纳米递送系统成为研究热点,白消安白蛋白纳米粒研发成为高效低毒的临床用药具有较大的可能性。
3 由聚合物构建的白消安纳米粒
聚合物自发展成为药物载体以来一直受到广泛的青睐,源于其与脂质体或纳米混悬剂相比有较好的稳定性,且聚合物疏水的核结构更适合包载疏水药物。通过选用或合成不同结构的聚合物来构建智能响应或靶向释药的纳米粒,可以实现药物在治疗范围内以较小的副作用达到最好的疗效[15]。有研究报道白消安对几种合成的聚合物材料有较好的亲和力,这为白消安纳米给药系统的发展提供了新思路。
为了避免白消安的肝脏蓄积并防止其在水介质中迅速降解,许多人试图用纳米材料作为载体包载白消安,但由于白消安对许多纳米载体的亲和力较低,它在载体中往往负载量较低[约 ≤ 5%(w/w)]且释放速度较快,在制备过程中大量药物会从纳米粒子中泄漏。Layre 等[16]建立了以聚氰基丙烯酸异丁酯(PIBCA)为载体的新型复合壳纳米粒子,能包载比其他聚合物更多的白消安。但该纳米粒子疏水比表面积大,易被单核巨噬细胞系统迅速识别,几分钟内就被从血液中清除,而且重复使用会在肝脏和脾脏中累积,可能会增加肝静脉闭塞性疾病的发生。基于此,Layre 等[17]通过在疏水纳米粒子表面修饰聚己内酯-聚乙二醇(PCL-PEG)二嵌段共聚物以获得长循环纳米粒,制备了一种新型复合核-壳纳米颗粒,能够将 PIBCA 有效包封白消安的能力与PCL-PEG 的优异“隐身”性能结合起来。这种复合纳米粒子是在不添加任何表面活性剂的情况下,以不同的质量比将PCL-PEG 和 PIBCA 用共沉淀法制备所得,其中“核”基本上由 PIBCA 聚合物形成,“壳”由 PCL-PEG 二嵌段共聚物形成,与单个 PCL-PEG 纳米颗粒相比,使用 PIBCA形成核芯的纳米颗粒药物量增加 2~4 倍,混合物中PIBCA 含量越高,载药量越高。这种新型复合壳纳米粒子作为载体是疏水性药物制备纳米递送系统时提高包封率和载药量的不错选择。
考虑到白消安具有较高的偶极矩可能存在特定的偶极-偶极相互作用的情况[18],Layre 等[19]尝试了 5 种不同的聚氰基丙烯酸酯(PACA)聚合物来实现白消安的高效包封。通过纳米沉淀法制备纳米颗粒并对该聚合物进行处方优化,考察白消安在纳米颗粒中的完整性,并对其体外释药行为也进行了研究。结果显示,聚氰基丙烯酸异丁酯和聚氰基丙烯酸乙酯对白消安的包载效率[约为 5.9%(w/w)]最高,粒径约为 210 nm,纳米粒子的产率为 71%(w/w)。1H-NMR谱表明白消安在该聚合物纳米颗粒中能保持结构的完整性,且该聚合物中没有白消安的降解产物存在。分子模拟表明,白消安分子中丁磺酸基的甲基磺酸盐与 PIBCA 的腈基之间存在特定的偶极-偶极相互作用,可以解释 PIBCA 包封大量白消安的有效性。在水或大鼠血浆中的体外释药实验表明,纳米颗粒中的白消安在前 10 min 快速释放,在接下来的 6 h 缓慢释放。PIBCA 作为载体的纳米递送系统虽然有药物突释的缺点,但能避免白消安在制备过程中的降解且能保留白消安结构的完整性,如前所述可考虑用 PCL-PEG 等具有“隐身”性能的共聚物对载体表面进行修饰以克服突释问题。
用于治疗癌症的功能性纳米粒由于其固有的物理性质、长的血液循环时间、特异性靶向能力及较强的细胞摄取率引起广泛关注[20]。Ye 等[21]设计了含有磁性量子点和白消安的可生物降解聚合物囊泡,既能在体内实现多模态生物成像,又能将抗癌药物有效递送到特定器官发挥作用。他们采用乳化蒸发法将超顺磁性氧化铁纳米粒子(SPION)、掺锰硫化锌量子点(Mn:ZnS-QDs)和白消安包覆在聚乳酸(PLGA)纳米粒子中,制备了 PLGA 囊泡。在该纳米递送系统中,SPION 用于体内核磁共振成像,Mn:ZnS-QDs用于体外荧光成像。制备时首先将这两种作为成像剂的疏水性 SPION 粒子和 Mn:ZnS-QDs 分别制造成纳米级颗粒,接着通过水包油乳化法制备有效截留了成像剂和白消安的 PLGA 囊泡,随后在室温下蒸发挥发性有机相。制备出的纳米粒子粒径为 100 nm 左右,白消安在 PLGA 囊泡中的包封率为(89 ± 2)%。研究者根据负载的 Mn:ZnS-QDs固有的荧光特性,评估了 J774A 小鼠巨噬细胞系中PLGA-SPION-Mn:ZnS 纳米颗粒的细胞吸收效应。结果显示,用纳米颗粒处理的细胞在孵育 24 h 后具有最大的荧光强度,表明细胞对纳米粒子有较高的吸收效率。该载药系统的药物释放模型显示在初期会呈现一个突释过程,之后白消安以持续的速率缓慢释药 5~6 h,使用表面涂层或其他精确控制药物释放速率的方法可建立稳定的零级释放曲线。
诸如上述的多功能纳米载体聚合物囊泡可用于控制药物的传递、疾病发展的成像和治疗效果的随访,有望发展为疾病诊断和治疗的新工具。除上述 PLGA 囊泡外,Ye 团队[22]在后续的研究中又研发了包裹白消安和 SPION 的PEG-PCL 胶束,与 PLGA 聚合物囊泡相比,PEG-PCL 胶束无突释效应,药物能在给药后的 10 h 内缓慢持续释放。此胶束中白消安的包封率为 83%,荧光素标记的 PEG-PCL胶束显示对 J774A 细胞的体外摄取具有时间依赖性,培养24 h 后可观察到最大摄取量。采用活体荧光成像技术研究了 VivoTag 680 XL 修饰的 PEG-PCL 胶束在 Balb/c 小鼠体内 48 h 内的生物分布。通过活体器官显像和组织学检查,对实时活体成像结果进行分析,发现静脉给药后 4 h,PEG-PCL 胶束先在肺内高度分布,然后在肝脏和脾脏中重新分布和积累,且在所研究的主要器官中未发现任何病理损害。因此,具有生物相容性的可生物降解 PEG-PCL 胶束能有效负载造影剂和抗癌药物,是有效的多模式成像剂和良好的药物载体,该给药系统在体内具有较好的治疗效果和实时跟踪功能,对高效给药系统的设计具有重要意义。近年来,此类多功能响应性纳米药物递送系统由于其增强的渗透性和保留效应而被广泛研究用于癌症治疗,这些系统能够控制药物生物分布以响应特定刺激,无论是外源性的刺激(温度变化、磁性或光照)还是内源性的刺激(pH 变化或酶浓度)[23]。与传统给药系统相比,多功能纳米给药系统具有体内成像、多靶点功能和联合给药等方面的潜力,能有效地减轻化疗和常规给药方式对人体的损伤,为肿瘤的精准和个性化治疗提供了新思路。
4 金属有机骨架纳米粒
如前所述,白消安对可生物降解的聚合物纳米载体的亲和力较低,使其包封率也较低,且其原料药在纳米粒子的制备过程中往往会发生药物结晶等问题,阻碍了白消安在纳米递送系统方面的发展[24]。为了安全使用,纳米悬浮液不应含有任何游离的白消安晶体。为了克服这些缺点,Chalati等[25]在 2011年以多孔结晶铁(Ш)羧酸盐为载体制备的金属有机骨架(MOFs)纳米粒显示出了较高的白消安包载量(25%)。这意味着当药物剂量达到治疗目的时所需载体材料的数量可以相应地减少,可以增强给药时患者的依从性,无论从工业方面和适用性方面都有一定的竞争优势。MOFs仅通过强离子共价键、无机亚基和易于调节的有机接头(羧酸盐)连接,具有较高的孔隙率和较规则的结晶骨架。在MOFs 纳米系统中最大的优点是没有白消安晶体,在以往的研究中,由共沉淀法制备白消安负载的纳米粒子常会在悬浮液系统中形成大量的白消安晶体。而 Chalati 等采用简单的混悬方法将白消安浸渍到悬浮的纳米粒子空隙中,避免了白消安的结晶。因为在整个包封过程中,白消安的增溶介质是相同的,且该溶剂中的最大溶解度仅为药物最大溶解度的80%。在包封过程中,当白消安被吸附到纳米粒子的孔隙中时,介质中白消安的浓度降低避免了其在溶液中过饱和结晶析出。总之,MOFs 纳米粒因其较高的孔隙率以及亲水-疏水的内部微环境很好地适应了白消安的两亲性,制备出了白消安包载量高达 25%、粒径大小保持在(140 ± 25)nm 范围的纳米递送系统。MOFs 作为载体保持了白消安原有的分子形式,防止了其结晶和降解,且白消安能从载体中完全释放出来,MOFs 纳米粒具有组成、结构、孔径可调,孔容大、无毒性等特点,具有良好的应用前景。
对该白消安的 MOFs 纳米粒进行药动学研究。结果表明,与市售的白消安注射液 Busulfex®相比,在前 8 小时,MOFs 纳米粒的血清白消安浓度较低,24 h 后,两种剂型的白消安在器官中的积累没有明显的差异[24]。在尿液中可观察到,与包载了白消安的纳米粒相比,空的 MOFs 纳米粒的清除速度更快,这可能是由于药物掺入后纳米粒的表面电荷从负电荷到正电荷的电位变化所致[26]。
金属纳米材料不仅可以作为载体包载白消安,还有研究表明金属纳米粒如银粒子与白消安共同作用能增加白消安的疗效。银纳米颗粒和白消安对 THP-1 细胞有广泛的细胞毒性。银纳米颗粒是由其自身的纳米尺寸、比表面积和表面功能化而产生的细胞毒性。白消安的细胞毒性是由于其能导致 DNA 的烷基化,这种烷基化导致 DNA 交联,使 DNA的复制和翻译受阻。银纳米粒具有的协同效应在抗肿瘤方面起着重要作用,有助于药物在癌细胞中聚集和运输,并阻碍肿瘤的代谢和增殖。当银纳米粒与白消安混合使用时,银纳米粒可能会破坏细胞膜,导致细胞的通透性被破坏,从而增加对药物的吸收。研究发现,银纳米粒与白消安的联合使用比单独使用白消安具有更好的抗瘤活性[27]。
5 结论与展望
白消安是一种独特的双功能烷化剂,低剂量白消安用于慢性粒细胞白血病的缓解治疗,其主要针对机体中缓慢增殖或非增殖细胞,在杀死白血病细胞的同时还会导致正常组织损伤;高剂量白消安常与环磷酰胺或其他细胞毒药物联用作为造血干细胞移植前的预处理方案,基于白消安的联合用药是全身放射治疗的重要替代方案,许多临床试验证明了此方案有较好的疗效[28]。不幸的是,不可预测的胃肠道吸收和个体间差异显著的生物利用度限制了白消安的大量使用,实现此药的胃肠外给药是解决上述问题行之有效的方法,但白消安的低溶解度和在水性介质中较差的稳定性阻碍了这一方法的发展。
近年来,纳米给药系统为许多限制化疗的药物提供了新的策略[29]。随着纳米给药系统对肿瘤治疗研究的深入,实现抗癌药物的靶向控制,以纳米技术为基础的药物递送系统在肿瘤诊断及治疗中的应用是一种可行且有效的策略[30]。它能在很大程度上缓解诸如白消安这类难溶性化疗药物的生物利用度差和个体间差异大等问题,还能克服体内许多如生物、生物物理和生物医学方面阻碍抗癌药物成功传递的屏障,以一种持续、控释的方式提供抗癌药物到特定的部位[31],减少药物的毒副作用,是一种精准高效的给药方式。但是,白消安自应用于临床以来至今仍无纳米递送系统问世,尽管科学家们为此做了诸多探究,目前为止与其相关的纳米递送系统仍处于实验室研究阶段。究其原因可能为:①小分子药物白消安与纳米载体的亲和力较低,制备时只有少部分药物晶体能与载体有效结合,且制备完成后药物也可能从载体中泄漏;②白消安在水中容易发生水解,降解生成四氢呋喃和甲磺酸并失活,制备时限制了水性介质的使用;③白消安在水性介质中还容易结晶,在制备过程中会有药物晶体析出,安全的纳米悬浮液不应含有任何白消安晶体。上述问题可能是限制白消安纳米递送系统发展的一些因素,虽然其研究开发存在一定的难度,但基于白消安对干细胞抑制作用的清髓方案是骨髓移植的中心环节之一,白消安在骨髓移植中具有不可或缺的地位,结合其目前使用中遇到的问题,开发白消安的纳米递送系统能解决实际问题,意义重大。可考虑对现有纳米载体的结构进行改造或开发新的适用于包载白消安的载体材料来制备相关纳米递送系统,以期获得安全有效、毒副作用小、包载效率高的纳米载体,让白消安更好地发挥临床作用。

