干扰COX2基因对罗氏沼虾生长及能量代谢酶活性和基因表达的影响
贾垂攀 戴习林 尹丹慧 黎兰诗 梁震宇 成良峰 陈昕


摘要:【目的】從能量代谢的角度探索罗氏沼虾生长缓慢的原因,为分析和解决罗氏沼虾生长缓慢问题提供参考。【方法】利用合适浓度的siRNA抑制罗氏沼虾肝胰腺和肌肉中COX2基因的表达,分析肝胰腺和肌肉中线粒体呼吸链相关基因表达量和酶活性以及ATP含量的变化;通过持续抑制罗氏沼虾COX2基因的表达,分析其对罗氏沼虾生长的影响。【结果】siRNA对罗氏沼虾线粒体编码的COX2基因表达有抑制作用,在一定浓度范围内,随着siRNA浓度的增加抑制的作用越明显,超过一定的浓度范围的siRNA抑制作用不明显,浓度为2.0 μg/g的siRNA与0.8、1.5、3.0 μg/g的siRNA的抑制作用相比效果最好。罗氏沼虾注射siRNA后,肝胰腺和肌肉中的COX2基因表达量下调,ND1和ATP6基因表达量随之下调,COX、ATP合酶、CCR和ND的酶活性显著下降(P<0.05,下同),ATP含量降低。连续注射siRNA能持续抑制罗氏沼虾肝胰腺和肌肉中COX2基因的表达,随着siRNA注射次数的增加,抑制COX2基因表达的作用时间也增加,在注射4次2.0 μg/g siRNA虾的肝胰腺和肌肉中,COX2、ND1和ATP6的基因表达量持续下调的时间最长,COX、ATP合酶、CCR和ND的酶活性能长期保持在显著低于对照组的水平,ATP含量也显著低于对照组。随着肝胰腺和肌肉中COX2基因表达被抑制时间的增加,罗氏沼虾的体长与体重增加量越小,养殖28 d后,注射1次siRNA和注射4次siRNA的虾的体重净增长分别为0.59和0.34 g。【结论】当参与ATP合成的酶的基因表达量和酶活性长时间受到抑制时,会抑制罗氏沼虾的生长。
关键词: 罗氏沼虾;细胞色素C氧化酶;siRNA干扰;能量代谢;生长
中图分类号: S917.4 文献标志码: A 文章编号:2095-1191(2021)12-3274-12
Effects of interference with COX2 gene on growth and energy metabolism enzyme activity and gene expression of Macrobrachium rosenbergii
JIA Chui-pan, DAI Xi-lin*, YIN Dan-hui, LI Lan-shi, LIANG Zhen-yu,
CHENG Liang-feng, CHEN Xin
(National Demonstration Center for Experimental Fisheries Science Education(Shanghai Ocean University)/Key Laboratory of Exploration and Utilization of Aquatic Genetic Resources(Shanghai Ocean University)/Shanghai Collaborative Innovation of Aquatic Animal Genetics and Breeding(Shanghai Ocean University),
Shanghai 201306, China)
Abstract:【Objective】Explored the reasons for the slow growth of Macrobrachium rosenbergii from the perspective of energy metabolism,and provide a reference for analyzing and solving the problem of slow growth of M.rosenbergii. 【Method】siRNA was used to inhibit the expression of COX2 gene in hepatopancreas and muscle of M. rosenbergii, and the changes of gene expression and enzyme activity of mitochondrial respiratory chain and ATP content in hepatopancreas and muscle of M. rosenbergii were analyzed. The effect on growth of M. rosenbergii was analyzed by consistently inhibi-ting gene expression of COX2. 【Result】siRNA could inhibit the expression of COX2 gene of M. rosenbergii. Within a certain range of concentration, the inhibition became more obvious with the increase of siRNA concentration, and the inhibition was not obvious beyond a certain range of concentration. siRNA at 2.0 μg/g showed the best inhibitory effect compared with 0.8, 1.5 and 3.0 μg/g siRNA. After siRNA injection, COX2 gene expression was down-regulated in hepatopancreas and muscle of M. rosenbergii, as well as the expression of ND1 and ATP6 genes, COX, ATP synthase, CCR and ND enzyme activities were significantly decreased (P<0.05, the same below), and content of ATP was decreased in hepatopancreas and muscle. Continuous injection of siRNA could continuously inhibit the expression of COX2 gene in hepatopanax and muscle of M. rosenbergii. With the increase of the number of siRNA injection, the inhibition time of COX2 gene expression also increased. In the hepatopancreas and muscle of shrimps injected 2.0 μg/g siRNA for 4 times,the expression of COX2、ND1 and ATP6 genes were continuously down-regulated for the longest time, and the activities of COX, ATP synthase, CCR and ND enzymes were significantly lower than control groups for a long time, and the content of ATP was also significantly lower than control groups. The body length and weight gain of M. rosenbergii decreased with the increase of inhibition time of COX2 gene expression in hepatopancreas and muscle. After 28 d of culture, the net weight gain of shrimp injected with siRNA one time and four times was 0.59 and 0.34 g. 【Conclusion】When the gene expression and enzyme activity of enzymes involve in ATP synthesis are inhibited for a long time,it will inhibit the growth of M. rosenbergii.
Key words: Macrobrachium rosenbergii; cytochrome C oxidase; siRNA interference; energy metabolism; growth
Foundation item: Shanghai Shrimp Industrial Technology System Construction Project(Hunongkechan〔2014〕5)
0 引言
【研究意义】罗氏沼虾(Macrobrachium rosenbergii)是我国重要的经济虾类之一,在江浙沪地区大范围养殖,具有生长速度快、营养价值高等优点。随着罗氏沼虾产量及养殖产业规模发展的不断提高,近年来铁壳虾的出现使罗氏沼虾养殖产业受到重创。铁壳虾通常出现性早熟的现象,且性腺发育需要大量能量支持。因此,从能量代谢方面探究罗氏沼虾生长缓慢的原因,对解决罗氏沼虾生长阻滞问题具有十分重要的意义。【前人研究进展】目前影响罗氏沼虾生长的主要原因还没有确切的定论。史建华等(2001)认为种质退化影响了罗氏沼虾的生长。Chen和Chen(2003)的试验表明罗氏沼虾养殖用水pH范围应在6.8~8.2,pH低于6.2则罗氏沼虾生长、蜕壳次数和存活率显著降低。黎东(2013)认为水中重金属离子会阻碍罗氏沼虾的生长。Chand等(2015)发现罗氏沼虾在盐度为10的养殖水中生长最佳,体质量比在淡水中增长的多。Mente等(2016)研究得出肠道菌群对罗氏沼虾的蜕壳有显著影响。戴习林等(2016)认为养殖密度会对罗氏沼虾的生长产生影响。孙海峰(2017)发现生长欠佳的罗氏沼虾眼柄中甲基法尼脂、20-羟基蜕皮酮、蜕皮激素受体和维甲酸受体的表达水平显著低于生长正常的虾,而蜕皮抑制激素表达水平显著高于生长正常的虾,推测这些基因表达的变化抑制了虾蜕壳。周俊名等(2017)发现生长正常的罗氏沼虾池塘中肝肠胞虫病毒(EHP)、传染性皮下及造血组织坏死(IHHNV)和白斑病毒(WSSV)病毒的阳性检出率显著低于生长欠佳的池塘,推测特定病原感染可能会导致罗氏沼虾生长缓慢。此外,国内外学者还在抗生素、水质、养殖水体的金属离子(王亚斌等,2008;Tavabe et al.,2013;孙龙生等,2015)等方面探究了对罗氏沼虾生长的影响。张俊功等(2020)发现雌雄虾比例为1∶1时,特定生长率高于比例为1∶2和1∶3时,同时水温26 ℃时,虾的绝对生长能最高。另外,接近性成熟的虾会优先将能量分配到性腺发育中,使生长受到一定影响(袁锐等,2017)。管政兵等(2012)切除克氏原螯虾的眼柄之后发现,其卵巢后期的NADH脱氢酶(NADH dehydrogenase,ND)、细胞色素C氧化酶(Cytochrome C oxidase,COX)和ATP合酶亚基6(ATP synthase subunit 6,ATP6)基因表达量上升,其中原因是卵巢后期要合成大量的卵黄蛋白,细胞需要大量能量。张海恩等(2021)发现中国对虾的养殖密度越高,虾体内三羧酸循环活性降低,有氧代谢受到抑制。相关研究表明,400尾/m3养殖密度下虾的体重增加量显著低于200尾/m3养殖密度,但其三羧酸循环活性低于200尾/m3養殖密度,说明密度胁迫对有氧呼吸产生影响,有氧呼吸能量代谢强度与中国对虾的生长有一定联系。饲料中添加高水平的磷和铜会使虾蟹肝胰腺中ATP含量和参与ATP合成酶的基因及酶活性升高,使虾蟹生长速度加快(Shi et al.,2021;Zhao et al.,2021)。【本研究切入点】关于罗氏沼虾生长缓慢的原因,国内学者多从病害、营养、水质及养殖管理等方面进行研究;在罗氏沼虾能量代谢的研究中,也仅从能量收支角度探究了罗氏沼虾能量分配的问题(朱其建等,2019;张俊功等,2020)。而罗氏沼虾生长及参与能量合成的酶之间的关系目前仍鲜有报道。【拟解决的关键问题】探究细胞色素C氧化酶亚基2(Cytochrome C oxidase subu-nit 2,COX2)基因表达下调对线粒体能量代谢相关基因表达量和酶活性的影响,以及参与ATP合成的酶活性对罗氏沼虾生长的影响,为进一步分析和解决罗氏沼虾生长缓慢问题提供参考。
1 材料与方法
1. 1 试验材料
试验用虾为在上海申漕特种水产开发公司培育的罗氏沼虾生长快速品系的子九代虾。挑选体长8~10 cm、体重16~22 g、四肢健全、无病无外伤的子八代作为亲本,在上海市金山区申漕特种水产有限公司的育苗车间孵化子九代无节幼体。将同一批变态的仔虾放到水泥池(3.0 m×7.0 m×1.5 m)中养至体重1.5 g左右,挑选合适规格的虾备用。
1. 2 试验方法
1. 2. 1 引物和siRNA设计及制备 在www.ncbi.nlm.nih.gov上检索罗氏沼虾NADH脱氢酶亚基1(NADH dehydrogenase subunit 1,ND1)(YP_214007.1)、COX2(KU745278.1)、ATP6(YP_213999.1)的编码序列,并用Blast设计荧光定量PCR的引物,选择罗氏沼虾的18S DNA作为内参引物。由生工生物工程(上海)股份有限公司根据罗氏沼虾COX2的完整mRNA序列设计一条siRNA和一条无意义的siRNA(NgsiRNA),引物和siRNA均由生工生物工程(上海)股份有限公司合成并验证(表1)。
1. 2. 2 siRNA剂量的筛选试验 试验组分别注射4个不同剂量的siRNA,为0.8、1.5、2.0和3.0 μg/g;对照组分别注射与试验组相同体积的NgsiRNA和DEPC水。每组30只虾(1.5±0.25 g),水温(26±1)℃,pH 7.8±0.5。养殖用水为加海水晶的深井水,盐度0.7~0.8,每组虾在容积90 L的蓝色塑料箱中暂养1个星期后,开始注射试验。注射部位为头胸甲基部腹膜,注射后每隔1 d从每组中随机取5只虾提取肝胰腺和肌肉组织,置于-80 ℃冰箱中保存,用于测定基因表达量和酶活性。
1. 2. 3 能量代谢酶基因表达量和酶活性测定 最适注射剂量确定后,测定最适剂量组肝胰腺和肌肉中ND1、ATP6的基因表达量和COX、ND、ATP合酶、细胞色素C还原酶(Cytochrome c reductase,CCR)4种酶的活性及ATP含量变化。
1. 2. 4 养殖试验 设计4个试验组、4个阴性对照组及1个空白对照组。试验组的虾分别注射1次、2次、3次和4次siRNA(2.0 μg/g),阴性对照组的虾分别注射1次、2次、3次和4次DEPC水,空白对照组不进行任何注射处理。每次注射间隔7 d。每组3个平行,每个平行10只虾(1.5±0.25 g)。各组从第1次注射开始计算,共养殖28 d。水温、盐度、pH与1.2.2保持一致,每2 d换水1/3。按照总体重的15%投喂新鲜的螺蛳肉泥,每天投喂2次(上午10:00和下午18:00),每天晚上集中排污1次。试验开始前测量虾的初始体长和体重,试验结束后测量虾的终末体长和体重,并收集肝胰腺和肌肉组织,每个平行取3只虾混样保存于-80 ℃冰箱。
1. 2. 5 总RNA提取及反转录和荧光定量PCR检测
取30~50 mg的肝胰腺和肌肉组织,按照TRNzol Universal Reagent[天根生化科技(北京)有限公司]使用说明书,提取总RNA并用1%琼脂糖凝胶电泳检测总RNA的质量。使用Fastking RT Kit(with gDNase)[天根生化科技(北京)有限公司]反转录试剂盒反转录出cDNA的第一条链,保存于-20 ℃冰箱备用。使用FastFire qPCR PreMix[天根生化科技(北京)有限公司]荧光定量试剂盒进行荧光定量试验。20.0 μL反应体系:2×FastFire qPCR PreMix 10.0 μL,上、下游引物各0.6 μL,cDNA 0.8 μL,ddH2o 8.0 μL。扩增程序:95 ℃预变性1 min;95 ℃变性5 s,60 ℃ 15 s,进行39个循环。
1. 2. 6 酶活测定 (1)线粒体蛋白的提取及浓度测定。按照线粒体蛋白提取试剂盒(南京建成生物科技有限公司)提取线粒体蛋白,-80 ℃冰箱保存。采用BCA蛋白浓度试剂盒(上海岚派生物科技有限公司)处理蛋白溶液样品,用酶标仪(KHB ST-360)在560 nm波长处测量吸光度值。根据标准蛋白吸光度,计算样品蛋白质浓度,用于酶活性的计算。(2)线粒体呼吸链酶活力测定。采用ND、CCR、COX和ATP合酶试剂盒(酶联免疫吸附法,上海岚派生物科技有限公司)处理蛋白液样品,用酶标仪(KHB ST-360)在450 nm处测量吸光度值,绘制标准曲线,计算样品酶活力。
1. 2. 7 生长指标计算 根据以下计算公式计算:体重净增长ΔW(g)、体长净增长ΔL(cm)、体长增长率WGR(%)、体重增长率LGR(%)、特定生长率(%/d)、体重净增长减少比P(%)。
ΔW=WT-W0
ΔL=LT-L0
LGR(%)=(LT-L0)/LT×100
WGR(%)=(WT-W0)/WT×100
SGR(%)=(lnWT-lnW0)/t×100
P(%)=(ΔWDEPC-ΔWsiRNA)/ΔWDEPC×100
式中,LT是试验结束后虾的长度,L0是试验开始时虾的长度,WT是试验结束后虾的重量(湿重),W0是试验开始时虾的重量(湿重),t是养殖天数,ΔWDEPC是对照组的体重净增长值,ΔWsiRNA是试验组的体重净增长值。
1. 3 統计分析
使用WPS 2019处理试验数据;利用2-ΔΔCt方法计算相对基因表达量;采用SPSS 17.0进行单因素方差分析(One-way ANOVA)、Duncan法进行多重比较。
2 结果与分析
2. 1 肝胰腺和肌肉中COX2基因表达干扰结果分析
由图1和图2可知,siRNA(0.8 μg/g)、siRNA(1.5 μg/g)、siRNA(2.0 μg/g)、siRNA(3.0 μg/g)在肝胰腺有显著的抑制作用(P<0.05,下同);siRNA(0.8 μg/g)、siRNA(1.5 μg/g)、siRNA(2.0 μg/g)在肌肉中有显著的抑制作用,siRNA(3.0 μg/g)在肌肉中无显著抑制作用,与对照组无显著差异(P>0.05,下同)。综上,siRNA(2.0 μg/g)干扰的效果最佳。从注射siRNA(2.0 μg/g)后的第1~7 d,肝胰腺和肌肉中COX2表达量显著低于对照组,且随时间增加表达量逐渐降低,至第7 d时达最低;第7 d时siRNA(2.0 μg/g)组肝胰腺中COX2表达量为NgsiRNA的37%,肌肉中COX2表达量为NgsiRNA的45%,有效干扰时间为7 d。故选2.0 μg/g的剂量作为养殖试验的最适注射剂量。
2. 2 肝胰腺和肌肉中ND1和ATP6基因表达量的变化
由图3-A和图3-C可知,在注射siRNA(2.0 μg/g)的虾的肝胰腺中,ND1和ATP6基因表达量随时间的增加而下调,从注射后第3 d开始ND1和ATP6基因表达量显著低于对照组,2个基因的表达量在第7 d时达最低值。由图3-B和图3-D可知,肌肉中的ND1和ATP6基因表达量随时间的增加而下调,ATP6在注射后第5 d其表达量显著低于对照组,ND1在第3 d时的表达量显著低于对照组,2个基因表达量在第7 d时达最低值。2组对照组的ND1和ATP6基因表达量间无显著差异。可见,COX2基因表达量下调,ND1和ATP6基因表达量也下调。
2. 3 COX、ND、ATP合酶、CCR酶的活性变化
由图4-A和图4-B可知,注射siRNA(2.0 μg/g)的虾的肝胰腺和肌肉中COX的活性显著低于对照组,且随时间增加COX活性逐渐降低,说明COX2表达量下调,COX活性也随之降低。由图4-C、图4-E和图4-G可知,在肝胰腺中,CCR活性在注射后第3~7 d显著低于对照组,ND和ATP合酶的活性在注射后第5~7 d显著低于对照组。由图4-D、图4-F和图4-H可知,在肌肉中,ATP合酶和CCR的活性在第1~7 d显著低于对照组,ND的活性从第3~7 d显著低于对照组,且随时间增加上述3种酶活性逐渐下降。综上所述,肝胰腺中COX活性下降后CCR活性最先下降,而肌肉中,当COX的活性下降后,CCR和ATP合酶的活性最先下降,ND活性下降需要的时间比CCR和ATP合酶长。不同酶的活性变化时间点不同,推测有可能是这些酶在电子传递过程中与COX联系的紧密程度存在差异,与COX联系最紧密的酶最先受到影响。
2. 4 肝胰腺和肌肉中ATP含量变化
由图5-A可知,注射siRNA(2.0 μg/g)的虾肝胰腺中ATP含量在第5 d时显著低于对照组,而第1~3 d时其ATP含量与对照组无显著差异。由图5-B可知,肌肉中的ATP含量在第1 d与对照组无显著差异,从第3 d开始显著低于对照组,并随时间的增加ATP含量逐渐降低。可见,当ATP合酶、CCR、COX和ND的活性下降时,ATP含量也下降,说明参与ATP合成的酶的活性影响ATP合成。
2. 5 注射不同次数siRNA虾的ATP6、ND1和COX2基因表达量分析
由图6-A、图6-C和图6-E可知,只有注射4次siRNA的虾肝胰腺中ATP6、ND1和COX2的基因表达量显著低于DEPC组,其余3组中ATP6、ND1和COX2的基因表达量与DEPC组无显著差异。由图6-B、图6-D和图6-F可知,注射3次和4次siRNA的虾肌肉中ATP6、ND1和COX2的基因表达量均显著低于对照组,约为對照组的50%,其余2组恢复至DEPC组的85%以上。综上所述,siRNA作用时间较短,当siRNA失去作用后,基因表达量会逐渐恢复至原来的水平,通过持续间隔注射siRNA能延长干扰效果,且干扰效果在肝胰腺和肌肉中有所差别,肌肉中有效干扰时间长于肝胰腺。
2. 6 注射不同次数siRNA虾的COX、ATP合酶、CCR和ND的酶活性
由图7-A、图7-C、图7-E和图7-G可知,注射4次siRNA的虾的肝胰腺中COX、ATP合酶、CCR和ND活性仍显著低于DEPC组,但注射1、2和3次的虾ATP合酶、ND和CCR的活性均恢复至DEPC组的水平,注射3次siRNA虾的肝胰腺中,COX活性仍显著低于对照组。由图7-B、图7-D、图7-F和图7-H可知,注射3次和4次siRNA虾的肌肉中ATP合酶、CCR、ND和COX的活性均显著低于对照组,且注射次数越多,上述酶的活性越低,由此说明,对COX2基因表达持续干扰的时间越长,酶活性处于低于正常水平的时间也越长。
2. 7 注射不同次数虾ATP含量的差异分析
由图8-A和8-B可知,注射3次和4次siRNA虾的肝胰腺和肌肉中ATP含量显著低于注射1次和2次的,且显著低于对照组。注射4次siRNA虾的肝胰腺和肌肉中ATP含量最低。结果表明,COX2基因表达干扰的时间越长,酶活性的降低时间也越长,ATP产量也越低。进一步说明COX2基因表达量的下降会导致呼吸链酶活性下降,对ATP合成造成影响。
2. 8 注射不同次数siRNA对罗氏沼虾虾生长的影响
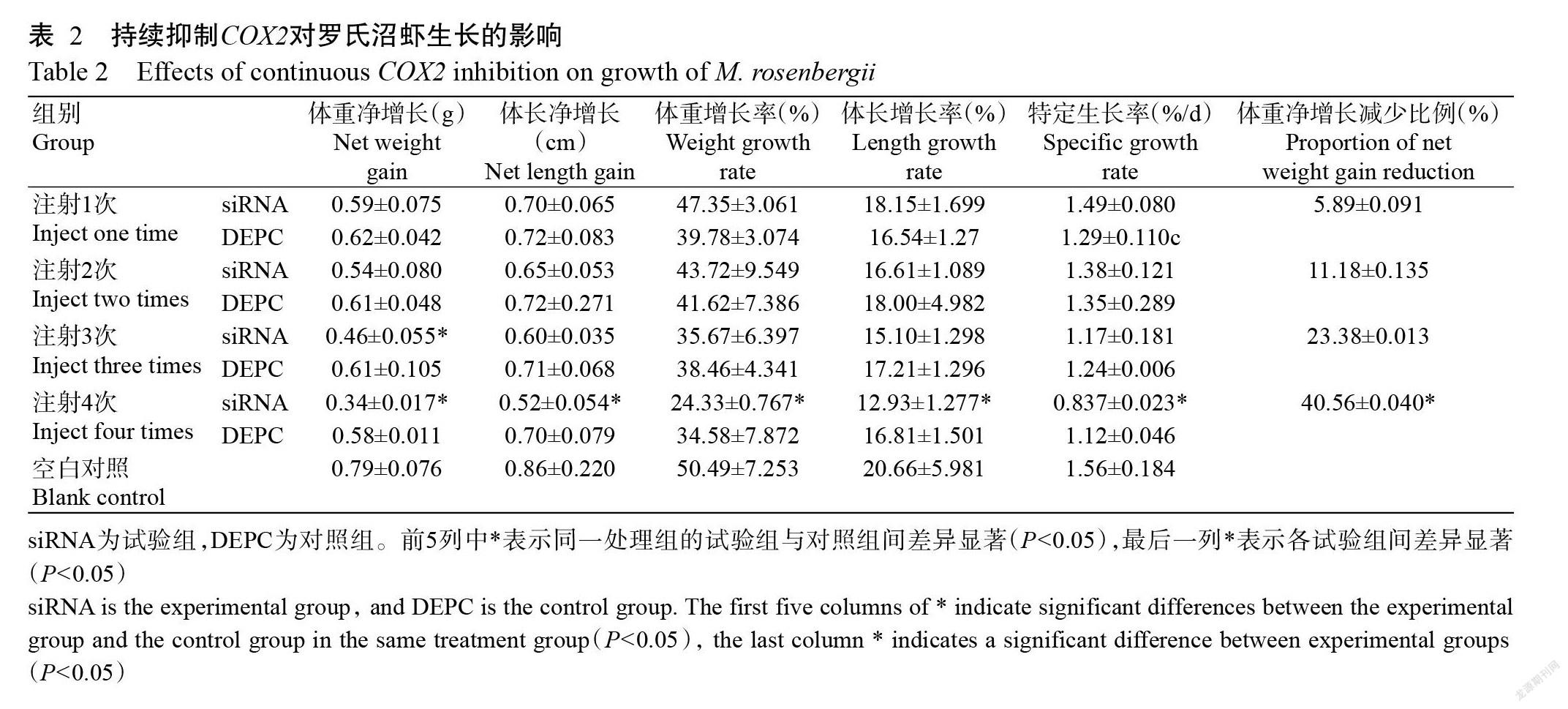
由表2可知,随着注射次数的增加,siRNA组体重净增长值逐渐降低,注射1次siRNA的虾体重平均增长0.59 g,注射2次平均增长0.54 g,注射3次平均增长0.46 g,注射4次平均增长0.34 g。虾的生长指标(除体重净增加减少比例外)由高到低依次排序为siRNA(注射1次)>siRNA(注射2次)>siRNA(注射3次)>siRNA(注射4次)。结果表明,随着抑制作用时间的延长,虾的生长速度逐渐变慢。注射1次的siRNA组的虾体重净增长值与注射1次DEPC水的虾体重净增长值无显著差异,注射3次和4次的siRNA组的虾体重净增长值显著低于注射相同次数的DEPC组。由此说明,短暂的呼吸链酶活性和ATP水平的降低不会对虾的生长造成显著影响,呼吸链酶长期处于低活性状态导致ATP也长期处于低水平状态,从而对虾的生长速度产生显著影响。结合2.7中空白对照组的4种酶活性(图7)显著高于siRNA组和DEPC组的研究结果,且生长速度也显著高于siRNA组和DEPC组,得出参与ATP合成的酶活性高低对罗氏沼虾生长的快慢有一定影响。
3 讨论
3. 1 siRNA的筛选及评价
王超等(2019)对牛肾细胞转染牛FOXM1的试验发现,作用效果最好的是1.5 μg/g剂量组而不是2 μg/g。Tan等(2020)在敲低罗氏沼虾胰岛素受体(MrIR)的试验中发现0.1 μg/g的siRNA对基因抑制无显著效果,0.5 μg/g效果最佳,而1.5和3.0 μg/g无显著抑制作用。袁伟(2020)在干扰罗氏沼虾toll样受体(MrTLR)的试验中发现,0.4 μg/g的注射剂量对MrTLR无明显抑制效果,而0.8和1.2 μg/g剂量的作用效果十分显著,且1.2 μg/g剂量的效果达最佳。本研究表明,4个siRNA注射剂量中2.0 μg/g剂量的干扰效果最好,说明在一定的范围内,siRNA的注射剂量越高干扰效果越好,2.0 μg/g siRNA的有效干扰时间也比其他3组时间长,与袁伟(2020)的结果相似,说明在合适的浓度范围内提高siRNA的浓度会延长siRNA的干扰时间。本研究中siRNA(3.0 μg/g)的注射剂量干扰作用在4个试验组中最差,与王超(2019)、Tan(2020)的试验结果相似,说明当siRNA超过一定剂量时,干扰作用会下降或起不到干扰作用。本研究结果证明,2.0 μg/g siRNA能抑制罗氏沼虾COX2基因的mRNA表达。同时发现了siRNA对甲壳动物线粒体编码的基因同样具有负调控作用,这可为以后siRNA对甲壳动物中线粒体基因的研究提供参考。
3. 2 COX2基因表达下调对参与ATP合成的酶的影响
本研究利用siRNA对罗氏沼虾线粒体编码的COX2基因表达进行下调,以探究呼吸链中其他参与ATP合成的酶(ND、CCR、COX、ATP合酶)的基因表达水平和活性的变化。结果显示,COX2基因表达量下调,COX的活性也会下降,与Gnipová等(2012)和Jia等(2017)的试验结果一致。表明COX2表达量的下调会导致COX活性降低。导致酶活下降的原因可能是COX2表达量下调使COX组装不完整,由于缺失催化中心的核心亚基,其他亚基迅速降解,从而导致酶的活性降低。
本研究结果得出,在肝胰腺中,当COX活性下降后,CCR活性最先下降,随后ND和ATP合酶的活性也下降;在肌肉中,当COX活性下降后,ATP合酶和CCR活性最先下降,随后ND活性下降。Gnipová(2012)研究发现细胞中COX的活性下降后会导致CCR的活性下降,因为CCR是活性氧(ROS)形成的主要部位之一,CCR活性增加和COX转移电子的能力受到损害时会导致细胞内产生更多的ROS,当COX功能衰弱,细胞色素C介导的呼吸作用会转移到其他末端氧化酶上,以减少ROS造成的氧化损害,因此,CCR活性下降可能是机体为避免线粒体中ROS升高对线粒体造成氧化损伤的一种调节方式。本研究中,COX活性下降后,CCR活性在肝胰腺和肌肉中最先下降,造成这一结果的原因可能是线粒体COX功能受损后,通过降低CCR活性以减少ROS带来的损害。
Furukawa等(2015)发现干扰COX2表达会造成线粒体膜电位下降。Ott等(2007)认为当电子传递链受到损害后,细胞中较高的ROS浓度可引起氧化应激造成氧化损伤,这种氧化损伤可能会改变线粒体蛋白质、DNA和脂质,导致线粒体功能失效,从而引起线粒体坏死或凋亡(Chuang,2010)。Zhao等(2011)研究认为,当呼吸链复合物中基因表达量和酶活下降时,细胞中OXPHOS(氧化磷酸化)系统的生化功能会改变,能量生成系统遭到损害。本研究结果显示,当COX2表达量被干扰后,ND1和ATP6基因表达量下降,ND、CCR和ATP合酶的活性下降,ATP含量下降。由此推测,COX2基因表达量被抑制后,COX功能受损,可能促使细胞内ROS水平上升,线粒体的OXPHOS系统功能紊乱,参与ATP合成的酶的活性和基因表达量被抑制,导致线粒体的能量生成系统被破坏,ATP产量下降。
3. 3 参于ATP合成的酶的活性对罗氏沼虾生长的影响
Zhao等(2021)研究发现,三疣梭子蟹肝胰腺中ATP含量越高,其体重增加越多;蟹肝胰腺中ATP含量含量较低,体重增加量少,且生長快速的三疣梭子蟹肝胰腺中与线粒体能量代谢相关的基因的表达显著上调。Shi等(2021)用不同含铜量的饲料投喂南美白对虾(Litopenaeus vannamei)发现,生长快的南美白对虾肝胰腺中ATPase(Cu-ATPase,NaK-ATPase,Mg-ATPase)、COX、柠檬酸合酶(CS)的活性和ATP含量均显著高于生长相对较慢的虾。上述研究表明,生长较快的虾和蟹肝胰腺中参与ATP合成的酶的活性和基因表达量高于生长较慢的虾蟹,且生长快的虾蟹中ATP含量水平也高(徐文杰等,2020)。本研究结果得出,虾的肝胰腺和肌肉中COX、ATP合酶、CCR和ND的活性和基因表达量以及ATP的含量均较低的虾的生长速度较慢,与前人研究结果相似。说明参于ATP合成的酶的活性速度高低影响着ATP的产生,进而影响甲壳动物的生长。
4 结论
干扰罗氏沼虾COX2基因的mRNA表达量,会使罗氏沼虾细胞色素C氧化酶的活性降低,且会导致参与ATP合成的酶的表达量和酶活性下降,导致能量代谢的功能降低,使ATP产量下降,结合生长试验得出参与ATP合成的酶的基因表达量和酶活性降低会显著抑制罗氏沼虾的生长。
参考文献:
戴习林,周梦颖,鞠波,过正乾,蒋飞,苏建,丁福江. 2016. 养殖密度对罗氏沼虾生长、性别分化与性腺发育的影响[J]. 水产学报,40(12):1874-1882. [Dai X L,Zhou M Y,Ju B,Guo Z Q,Jiang F,Su J,Ding F J. 2016. Effects of stocking density on growth,sexual differentiation and gonad development of Macrobrachium rosenbergii[J]. Journal of Fisheries of China,40(12):1874-1882.] doi:10. 11964/jfc.20140609340.
管政兵,水燕,周鑫,徐增洪,赵朝阳. 2012. 能量代谢相关基因在眼柄切除诱导克氏原螯虾卵巢成熟中后期的表达量[J]. 江苏农业科学,40(12):28-30. [Guan Z B,Shui Y,Zhou X,Xu Z H,Zhao C Y. 2012. Expression of energy metabolism related genes in the middle and late sta-ges of ovarian katuration of Procambarus clarkii induced by eyestalk removal[J]. Jiangsu Agricultural Sciences,40(12):28-30.] doi:10.3969/j.issn.1002-1302.2012.12.009.
黎东. 2013. Cu2+、Zn2+对罗氏沼虾生长以及卵巢发育的影响[D]. 湛江:广东海洋大学. [Li D. 2013. Effects of growth and ovarian development on Macrobrachium rosenbergii by Cu2+and Zn2[D]. Zhanjiang:Guangdong Ocean Universtity.] doi:10.7666/d.D329477.
孙海峰. 2017. 生长阻滞罗氏沼虾相关激素含量及其基因的表达[D]. 扬州:扬州大学. [Sun H F. 2017. The contents of the relative hormones and their gene expressions for growth retardant Macrobrachium rosenbergii[D]. Yangzhou:Yangzhou University.]
史建華,肖雨,徐琴英. 2001. 罗氏沼虾引种复壮技术的研究[J]. 水产科技情报,28(2):64-67. [Shi J H,Xiao Y,Xu Q Y. 2001. Studies on the introductional rejuvenated technique of Macrobrachium rosenbergii[J]. Fisheries Science & Technology Information,28(2):64-67.] doi:10.3969/j.issn.1001-1994.2001.02.013.
孙龙生,陈佳毅,吴骏,董学洪,马建社. 2015. 不同抗生素对罗氏沼虾育苗池水质及虾苗生长的影响[J]. 科学养鱼,(11):54-56. [Sun L S,Chen J Y,Wu J,Dong X H,Ma J S. 2015. Effects of different antibiotics on the water qua-lity of Macrobrachium rosenbergii nursery pond and the growth of shrimp larvae[J]. Scientific Fish Farming,(11):54-56.] doi:10.14184/j.cnki.issn1004-843x.2015.11.032.
王超,张淑琴,宋雪莹,王改丽,孙娜,郭利,程世鹏. 2019. 牛FOXM1基因特异性siRNA干扰效率的分析[J]. 黑龙江畜牧兽医,(19):1-4. [Wang C,Zhang S Q,Song X Y,Wang G L,Sun N,Guo L,Cheng S P. 2019. Interfering efficiency analysis of specific siRNAs targeting bovine FOXM1 gene[J]. Heilongjiang Animal Science and Vete-rinary Medicine,(19):1-4.] doi:10.13881/j.cnki.hljxmsy.2018.10.0320.
王亚斌,王军霞,刘存歧,张亚娟. 2008. 水质因子对罗氏沼虾生长及毒性的研究进展[J]. 河北渔业,(4):1-3. [Wang Y B,Wang J X,Liu C Q,Zhang Y J. 2008. Research progress of water quality factors on the growth and toxi-city of Macrobrachium rosenbergii[J]. Hebei Fisheries,(4):1-3.] doi:10.3969/ j.issn.1004-6755.2008.04.001.
徐文杰,韩士群,周庆,巫佳杰,陈婷. 2020. 饲料中添加抗氧化剂对鲫鱼抵抗藻毒素作用的影响[J]. 江苏农业学报,36(2):417-422. [Xu W J,Han S Q,Zhou Q,Wu J J,Chen T. 2020. Effect of dietary antioxidant on microcyst-induced toxicosis in crucian[J]. Jiangsu Journal of Agricultural Sciences,36(2):417-422.] doi:10.3969/j.issn. 1000-4440.2020.02.023.
袁锐,张朝晖,陈辉,方苹,陈静,刘训猛,吴亚锋,王晶晶. 2017. 罗氏沼虾“铁壳”现象及其防控研究进展[J]. 水产科学,36(3):383-390. [Yuan R,Zhang Z H,Chen H,Fang P,Chen J,Liu X M,Wu Y F,Wang J J. 2017. Phenomenon and research progress on prevention and control of ‘Iron Shell in giant freshwater prawn Macrobrachium rosenbergii[J]. Fisheries Science,36(3):383-390.] doi:10.16378/j.cnki.1003-1111.2017.03.022.
袁伟. 2020. RNA干扰不同类型TLR基因对罗氏沼虾免疫相关基因表达的影响和MyD88基因的片段克隆[D]. 上海:上海海洋大学. [Yuan W. 2020. The regulation of immune-related genes expression in Toll-like receptors silenced Macrobrachium rosenbergii and partial cloning of MyD88 gene[D]. Shanghai:Shanghai Ocean University.] doi:10.27314/d.cnki.gsscu.2020.000420.
张俊功,戴习林,丁福江. 2020. 水温和雌雄配比对罗氏沼虾能量代谢的影响[J]. 南方农业学报,51(7):1721-1728. [Zhang J G,Dai X L,Ding F J. 2020. Effects of temperature and female-male mating ratios on energy metabolism of Macrobrachium rosenbergii[J]. Journal of Sou-thern Agriculture,51(7):1721-1728.] doi:10.3969/j.issn. 2095-1191.2020.07.027.
張海恩,何玉英,李健,韩旭,谢拥军. 2021. 不同养殖密度对中国明对虾生长和能量代谢的影响[J]. 渔业科学进展,42(5):70-76. [Zhang H E,He Y Y,Li J,Han X,Xie Y J. 2021. Effects of different stocking densities on the growth and energy metabolism of Fenneropenaeus chinensis[J]. Progress in Fishery Sciences,42(5):70-76]. doi:10.19663/j.issn2095-9869.20200326001.
周俊名,戴习林,蒋飞,丁福江. 2017. 池养罗氏沼虾生长缓慢原因初步分析[J]. 上海海洋大学学报,26(6):853-861. [Zhou J M,Dai X L,Jiang F,Ding F J. 2017. The preliminary analysis of the reasons for the poor growth of Macrobrachium rosenbergii in pond[J]. Journal of Shanghai Ocean University,26(6):853-861.] doi:10.12024 /jsou.20170402024.
朱其建,鞠波,戴习林. 2019. 亚硝态氮对罗氏沼虾存活率、生长及能量代谢的影响[J]. 水产科技情报,46(1):14-18. [Zhu Q J,Ju B,Dai X L. 2019. Effect of nitrite nitrogen on survival rate,growth and energy metabolism of Macrobrachium rosenbergii[J]. Fisheries Science & Techno-logy Information,46(1):14-18.] doi:10.16446/j.cnki. 1001-1994.2019.01.004.
Chand B K,Trivedi R K,Dubey S K,Rout S K,Beg M M,Das U K. 2015. Effect of salinity on survival and growth of giant freshwater prawn Macrobrachium rosenbergii(de Man)[J]. Aquaculture Reports,2:26-33. doi:10.1016/j.aqrep.2015.05.002.
Chen S M,Chen J C. 2003. Effects of pH on survival,growth,molting and feeding of giant freshwater prawn Macrobrachium rosenbergii[J]. Aquaculture,218(1-4):613-623. doi:10.1016/S0044-8486(02)00265-X.
Chuang Y C. 2010. Mitochondrial dysfunction and oxidative stress in seizure-induced neuronal cell death[J]. Acta Neurologica Taiwanica,19(1):3-15. doi:10.3390/ijms20 143588.
Furukawa R,Yamada Y,Kawamura E,Harashima H. 2015. Mitochondrial delivery of antisense RNA by MITO-Porter results in mitochondrial RNA knockdown,and has a functional impact on mitochondria[J]. Biomaterials,57:107-115. doi:10.1016/j.biomat erials.2015.04.022.
Gnipová A,Panicucci B,Paris Z,Verner Z,Horváth A,Luke? J,Zíková A. 2012. Disparate phenotypic effects from the knockdown of various Trypanosoma brucei cytochrome c oxidase subunits[J]. Molecular and Biochemical Parasitology,184(2):90-98. doi:10.1016/j.molbiopara.2012. 04.013.
Jia H L,Ma M L,Zhai N,Liu Z G,Wang H F,Guo X Q,Xu B H. 2017. Roles of a mitochondrial AccSCO2 gene from Apis cerana in oxidative stress responses[J]. Journal of Inorganic Biochemistry,175:9-19. doi:10.1016/j.jinorgbio.2017.06.015.
Mente E,Gannon A T,Nikouli E,Hammer H,Kormas K A. 2016. Gut microbial communities associated with the molting stages of the giant freshwater prawn Macrobrachium rosenbergii[J]. Aquaculture,463:181-188. doi:10. 1016/j.aquaculture.2016.05.045.
Ott M,Gogvadze V,Orrenius S,Zhivotovsky B. 2007. Mitochondria,oxidative stress and cell death[J]. Apoptosis,12:913-922. doi:10.1007/s10495-007-0756-2.
Shi B,Lu J J,Hui X Y,Betancor M B,Zhao M M,Tocher D R,Zhou Q C,Jiao L F,Xu F M,Jin M. 2021. Dietary copper improves growth and regulates energy generation by mediating lipolysis and autophagy in hepatopancreas of Pacific white shrimp(Litopenaeus vannamei)[J]. Aquaculture,537:736505. doi:10.1016/j.aquaculture.2021.736 505.
Tan K,Zhou M,Jiang H G,Jiang D H,Li Y H,Wang W M. 2020. siRNA-Mediated MrIAG silencing induces sex reversal in Macrobrachium rosenbergii[J]. Marine Biotechnology,22:456-466. doi:10.1007/s10126-020-09965-4.
Tavabe K R,Rafiee G,Frinsko M,Daniels H. 2013. Effects of different calcium and magnesium concentrations separately and in combination on Macrobrachium rosenbergii(de Man) larviculture[J]. Aquaculture,412-413(3):160-166. doi:10.1016/j.aquaculture.2013.07.023.
Zhao M M,Luo J X,Zhou Q C,Yuan Y,Shi B,Zhu T T,Lu J J,Hu X Y,Jiao L F,Sun P,Jin M. 2021. Influence of dietary phosphorus on growth performance,phosphorus accumulation in tissue and energy metabolism of juvenile swimming crab(Portunus trituberculatus)[J]. Aquaculture Reports,20:100654. doi:10.1016/j.aqrep.2021.100654.
Zhao Y Y,Xie P,Fan H H,Zhao S J. 2011. Impairment of the mitochondrial oxidative phosphorylation system and oxidative stress in liver of crucian carp(Carassius auratus L.) exposed to microcystins[J]. Environmental Toxicology,29(1):30-39. doi:1 0.1002/tox.20770.
(責任编辑 邓慧灵)

