副溶血弧菌对罗氏沼虾肝胰腺和鳃组织中呼吸相关酶活性及抗氧化酶基因表达的影响
孔嘉明 戴习林 黎兰诗 梁震宇

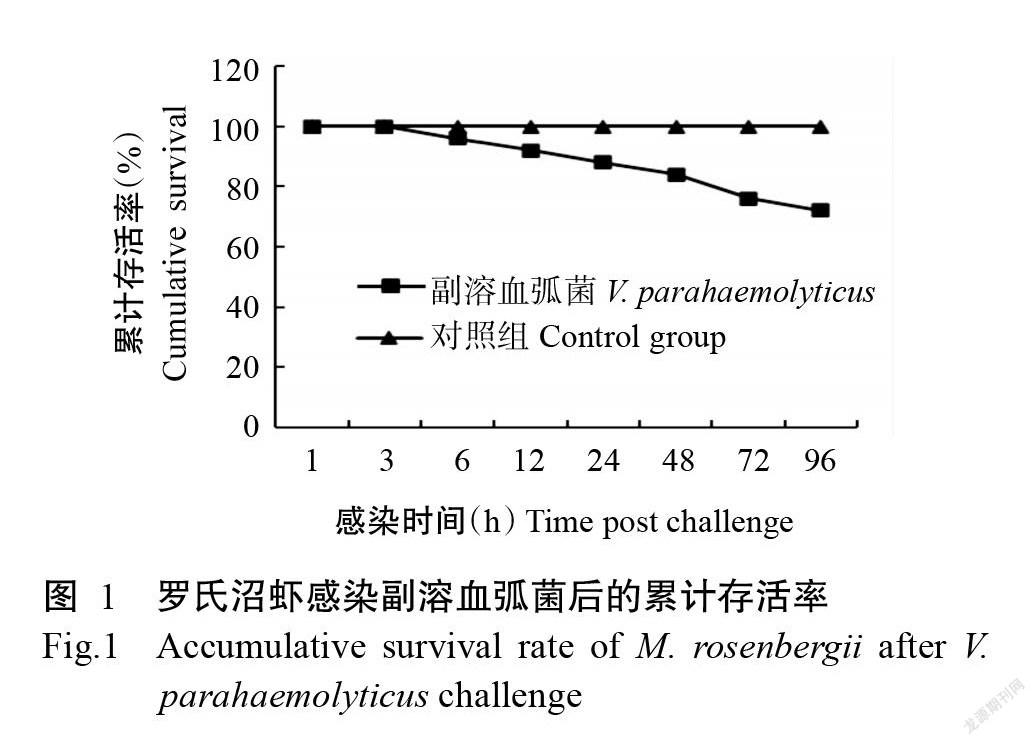

摘要:【目的】探討副溶血弧菌(Vibrio parahaemolyticus)对罗氏沼虾(Macrobrachium rosenbergii)肝胰腺和鳃组织中呼吸相关酶活性和抗氧化酶基因的影响,以期为罗氏沼虾免疫机理研究和病害防治提供参考依据。【方法】选取规格整齐、健康的罗氏沼虾,分别注射PBS溶液(对照组)和副溶血弧菌(试验组),在第1、3、6、12、24、48、72和96 h统计累计存活率,并取肝胰腺和鳃组织进行呼吸相关酶活性及抗氧化酶相关基因表达测定。【结果】罗氏沼虾感染副溶血弧菌后,随着时间的推移,其累计存活率逐渐下降,在96 h累计存活率为72%。感染副溶血弧菌后,其肝胰腺中的ATP合酶、细胞色素C氧化酶和NADH脱氢酶活性随时间延长均呈先降低后上升最后趋于对照组水平的变化趋势,且在6~24 h 3种酶活性均显著低于对照组(P<0.05,下同),之后酶活性逐步上升;活性氧(ROS)含量则呈先上升后下降的变化趋势,且在6~48 h显著高于对照组;超氧化物歧化酶(SOD)基因、过氧化氢酶(CAT)基因及谷胱甘肽过氧化物酶(GPX)基因相对表达量呈先升高后降低再升高的变化趋势。在鳃组织中,ATP合酶、细胞色素C氧化酶和NADH脱氢酶的活性随着感染时间的延长呈先降低后上升至趋于对照组水平,在6~72 h 3种酶活性不同时间段表现出显著下降趋势;ROS含量则呈先上升后下降的变化趋势;SOD、CAT和GPX基因相对表达量呈先升高后降低再升高的变化趋势,且均在感染6 h显著上调至最大值,其中GPX基因相对表达量在12~48 h显著下调低于对照组,并在72 h逐渐上调。【结论】副溶血弧菌感染罗氏沼虾后对肝胰腺和鳃组织中的呼吸相关酶及抗氧化酶基因产生显著影响,ROS水平呈上升趋势。虽然罗氏沼虾能通过自我调节呼吸相关酶和抗氧化酶基因促使机体抵御病原体入侵,但超过机体自我调节的限度时会对机体造成损伤。
关键词: 罗氏沼虾;副溶血弧菌;呼吸相关酶;抗氧化酶基因
中图分类号: S945.41 文献标志码: A 文章编号:2095-1191(2021)12-3294-09
Effects of Vibrio parahaemolyticus on activities of respiratory-related enzymes and gene expression of antioxidant enzymes in hepatopancreas and gill of Macrobrachium rosenbergii
KONG Jia-ming1,2, DAI Xi-lin1,2,3,4*, LI Lan-shi2,4, LIANG Zhen-yu2,4
(1Shanghai Ocean University, National Experimental Teaching Demonstration Center of Fisheries Science, Shanghai 201306, China; 2Shanghai Shencao Special Aquatic Development Company, Shanghai 201516, China; 3Shanghai Ocean University, Ministry of Agriculture and Rural Affairs Key Laboratory of Freshwater Aquatic Germplasm Resources, Shanghai 201306, China; 4Shanghai Ocean University, Aquatic Animal Genetic Breeding Center
Shanghai Collaborative Innovation Center, Shanghai 201306, China)
Abstract:【Objective】To investigate the effects of Vibrio parahaemolyticus on the activities of respiratory-related enzymes and antioxidant enzyme genes in hepatopancreas and gill of Macrobrachium rosenbergii, in order to provide referen-ce for the immune mechanism research and disease control of M. rosenbergii. 【Method】Regular and healthy M. rosenbergii was selected and injected with PBS solution(control group) and V. parahaemolyticus(experimental group) respectively. The cumulative survival rate was counted at the 1, 3, 6, 12, 24, 48, 72 and 96 h, and the activities of respiratory related enzymes and the expression of antioxidant enzyme related genes were measured in hepatopancreas and gill tissues.【Result】After being infected with V. parahaemolyticus, the cumulative survival rate of M. rosenbergii gradually decreased with the passage of time, and the cumulative survival rate was 72% at 96 h. After infection with V. parahaemolyticus, compared with the control group, the activities of ATP synthase, cytochrome C oxidase and NADH dehydrogenase in the hepatopancreas of M. rosenbergii in the experimental group decreased at first and then increased and finally tended to be the level of the control group. At 6 to 24 h, the activities of the three enzymes were significantly lower than those in the control group(P<0.05,the same below), and then gradually increased. The reactive oxygen species (ROS) content increased at first and then decreased, and was significantly higher than that in control group at 6-48 h. Superoxide dismutase (SOD) gene, catalase (CAT) gene and glutathione peroxidase (GPX) gene increased at first,then decreased and then increased. In the gill tissue of M. rosenbergii in the experimental group, the activities of ATP synthase, cytochrome C oxidase and NADH dehydrogenase decreased at first and then increased to the level of the control group, and the activities of the three enzymes decreased significantly at 6-72 h. The activity of reactive oxygen species increased at first and then decreased. The relative expression of SOD gene, CAT gene and GPX gene increased first, then decreased and finally increased, and both of them significantly increased to the maximum at 6 h after infection, in which the relative expression of GPX gene significantly decreased from 12-48 h to lower than that of the control group, and gradually increased at 72 h. 【Conclusion】V. parahaemolyticus infection of M. rosenbergii has significant effect on antioxidant enzyme genes and respiratory-related enzymes in hepatopancreas and gill tissues, the level of ROS increases. Although M. rosenbergii can resist pathogen invasion by self-regulating antioxidant enzyme genes and respiratory-related enzymes, it will cause damage to the body when it exceeds the limit of self-regulation.
Key words: Macrobrachium rosenbergii; Vibrio parahaemolyticus; respiratory related enzymes; antioxidant enzyme gene
Foundation item: Shanghai Shrimp Industry Technology System Construction Project(HNKCZ〔2016〕5)
0 引言
【研究意义】罗氏沼虾(Macrobrachium rosenbergii)是一种重要的经济甲壳类动物,原产于东南亚,其肉质鲜嫩,个体大,生长速度快,是我国重要的淡水养殖虾类。随着罗氏沼虾集约化养殖发展和环境恶化,各种疾病频繁暴发,给养殖业造成严重损失。弧菌属如创伤弧菌(Vibrio vulnificus)、鳗弧菌(V. anguillarum)、哈维氏弧菌(V. harveyi)、溶藻弧菌(V. alginolyticus)等容易引发养殖水生动物的疾病(蒋葛等,2019)。当养殖水环境恶化,会引起虾类免疫机能失衡和组织出现损伤,从而降低虾类对入侵病原的防御能力(赵伟等,2017)。无脊椎动物缺乏适应性免疫系统,防御机制主要依靠先天免疫反应来保护自身免受病原体的侵袭。因此,深入了解虾类的先天免疫能力和免疫防御机制,有利于虾类养殖业的健康管理和疾病控制发展。过氧化氢(H2O2)、超氧阴离子(·O2-)和羟自由基(·OH)等活性氧(ROS)被认为与癌症、衰老和各种炎症性疾病有关(曹玲芳等,2013),可有效杀死病原微生物,并在免疫信号转导中发挥重要作用(刘晓华,2010)。但过量的ROS会造成机体损伤,导致各种疾病。可见,研究抗氧化系统,对无脊椎动物生长发育具有重要意义。【前人研究进展】病毒性和细菌性疾病对水产动物的影响研究非常广泛。研究表明肝胰腺是甲壳动物产生ROS的代谢中心,鳃是呼吸器官,血淋巴中的病原体主要由鳃吸收,比其他器官更能引起生理功能的改变或对器官的损伤(Duan et al.,2015)。目前關于水生动物呼吸链的研究已有报道,对虾白斑综合征病毒(WSSV)在凡纳滨对虾细胞中的快速复制导致宿主腺苷三磷酸(ATP)快速消耗,影响宿主细胞其他能量依赖的生物学功能,最终导致细胞死亡(Liang et al.,2015);Ma等(2020)通过核磁共振的代谢组学方法研究哈维氏弧菌感染凡纳滨对虾,发现虾体内大多与能量相关的代谢途径的氨基酸呈下降趋势。此外,对于生化和理化因子的刺激,低温干露、不同浓度的硫化物会导致虾类肝胰腺中细胞色素C氧化酶降低,其蛋白质合成和能量代谢功能改变(连春盎,2016;Li et al.,2017)。陈萍等(2009)研究表明溶藻弧菌感染梭子蟹(Portunus trituberculatus),会造成机体消除自由基的抗氧化酶活性降低。Duan等(2013)、段亚飞等(2015)研究表明鳗弧菌感染脊尾白虾(Exopalaemon carinicauda),对抗氧化酶及基因产生影响,而ROS过量产生加剧膜脂过氧化,会导致细胞损伤和氧化损伤。在凡纳滨对虾(Litopenaeus vannamei)(Liu et al.,2007)、中国对虾(Fenneropenaeus chinensis)(Zhang et al.,2008)和克氏原螯虾(Procambarus clarkii)(Xia et al.,2013)的相关研究中均发现细菌能诱导抗氧化酶基因上调。【本研究切入点】罗氏沼虾作为水产经济动物,在养殖过程中,细菌性疾病对其生长发育及产量影响严重,目前有关细菌对罗氏沼虾的影响研究主要集中在免疫信号通路(Toll、IMD、JAK/STAT信号通路)、抗菌肽、药物防治和疫苗研发等方面(史晏如,2016;辛芳,2016),而针对细菌侵染罗氏沼虾对其呼吸链相关酶的影响及与抗氧化酶基因的关系研究鲜见报道。【拟解决的关键问题】对健康罗氏沼虾进行副溶血弧菌注射感染,从酶活性和基因表达水平探究感染后罗氏沼虾的肝胰腺和鳃组织中呼吸相关酶、抗氧化酶基因及ROS随时间变化的规律,为罗氏沼虾免疫机理研究和病害防治提供参考依据。
1 材料与方法
1. 1 试验材料
罗氏沼虾由上海申漕特种水产开发公司提供,随机挑选健康、活力强、规格均一的罗氏沼虾150尾,初始体重为15.64±2.15 g,将其暂养在水泥池中1周后进行试验。副溶血弧菌由上海海洋大学病原库提供。TRNzol Univesal Reagent和FastKing RT Kit购自TIANGEN公司,Talent QPCR PreMIX购自SYBR Green TIANGEN公司,ATP合酶(ATPase)、细胞色素C氧化酶(CCO)、NADH脱氢酶(ND)和ROS试剂盒购自上海岚派生物科技有限公司,线粒体蛋白提取试剂盒和蛋白定量试剂盒购自南京建成生物工程研究所。
1. 2 试验方法
采取注射攻毒的方式,为了使罗氏沼虾既有免疫反应且死亡数量较小,经过预试验,确定本试验选取5×107 CFU/mL为最佳注射浓度。试验在200 L水族箱中进行。将试验用虾随机分为对照组和试验组,每组设3个平行,每个水族箱放25尾。试验组在每尾虾的第二腹节基部注射100 μL副溶血弧菌菌液(5×107 CFU/mL),对照组注射等量的PBS溶液。试验期间水温平均(26±1)℃,每天早晚各投喂一次配合饲料,日换水1/3,并连续充气。注射后分别于1、3、6、12、24、48、72和96 h,观察其摄食情况、统计存活率,并在每个时间点取2尾虾的肝胰腺和鳃组织于液氮中冷冻保存,以用于酶活性和基因表达的测定。
1. 3 抗氧化酶基因表达分析
RNA提取:参照TRNzol Univesal Reagent说明书提取-80 ℃罗氏沼虾肝胰腺和鳃组织的总RNA。提取的总RNA用Nanodrop-lite测定OD260和OD280值,用琼脂糖凝胶电泳鉴定其完整性。RNA反转录:按照FastKing RT Kit说明书进行操作。在GenBank中查得罗氏沼虾过氧化氢酶(CAT,HQ668089.1)、超氧化物歧化酶(SOD,DQ121374.1)、谷胱甘肽过氧化物酶(GPX,FJ670566.1)及18S(GQ131934.1)序列,设计引物序列见表1,由生工生物工程(上海)股份有限公司合成。实时荧光定量PCR(RT-PCR):以罗氏沼虾18S为内参基因,参照Talent QPCR PreMIX说明书进行基因表达量的测定,以2-△△Ct的方法进行计算。
1. 4 呼吸相关酶活性测定
取组织称量后放入玻璃匀浆器,按质量体积比1∶9加0.1% PBS缓冲液于冰水混合物中,匀浆制备成10%组织匀浆液,于4 ℃冷冻离心机3000 r/min低速离心15 min,取上清液制备粗酶液,然后按各种酶试剂盒说明书进行操作,并用科华酶标仪检测读数。
1. 5 统计分析
采用SPSS 20.0对试验数据进行单因素方差分析(One-way ANOVA),以Excel 2016制图。
2 结果与分析
2. 1 副溶血弧菌对罗氏沼虾存活率的影响
由图1可知,对照组的罗氏沼虾累计存活率保持在100%,而感染副溶血弧菌的罗氏沼虾随着时间的推移,累计存活率逐渐下降,在6 h出现死亡现象,24 h的累计存活率为84%,感染48 h后罗氏沼虾活力减弱、反应变慢,摄食量变少,在96 h累计存活率为72%。试验中观察到,对照组的罗氏沼虾摄食正常,未出现死亡;而试验组中濒临死亡的罗氏沼虾附肢和尾扇变红,肌肉轻微泛白,甲壳上出现损伤并变黑。
2. 2 副溶血弧菌对罗氏沼虾呼吸相关酶活性的影响
2. 2. 1 副溶血弧菌对肝胰腺中呼吸相关酶活性的影响 由图2可知,与对照组相比,感染副溶血弧菌的罗氏沼虾肝胰腺中ATP合酶、细胞色素C氧化酶和NADH脱氢酶活性总体呈先降低后升高的变化趋势,3种酶活性在6~24 h均显著低于对照组(P<0.05,下同)。ATP合酶活性在48 h显著上调,随后趋于对照组水平(图2-A);细胞色素C氧化酶活性在第6 h下调幅度最大,但在72和96 h显著高于对照组水平(图2-B);NADH脱氢酶在第12 h下调幅度最大,至72 h显著上调,随后趋于对照组水平(图2-C)。试验组ROS含量呈先上升后下降的變化趋势,在第6 h显著高于对照组并持续升高,至72 h降低至对照组水平(图2-D)。
2. 2. 2 副溶血弧菌对鳃组织中呼吸相关酶活性的影响 由图3可知,与对照组相比,感染副溶血弧菌的罗氏沼虾鳃组织中ATP合酶、细胞色素C氧化酶和NADH脱氢酶活性总体呈先降低后上升并趋于对照组水平的变化趋势。3种酶活性均在第3 h显著上调;ATP合酶活性在12~72 h显著降低,在96 h趋于对照组水平(图3-A);细胞色素C氧化酶活性在6~48 h显著降低,在72 h趋于对照组水平(图3-B);NADH脱氢酶活性在6~72 h显著降低,在96 h趋于对照组水平(图3-C)。而试验组ROS含量(图3-D)与肝胰腺中ROS含量变化基本一致。
2. 3 副溶血弧菌对罗氏沼虾抗氧化酶基因的影响
2. 3. 1 副溶血弧菌对肝胰腺抗氧化酶基因的影响 罗氏沼虾在感染副溶血弧菌后,对肝胰腺的抗氧化酶基因表达产生不同程度的影响(图4)。与对照组相比,试验组罗氏沼虾的肝胰腺中SOD、CAT和GPX基因相对表达量呈升高—降低—升高的变化趋势。SOD和CAT基因相对表达量均在3 h显著下调,6 h显著上调,6 h后下调,并在72 h趋于对照组水平,但CAT基因在96 h又显著上调(图4-A和图4-B);GPX基因相对表达量在感染前期(1~3 h)显著上调,随后显著下调,至24 h趋于对照组水平,感染后期72 h显著上调,且上调幅度最大(图4-C)。
2. 3. 2 副溶血弧菌对鳃组织抗氧化酶基因的影响 由图5可知,与对照组相比,试验组罗氏沼虾的鳃组织中SOD、CAT和GPX基因相对表达量均呈升高—降低—升高的变化趋势,与对肝胰腺的影响变化一致。3种基因相对表达量均在感染6 h显著上调至最大值;SOD基因相对表达量在24~48 h下调,且显著低于对照组,但在96 h显著上调(图5-A);CAT基因相对表达量在24 h下调,48 h为最小值,随后趋于对照组水平(图5-B);GPX基因相对表达量在12~48 h显著低于对照组,但在72 h显著上调,并于96 h趋于对照组水平(图5-C)。
3 讨论
弧菌是虾类养殖业中危害严重的病原之一,可导致虾类机体生理功能紊乱,造成严重死亡和经济损失。而溶藻弧菌和副溶血弧菌在弧菌中表现出溶血性,且弧菌对氨苄青霉素、红霉素和链霉素均具有多重耐药性,被归为罗氏沼虾中毒力最强的弧菌。本试验开展副溶血弧菌对罗氏沼虾肝胰腺和鳃组织的损伤机制研究,可为罗氏沼虾的病害防治提供参考依据,具有重要意义。
呼吸暴发是一种快速、短暂、产生大量ROS的过程,是甲壳类动物抵御细菌、真菌和病毒等入侵微生物的重要防御策略之一(Liu et al.,2007)。尽管ROS在宿主防御中起着重要保护作用,但其过量和残留会导致机体损伤。因此,无脊椎动物均有保护性机制来平衡ROS的产生和避免氧化应激,即抗氧化系统(霍利杰,2019)。抗氧化系统能防止ROS的有害作用,在保护机体免受氧化应激、预防或修复氧化损伤方面发挥作用。凡纳滨对虾的ROS水平在铜暴露后显著增加,且与血细胞凋亡存在相关性,诱导CAT和SOD的相对表达水平下调(Guo et al.,2017)。 中国明对虾感染副溶血弧菌后,其肝胰腺中ROS在6 h显著增加,12 h达最大值,鳃中ROS在3 h增加,48 h趋于对照组但仍高于对照组(Ren et al.,2009)。本研究结果与上述结果一致,副溶血弧菌感染期间会提高组织中的ROS水平以杀死病原菌,本研究罗氏沼虾肝胰腺和鳃组织中的ROS含量均呈先升高后降低的变化趋势,可能由于细菌在体内不断繁殖,导致ROS水平升高,ROS的变化会引起抗氧化酶基因水平的变化,以维持机体平衡,当ROS含量超出抗氧化系统的阈值时,机体会出现氧化损伤甚至死亡。但本研究中,副溶血弧菌感染罗氏沼虾是否造成虾组织细胞凋亡或坏死,还需通过组织切片或检测与细胞凋亡相关的基因变化来验证。
线粒体作为细胞储存和提供能量的场所,具有氧化磷酸化、传递电子、能量代谢和抗ROS等重要生理作用,是细胞内氧化应激的源头,也是细胞凋亡的主要位点(方允中等,2003)。线粒体是体内氧自由基的重要来源之一,生物体内的氧化还原系统保持动态平衡,若过量的超氧负离子O2-及其歧化产物H2O2(ROS主要形式)产生,会加重线粒体DNA、酶和膜脂质损伤,同时加重细胞功能降低或细胞死亡。本研究中感染副溶血弧菌的罗氏沼虾,其肝胰腺中NADH脱氢酶、ATP合酶和细胞色素C氧化酶的活性较鳃组织中的活性高;ROS含量变化与呼吸链酶活性呈负相关,与李杰等(2017)的研究结果相似,其研究发现低表达NADH脱氢酶的乳鼠心肌细胞,线粒体电子传递链上泄露了比正常表达NADH脱氢酶更多的ROS,而ROS含量较高会启动线粒体介导的凋亡通路。罗氏沼虾感染副溶血弧菌后,随着时间的延长,副溶血弧菌在体内扩散,肝胰腺中的NADH脱氢酶、ATP合酶和细胞色素C氧化酶在6~24 h显著降低,推测一方面可能是由于针刺或高浓度的细菌进入虾体内,导致线粒体产生氧化应激;另一方面可能是细菌在虾体内进行大量繁殖,导致过量的ROS产生从而抑制了呼吸链酶活性。48 h后,呼吸链酶活性逐渐上升,可能是抗氧化系统对过量ROS逐渐清除,先天免疫信号通路、中性粒细胞对细菌的吞噬与清除。Zhao等(2014)研究发现鲫鱼(Carassius auratus)暴露于微囊藻毒素48 h,肝脏中线粒体编码基因(COX1、COX2、COX3、ATP6)的表达和5种线粒体复合物酶活性均显著降低,且呈时间依赖性。本研究中,罗氏沼虾鳃组织中NADH脱氢酶、ATP合酶和细胞色素C氧化酶活性在3 h前升高,可能是细菌通过血液运输到鳃,低浓度的细菌会刺激呼吸链酶活性升高,后期由于细菌繁殖引起ROS过量导致呼吸链酶活降低。上述结果与中国对虾的研究报道(Mohankumar and Ramasamy,2006)一致,其推测是由于虾体内病毒载量过多,引起自由基过多,从而导致ATP产量降低;也可能是感染后摄食减少,导致TCA循环中葡萄糖氧化的减少。
SOD、CAT和GPX之间具有协同作用(时少坤等,2013;梁俊平等,2020)。O2-是呼吸暴发释放的第一个产物,可以被SOD转化为H2O2,H2O2可通过细胞膜扩散到细胞质中,再通过CAT和GPX将H2O2转化为H2O和O2。ROS的增加在虾类感染细菌的早期反应中起重要作用。本研究中,罗氏沼虾在注射副溶血弧菌后,其鳃组织和肝胰腺中SOD、CAT及GPX基因转录水平均升高,说明ROS诱导抗氧化酶基因来提高机体抗氧化防御能力及时清除过多的ROS,以维持代谢平衡,与Ji等(2011)研究凡纳滨对虾受副溶血弧菌和白斑病毒感染后的报道结果一致。Tian等(2011)对凡纳滨对虾注射WSSV后的相关研究表明SOD基因對WSSV有诱导和应答作用。本研究罗氏沼虾感染副溶血弧菌后,其肝胰腺中SOD基因相对表达量在6 h显著上调,随后显著下调;鳃组织中在6 h显著上调,后显著下调,最后趋于对照组水平,与斑节对虾(Penaeus monodon)感染副溶血弧菌后肝胰腺中SOD基因相对表达量在6和12 h显著上调的结果基本一致(Bu et al.,2017)。上述结果表明机体产生的ROS诱导SOD表达,通过提高抗氧化酶活性来保护机体。随着病原体在宿主体内不断繁殖,更多的病原体造成机体产生更高的局部ROS,可能超出抗氧化酶系统的阈值,导致SOD基因受到抑制。
CAT不仅参与细胞内ROS的代谢过程,维持细胞氧化还原平衡,还能增强吞噬细胞的防御能力及免疫功能,有效抑制脂质的过氧化作用,保护机体免受损伤(陈晓敏,2017)。鳗弧菌感染脊尾白虾(Exopalaemon carinicauda),其鳃组织中CAT基因相对表达量在12 h后始终处于较高水平,推测可能是H2O2含量显著增加诱导CAT基因的表达,产生较多的CAT用于分解过多的H2O2(Duan et al.,2013)。而本研究中,罗氏沼虾的肝胰腺和鳃组织中CAT基因相对表达量在感染前期显著上调,在12 h后转录水平有所下调,与Ji等(2011)对凡纳滨对虾注射副溶血弧菌后肝胰腺中CAT表达的研究结果一致,推测是弧菌后期破坏了对虾的免疫应答。WSSV感染中国对虾后,肝胰腺CAT基因表达水平在0~14 h降至较低水平,在23 h显著上调,之后下降至正常水平(Zhang et al.,2008)。这与副溶血弧菌感染罗氏沼虾不同,可能不同的感染剂量和感染方法导致应答的差异。在注射后早期,针刺和细菌刺激诱导了一定的免疫反应,进而影响罗氏沼虾的正常生理功能,CAT表达上调;随着细菌不断繁殖,在注射后较晚时间刺激作用增强,使机体局部产生过量ROS,从而抑制CAT的表达。
GPX和硫氧还蛋白过氧化物酶(TPX)对H2O2亲和力高于CAT,即GPX和TPX在H2O2浓度很低的情况下也能有效地清除H2O2,而CAT不能(Kang et al.,2005)。本研究中,罗氏沼虾感染副溶血弧菌前期,肝胰腺和鳃组织中的GPX基因相对表达量显著上调,中期受到抑制,后期又出现显著上调,与Xia等(2013)对克氏原螯虾感染WSSV和金黄色葡萄球菌后GPX基因的表达趋势、程超等(2020)对嗜水气单胞菌刺激中华绒螯蟹(Eriocheir sinensis)的研究结果相一致。本研究结果表明,过量的ROS可能会导致SOD、CAT和GPX基因在一定时间段会受到短暂抑制,但在后期均表现出上调趋势,ROS后期降低也说明了抗氧化酶基因对ROS的清除作用。但虾类的免疫系统较复杂,同一种抗氧化酶基因在不同感染研究中表现出的不同变化趋势,可能与病原种类、感染剂量、组织的功能与定位、虾的种类及规格等因素有关(罗词兴等,2014)。此外,造成ROS含量降低的原因不仅是抗氧化酶系统的作用,具体还需更深入的研究。
4 结论
副溶血弧菌感染罗氏沼虾后对肝胰腺和鳃组织中的呼吸相关酶及抗氧化酶基因产生显著影响,ROS水平呈上升趋势。虽然罗氏沼虾能通过自我调节呼吸相关酶和抗氧化酶基因促使机体抵御病原体入侵,但超过机体自我调节的限度时会对机体造成损伤。
参考文献:
曹玲芳,李怡芳,何蓉蓉,栗原博. 2013. 细胞色素c氧化酶对衰老调控作用的研究进展[J]. 国际药学研究杂志,40(6):751-756. [Cao L F,Li Y F,He R R,Hiroshi K. 2013. Regulation function of cytochrome c oxidase on aging:Research advances[J]. Journal of International Pharmaceutical Research,40(6):751-756.] doi:10.13220/j.cnki.jipr.2013.06.029.
陳萍,李吉涛,李健,刘淇,刘萍. 2009. 溶藻弧菌对三疣梭子蟹抗氧化酶系统的影响[J]. 海洋科学,33(5):59-63. [Chen P,Li J T,Li J,Liu Q,Liu P. 2009. Effect on antio-xidant enzyme system of Portunus trituberculatus infec-ted by Vibrio alginolyticus[J]. Marine Sciences,33(5):59-63.]
陈晓敏. 2017. 凡纳滨对虾CAT基因和SOD基因单核苷酸多态性及与抗逆性状的相关性分析[D]. 湛江:广东海洋大学. [Chen X M. 2017. Analyzation of single nucleotide polymorphisms in CAT gene and SOD gene and associa-ted with resistant hypoxia traits in Litopenaeus vannamei[D]. Zhanjiang:Guangdong Ocean University.]
程超,肖敏,李菁,毛振方,张翠真,陈志和,朱敏杰,简少卿,赵大显. 2020. 嗜水气单胞菌刺激对中华绒螯蟹免疫的影响[J]. 水产科学,39(4):465-475. [Chen C,Xiao M,Li J,Mao Z F,Zhang C Z,Chen Z H,Zhu M J,Jian S Q,Zhao D X. 2020. Effects of Aeromonas hydrophila stimulation on immunity of Chinese mitten crab Eriocheir sinensis[J]. Fisheries Science,39(4):465-475.] doi:10.16378/j.cnki.1003-1111.2020.04.001.
段亚飞,梁俊平,李吉涛,王芸,张喆,李健,刘萍. 2015. 鳗弧菌感染对脊尾白虾鳃组织抗氧化酶系统的影响[J]. 水产科学,34(11):667-672. [Duan Y F,Liang J P,Li J T,Wang Y,Zhang Z,Li J,Liu P. 2015. Antioxidant enzyme system in gills of shrimp Exopalaemon carinicauda challenged with Vibrio anguillarum[J]. Fisheries Science,34(11):667-672.] doi:10.16378/j.cnki.1003-1111.2015.11. 001.
方允中,杨胜,伍国耀. 2003. 自由基、抗氧化剂、营养素与健康的关系[J]. 营养学报,25(4):337-343. [Fang Y Z,Yang S,Wu G Y. 2003. Free radicals,antioxidants,and nutrients in relation to health[J]. Acta Nutrimenta Sinica,25(4):337-343.] doi:10.3321/j.issn:0512-7955.2003.04. 001.
霍利杰. 2019. 日本囊对虾ATP合酶及其抑制因子在病毒免疫反应中的功能研究[D]. 济南:山东大学. [Huo L J. 2019. The functions of ATP synthase and its inhibitory factor in shrimp viral immune reaction[D]. Jinan:Shandong University.]
蒋葛,沈辉,万夕和,乔毅,黎慧,王李宝,史文军. 2019. 凡纳滨对虾急性肝胰腺坏死综合症病虾与健康虾肠道优势菌群比较分析[J]. 江苏农业学报,35(1):142-148. [Jiang G,Shen H,Wan X H,Qiao Y,Li H,Wang L B,Shi W J. 2019. Difference analysis of intestinal flora between healthy Litopenaeus vannamei and acute hepatopancreatic necrosis syndrome L. vannamei[J]. Jiangsu Journal of Agricultural Sciences,35(1):142-148.] doi:10. 3969/j. issn.1000-4440.2019.01.021.
李杰,王爱玲,杨谋广. 2017. 低表达NADH脱氢酶[辅酶Q]铁硫蛋白4对乳鼠心肌细胞线粒体功能的影响[J]. 安徽医学,38(8):959-962. [Li J,Wang A L,Yang M G. 2017. Effect of low expression of protein NDUSFS4 on mitochondria function of ventricular myocytes in neonatal rats[J]. Anhui Medical Journal,38(8):959-962.] doi:10. 3969/j.issn.1000-0399.2017.08.001.
连春盎. 2016. 干露胁迫对脊尾白虾呼吸代谢相关酶和低氧诱导因子的影响[D]. 上海:上海海洋大学. [Lian C A. 2016. Effects of dry exposure on the respiratory metabolism-related enzymes and HIF-1 of Exopalaemon carinicauda[D]. Shanghai:Shanghai Ocean University.]
梁俊平,张静,覃宝利,王宣朋,蔺玉华,丁辰龙,吴学军. 2020. 维生素C对氨氮胁迫下大鳞鲃幼鱼存活及鳃抗氧化酶活性的影响[J]. 河南农业科学,49(1):157-164. [Liang J P,Zhang J,Qin B L,Wang X P,Lin Y H,Ding C L,Wu X J. 2020. Effects of Vitamin C on the survival and antioxidant enzyme activities of juvenile Barbus capito under ammonia-N stress[J]. Journal of Henan Agricultural Sciences,49(1):157-164.] doi:10.15933/j.cnki.1004- 3268.2020.01.022.
刘晓华. 2010. 谷胱甘肽对凡纳滨对虾抗氧化防御的调控机理[D]. 武汉:华中农业大学. [Liu X H. 2010. Antioxidative defence mechanism of glutathioneon Litopenaeus Vannamei[D]. Wuhan:Huazhong Agricultural University.]
羅词兴,黄旭雄,李桑,赵利斌,危立坤,陈春燕,刘林林,曾蓓蓓. 2014. 溶藻弧菌感染后凡纳滨对虾鳃组织免疫相关基因的表达[J]. 中国水产科学,21(1):189-196. [Luo C X,Huang X X,Li S,Zhao L B,Wei L K,Chen C Y,Liu L L,Zeng B B. 2014. Expressions of Toll receptor,IMD and lysozyme mRNA in the gills of the white shrimp (Litopenaeus vannamei) after acute challenge with Vibrio alginolyticus[J]. Journal of Fishery Sciences of China,21(1):189-196.] doi:10.3724/SP.J.1118.2014.00189.
时少坤,王瑞旋,王江勇,姜敬哲,刘广锋,杨蕊. 2013. 盐度胁迫对近江牡蛎几种免疫因子的影响[J]. 南方水产科学,9(3):26-30. [Shi S K,Wang R X,Wang J Y,Jiang J Z,Liu G F,Yang R. 2013. Effects of salinity stress on immune factors of Crassostrea hongkongensis[J]. South China Fisheries Science,9(3):26-30.] doi:10.3969/j.issn. 2095-0780.2013.03.005.
史晏如. 2016. 罗氏沼虾IMD信号通路关键基因(Relish、IMD)的克隆和功能研究[D]. 南京:南京师范大学. [Shi Y R. 2016. Cloning and functional study of key genes of IMD signaling pathway in Macrobrachium rosenbergii[D]. Nanjing: Nanjing Normal University.]
辛芳. 2016. 凡纳滨对虾mTOR信号通路中重要基因的克隆和功能的初步研究[D]. 青岛:中国科学院大学. [Xin F. 2016. Gene cloning and functional study on the important genes of mTOR signaling in Litopenaeus vannamei[D]. Qingdao:University of Chinese Academy of Sciences.]
赵伟,王雷,刘梅,蒋克勇,齐灿灿,杨广,王宝杰. 2017. 副溶血弧菌对凡纳滨对虾肝胰腺抗氧化酶活性和基因表达的影响[J]. 中国水产科学,24(6):1261-1270. [Zhao W,Wang L,Liu M,Jiang K Y,Qi C C,Yang G,Wang B J. 2017. The effects of Vibrio parahaemolyticus on hepatopancreas antioxidant enzyme activity and gene expression of Litopenaeus vannamei[J]. Journal of Fishery Scien-ces of China,24(6):1261-1270.] doi:10.3724/SP.J.1118. 2017.16221.
Bu R Q,Wang P F,Zhao C,Bao W Y,Qiu L H. 2017. Gene characteristics,immune and stress responses of PmPrx1 in black tiger shrimp(Penaeus monodon):Insights from exposure to pathogenic bacteria and toxic environmental stressors[J]. Developmental & Comparative Immunology,77:1-16. doi:10.1016/j.dci.2017.07.002.
Duan Y F,Liu P,Li J T,Li J,Chen P. 2013. Expression profiles of selenium dependent glutathione peroxidase and glutathione S-transferase from Exopalaemon carinicauda in response to Vibrio anguillarum and WSSV challenge[J]. Fish & Shellfish Immunology,35(3):661-670. doi:10.1016/j.fsi.2013.05.016.
Duan Y F,Zhang J S,Dong H B,Wang Y,Liu Q S,Li H. 2015. Oxidative stress response of the black tiger shrimp Penaeus monodon to Vibrio parahaemolyticus challenge[J]. Fish & Shellfish Immunology,46(2):354-365. doi:10.1016/j.fsi.2015.06.032.
Guo H,Li K X,Wang W,Wang C G,Shen Y C. 2017. Effects of copper on hemocyte apoptosis,ROS production,and gene expression in white shrimp Litopenaeus vannamei[J]. Biological Trace Element Research,179(2):318-326. doi:10.1007/s12011-017-0974-6.
Ji P F,Yao C L,Wang Z Y. 2011. Reactive oxygen system plays an important role in shrimp Litopenaeus vannamei defense against Vibrio parahaemolyticus and WSSV infection[J]. Diseases of Aquatic Organisms,96(1):9-20. doi:10.3354/dao02373.
Kang S W,Rhee S G,Chang T S,Jeong W J,Choi M H. 2005. 2-Cys peroxiredoxin function in intracellular signal transduction:Therapeutic implications[J]. Trends in Mole-cular Medicine,11(12):571-578. doi:10.1016/j.molmed. 2005.10.006.
Li T Y,Li E C,Suo Y T,Xu Z X,Jia Y Y,Qin J G,Chen L Q,Gu Z M. 2017. Energy metabolism and metabolomics response of Pacific white shrimp Litopenaeus vannamei to sulfide toxicity[J]. Aquatic Toxicology,183:28-37. doi:10. 1016/j.aquatox.2016.12.010.
Liang Y,Xu M L,Wang X W,Gao X X,Cheng J J,Li C,Huang J. 2015. ATP synthesis is active on the cell surface of the shrimp Litopenaeus vannamei and is suppressed by WSSV infection[J]. Virology Journal,12:49. doi:10. 1186/s12985-015-0275-7.
Liu C H,Tseng M C,Cheng W T. 2007. Identification and cloning of the antioxidant enzyme,glutathione peroxidase,of white shrimp,Litopenaeus vannamei,and its expression following Vibrio alginolyticus infection[J]. Fish & Shellfish Immunology,23(1):34-45. doi:10.1016/j.fsi. 2006.09.002.
Ma S,Kim A,Lee W,Kim S,Lee S,Yoon D,Bae J S,Park C,Kim S. 2020. Vibrio harveyi infection significantly alters amino acid and carbohydrate metabolism in whiteleg shrimp,Litopenaeus vannamei[J]. Metabolites,10(6):265. doi:10.3390/metabo10060265.
Mohankumar K,Ramasamy P. 2006. Activities of membrane bound phosphatases,transaminases and mitochondrial enzymes in white spot syndrome virus infected tissues of Fenneropenaeus indicus[J]. Virus Research,118(1-2):130-135. doi:10.1016/j.virusres.2005.12.002.
Ren Q,Sun R R,Zhao X F,Wang J X. 2009. A selenium-dependent glutathione peroxidase(Se-GPx) and two glutathione S-transferases(GSTs) from Chinese shrimp(Fenneropenaeus chinensis)[J]. Comparative Biochemistry and Physiology Part C:Toxicology & Pharmacology,149(4):613-623. doi:10.1016/j.cbpc.2009.01.007.
Tian J X,Chen J,Jiang D,Liao S A,Wang A L. 2011. Transcriptional regulation of extracellular copper zinc superoxide dismutase from white shrimp Litopenaeus vannamei following Vibrio alginolyticus and WSSV infection[J]. Fish & Shellfish Immunology,30(1):234-240. doi:10.1016/j.fsi.2010.10.013.
Xia X F,Zheng J J,Shao G M,Wang J L,Liu X S,Wang Y F. 2013. Cloning and functional analysis of glutathione peroxidase gene in red swamp crayfish Procambarus clarkii[J]. Fish & Shellfish Immunology,34(6):1587-1595. doi:10.1016/j.fsi.2013.03.375.
Zhang Q L,Li F H,Zhang X J,Dong B,Zhang J Q,Xie Y S,Xiang J H. 2008. cDNA cloning,characterization and expression analysis of the antioxidant enzyme gene,catalase,of Chinese shrimp Fenneropenaeus chinensis[J]. Fish & Shellfish Immunology,24(5):584-591. doi:10.1016/j.fsi.2008.01.008.
Zhao Y Y,Xie P,Fan H H,Zhao S J. 2014. Impairment of the mitochondrial oxidative phosphorylation system and oxidative stress in liver of crucian carp(Carassius auratus L.) exposed to microcystins[J]. Environmental Toxicology,29(1):30-39. doi:10.1002/tox.20770.
(責任编辑 罗 丽)

