有机酸对H发泡剂分解历程的影响及作用机制分析*
赵隧军,陈思凝,魏利军,方云龙
(中国安全生产科学研究院,北京 100012)
0 引言
H发泡剂学名N,N′-二亚硝基五亚甲基四胺(N,N′-Dinitrosopentamethylenetetramine),浅黄色粉末,是1种热分解型敏感性的亚硝基化合物[1],主要用于制造海绵、橡胶、微孔聚氯乙烯塑料等。H发泡剂分解生成氮气、甲醛和六亚甲基四胺,研究者们对H发泡剂的分解机理和发泡效果开展多样化的工作,测定H发泡剂的分解热效应,研究H发泡剂与尿素混合使用的作用机理[2];通过H发泡剂在橡胶介质中的分解特性,研究其热分解动力学[3]。工业上常用的发泡剂助剂主要有有机酸、有机酸盐、碱土金属化合物等[4],现有的工作对发泡剂中加入添加剂后的分解温度、焓变和分解速率进行研究[5],添加剂氧化锌和硬脂酸对H发泡剂分解温度几乎没有影响,硬脂酸锌能使得H发泡剂分解温度呈线性下降,但对于有机酸与H发泡剂混合后的分解历程及其作用机制缺少详细分析,对分解过程中热危害的变化因素还缺少深入认识。对此,本文采用绝热加速量热仪、微量热仪等高精度设备,测试含有不同质量分数苯甲酸、水杨酸、邻苯二甲酸对H发泡剂分解过程的影响,分析其作用机制,为在橡胶、塑料及海绵等制造工艺中降低H发泡剂使用风险、提高发泡效率提供数据支撑。
1 实验设备及实验条件
1.1 实验样品
实验样品:H发泡剂(工业用品)、苯甲酸(分析纯)、水杨酸(分析纯)、邻苯二甲酸(分析纯)。
1.2 实验设备及测试过程
1.2.1 H发泡剂热分解特性测试
1)实验采用英国Thermal Hazard Technology(THT)公司制造的绝热加速量热仪。实验中使用不锈钢测试球,测试条件见表1。

表1 H发泡剂绝热量热测试条件Table 1 Adiabatic calorimetry test conditions of H foaming agent
2)采用法国SETARAM公司制造的C80微量热仪,选取0.1,0.2,0.4 K/min的升温速率进行扫描量热实验。
1.2.2 有机酸对H发泡剂分解影响测试
采用C80微量热仪,称取H发泡剂150 mg,按6%,12%,24%的质量分数分别加入苯甲酸、水杨酸和邻苯二甲酸,装入不锈钢高压池摇匀。设置升温速率为0.4 ℃/min,测试温度为50~250 ℃,测试氛围为空气。
2 实验结果与讨论
2.1 H发泡剂的热分解特性
2.1.1 H发泡剂分解绝热量热结果分析
按照表1中测试条件对H发泡剂进行绝热量热实验,实验结果如图1所示。

图1 绝热条件下H发泡剂温度和压力随时间的变化曲线Fig.1 Variation curves of temperature and pressure of H foaming agent with time under adiabatic condition
图1中,由温度随时间的变化曲线可知H发泡剂在150.6 ℃时开始分解放热,同时测试球内压力开始上升,约141 min后温度曲线呈垂直上升,上升速率达到最大,当温度上升至211.9 ℃后,放热过程结束,此时实验测得绝热温升ΔTad为61.3 ℃。测试结果见表2。

表2 H发泡剂绝热量热测试结果Table 2 Adiabatic calorimetry test results of H foaming agent
由表2可知,H发泡剂初始分解放热温度(Tonset)为150.6 ℃,分解放热量(ΔHd)较大,放热较为剧烈,依据绝热条件下放热速率随温度变化的测试结果进行动力学分析,n级动力学的绝热加速量热的温升速率方程[6-10]如式(1)~(2)所示:
(1)
(2)
式中:mT为绝热条件下温升速率,K/min;k为速率常数,s-1;Tf为放热结束时体系的温度,K;T0为初始放热时体系的温度,K;ΔTad为绝热温升,K;T为测试样品的温度,K。
将阿伦尼乌斯方程带入式(2),并对两边求对数,如式(3)所示:
(3)
式中:A为指前因子;E为表观活化能,kJ/mol;R为气体常数,J/(mol·K)。

2.1.2 H发泡剂分解扫描量热结果分析
对H发泡剂进行动态升温扫描量热实验,实验结果如图2所示,积分基线选取切线方法进一步得到不同升温速率下样品的外推起始温度Te、峰值温度Tp、分解热ΔHd等热特征参数,见表3。

图2 不同升温速率下H发泡剂分解的热流变化曲线Fig.2 Variation curves of heat flux in decomposition of H foaming agent under different heating rates

表3 不同升温速率下H发泡剂分解扫描量热测试结果Table 3 Test results of H foaming agent decomposition by scanning calorimetry under different heating rates
随着升温速率β增加,H发泡剂分解的Te,Tp随之升高,最大放热速率q亦随之升高,但分解热ΔHd相差不大。与绝热量热相比,扫描量热测试的分解放热量较大,这是由于微量热仪的测试精度更高,检测限更低,且绝热量热测试过程中有部分热量被测试球吸收,进行热惰性因子修正过程中会造成偏差。
2.2 3种有机酸分解热特性
在H发泡剂分解过程中加入添加剂是提升其发泡效果、降低发泡温度的常用手段,本文中选择苯甲酸、水杨酸、邻苯二甲酸3种有机酸与H发泡剂混合后的热分解过程进行研究,3种有机酸均含有羧基,水杨酸含有1个羧基和1个羟基,邻苯二甲酸含有2个羧基,使用微量热仪C80分别对3种有机酸进行扫描量热测试,热流曲线如图3所示,积分采用切线积分,测试结果见表4。

图3 3种有机酸扫描量热的热流曲线Fig.3 Heat flow curves of three organic acids by scanning calorimetry

表4 3种有机酸的扫描量热测试结果Table 4 Scanning calorimetry test results of three organic acids
由表4可知,在测试温度范围内3种有机酸均未出现放热峰,由出现的吸热峰可推断3种有机酸在升温的过程中均发生了熔化,其中苯甲酸的熔程在120~140 ℃之间,水杨酸的熔程在150~170 ℃之间,邻苯二甲酸的熔程在170~240 ℃之间。相较而言,邻苯二甲酸发生相态变化的温度区间较宽,熔化所吸收的热量较大。以Tp作为熔点,此时熔点温度:苯甲酸<水杨酸<邻苯二甲酸。
2.3 有机酸对H发泡剂分解历程的影响
分别对加入6%,12%,24%质量分数的苯甲酸、水杨酸、邻苯二甲酸的H发泡剂进行量热测试,热流曲线如图4~6所示。

图4 6%有机酸与H发泡剂混合后的分解热流曲线Fig.4 Decomposition heat flow curves of 6% organic acids mixed with H foaming agent
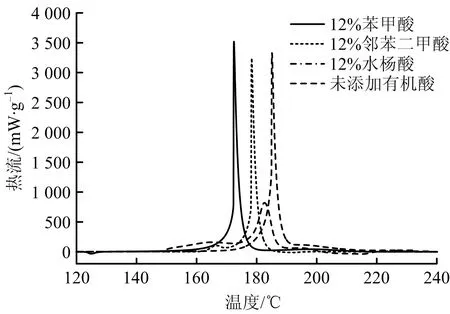
图5 12%有机酸与H发泡剂混合后的分解热流曲线Fig.5 Decomposition heat flow curves of 12% organic acids mixed with H foaming agent

图6 24%有机酸与H发泡剂混合后的分解热流曲线Fig.6 Decomposition heat flow curves of 24% organic acids mixed with H foaming agent
加入不同质量分数有机酸后,H发泡剂分解热流曲线较之纯品H发泡剂的分解热流曲线表现出不同的特点,其中加入苯甲酸和邻苯二甲酸后的放热峰峰型与纯品H发泡剂分解峰型相似性较高,主要差异在于加入有机酸后促进了H发泡剂的分解,混合物在较低温度下即开始分解放热,Te和Tp提前,同时分解放热量降低;加入水杨酸后,除了分解温度提前,分解最大放热速率出现明显降低,分解放热的温度区间增大。添加不同有机酸后H发泡剂的分解热特性参数见表5。

表5 添加不同质量分数有机酸后的H发泡剂热分解特性参数Table 5 Thermal decomposition characteristic parameters of H foaming agent when adding organic acids with different mass fractions
加入不同质量分数有机酸后H发泡剂的热分解Te和Tp的变化趋势如图7所示。

图7 H发泡剂混合物热分解的Te和Tp随有机酸质量分数的变化曲线Fig.7 Variation curves of Te and TP in thermal decomposition of H foaming agent mixture with mass fraction of organic acids
混有苯甲酸、水杨酸、邻苯二甲酸的H发泡剂分解的Te和Tp随着有机酸质量分数的增加呈降低趋势。混有不同质量分数苯甲酸或邻苯二甲酸的H发泡剂分解的Te和Tp降幅一致,且同一质量分数下,含有苯甲酸的H发泡剂分解的Te和Tp降幅较大;含有水杨酸的H发泡剂分解的Tp降幅最小,当质量分数大于12%时含有水杨酸的H发泡剂分解的Te出现大幅降低。
加入不同质量分数有机酸后H发泡剂的热分解q和ΔHd的变化趋势如图8所示。
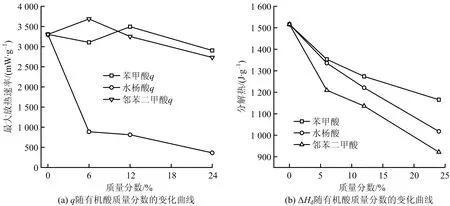
图8 H发泡剂混合物热分解q和ΔHd随有机酸质量分数的变化曲线Fig.8 Variation curves of q and ΔHd in thermal decomposition of H foaming agent mixture with mass fraction of organic acids
加入6%的邻苯二甲酸使得H发泡剂的最大放热速率增大,加入12%的邻苯二甲酸使得H发泡剂的最大放热速率增大,加入不同质量分数的水杨酸后,显著的降低了H发泡剂的最大放热速率,最大降低幅度可达89%。随着有机酸质量分数的增加,H发泡剂混合物分解热逐渐降低,其中含有邻苯二甲酸的降幅更为显著。
2.4 有机酸对H发泡剂分解作用机制分析

2.4.1 苯甲酸对H发泡剂分解作用机制分析
不同质量分数的苯甲酸与H发泡剂混合物的分解均出现有1个吸热峰和1个放热峰,且吸热峰的吸热量随苯甲酸含量增大而增大,推测该吸热峰是由苯甲酸在120~130 ℃时熔化相变导致,这与图3中苯甲酸的熔化吸热峰相吻合。因此苯甲酸与H发泡剂混合物的热分解过程是由苯甲酸的熔化过程与H发泡剂的分解过程耦合而成,苯甲酸的熔化,使得羧基中的H+电离,H+对H发泡剂的分解具有活化作用,进而使得H发泡剂分解的Te和Tp出现降低。随着苯甲酸的质量分数增加,熔化后电离的H+浓度增加,对H发泡剂的分解活化作用加强,从而导致H发泡剂分解的Te和Tp持续降低。
2.4.2 水杨酸对H发泡剂分解作用机制分析
水杨酸的加入使得H发泡剂分解热流曲线呈现出多峰型的特征,且随着水杨酸质量分数的增加,出现第1个峰高逐步增强,同时第2个峰高相对降低的趋势。
考虑到水杨酸结构中酚羟基的存在,其苯环上邻对位可能会与H发泡剂分解产生的甲醛发生取代反应,且水杨酸的熔程在150~170 ℃之间,推测在H发泡剂和水杨酸混合物升温过程中存在水杨酸与甲醛反应、水杨酸熔化吸热以及H发泡剂分解等多个过程的耦合。
水杨酸与甲醛反应生成水,水可以使得H发泡剂分解的Te和Tp降低[15],使得H发泡剂在较低温度下开始分解;熔化的水杨酸由羧基和羟基电离出质子H+,H+对H发泡剂的分解亦具有活化作用,进一步降低H发泡剂分解的Te和Tp。此时出现的第1阶段的放热推测主要是由于H发泡剂分解以及水杨酸与分解产物甲醛反应导致,随着水杨酸的质量分数增加,这一阶段的放热随之增强。由于在反应温度下,水杨酸和H发泡剂混合物不是均相体系,当水杨酸消耗完毕,剩余固体H发泡剂继续分解,导致第2阶段的放热,同时这一阶段放热量随着水杨酸质量的增加呈降低趋势。
2.4.3 邻苯二甲酸对H发泡剂分解作用机制分析
加入不同质量分数的邻苯二甲酸后,H发泡剂分解的Te和Tp均呈降低趋势。由图3可知,邻苯二甲酸的熔程在170~240 ℃,邻苯二甲酸熔化温度较高,且熔程较宽,当温度升至170 ℃,H发泡剂先发生分解,同时邻苯二甲酸缓慢熔化,可推测加入邻苯二甲酸后,H发泡剂分解热流曲线是由邻苯二甲酸的熔化过程和H发泡剂的分解过程耦合而成。在H发泡剂分解过程中邻苯二甲酸熔化较慢,电离H+能力较低,因此相比于苯甲酸与水杨酸,相同质量分数下,加入邻苯二甲酸对H发泡剂分解影响最小。
3 结论
1)H发泡剂分解时,随着升温速率增加,外推起始分解温度、峰值温度随之升高,最大放热速率亦随之升高,但分解热相差不大。
2)3种有机酸的加入均可以促进H发泡剂的分解,降低其Te和Tp。随着有机酸质量分数的增加,Te和Tp呈同步下降趋势。当水杨酸质量分数达到24%时,较之混有苯甲酸与邻苯二甲酸的H发泡剂Te降低20℃,在相对较低的温度下即可开始分解。
3)有机酸熔融生成的H+对H发泡剂分解过程产生显著影响,加入水杨酸能显著降低H发泡剂分解的热释放速率,进而降低H发泡剂分解过程中的热风险。

