正常生理和尿毒症状态下剪切力对静脉内皮细胞中KLF2及eNOS表达的影响
王冰月 姜埃利 贾岚 王立华
1天津市第三中心医院肾内科300170;2天津医科大学第二医院肾脏病与血液净化中心300211
0 引 言
良好的血管通路,尤其是动静脉内瘘,是保证维持性血液透析顺利进行,维持患者长期生存的前提,而静脉内膜增生是导致血管通路失功的最常见因素[1]。静脉内膜增生与动静脉内瘘状态下,剪切力的变化与内膜功能紊乱密切相关,其中涉及许多超微结构、细胞基因及信号通路等。有研究结果显示,Kruppel 样因子2(Krüppel-like factor 2,KLF2)及内皮型一氧化氮合成酶(endothelial nitric oxide synthase,eNOS)都会受到剪切力作用,发挥不同的生理功能,调节静脉内皮细胞功能。本研究中,分析正常生理及尿毒症状态下剪切力作用对静脉内皮细胞KLF2 及eNOS 表达的影响,从基础理论方面更好地理解动静脉内瘘失功的原因,对临床实际工作中治疗内瘘狭窄或阻塞有重要的意义。
1 材料与方法
1.1 主要材料与仪器
人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)(上海星博生物科技有限公司),反转录试剂盒(美国Fermentas 公司),聚合酶链反应(polymerase chain reaction,PCR)试剂盒(美国Roche 公司)。
BK800 细胞培养箱(德国Heraeus Sepatech 公司),XDY-1 倒置荧光显微镜(深圳市博视达光学仪器有限公司)。
1.2 方法
1.2.1 细胞培养与传代
HUVECs 以常规传代培养。细胞复苏后,用含体积分数为10%胎牛血清(fetal bovine serum,FBS)的DMEM 培养液,在37 ℃、5%CO2无菌培养箱条件下培养细胞,每1~3 天更换一次培养液,当细胞生长至80%以上融合时,胰蛋白酶消化按1∶3 传代,倒置显微镜观察细胞形态。
1.2.2 体外尿毒症培养基配置方法
尿毒症血清取自于天津医科大学第二医院透析中心的规律血液透析患者,所有患者均签署知情同意书。患者的原发病均为慢性肾小球肾炎,每周透析3 次,透析时间4 h,排除1 周内感染、心衰、患肿瘤及严重免疫性疾病的患者。患者于血液透析前空腹取血5 ml,收集后尽快处理,以3000 r/min 离心处理10 min;采集上清液,放置于56 ℃的水浴中处理30 min 清除血清补体,再经孔径为0.2 μm 的微孔滤膜过滤除细菌,储存在-20 ℃冰箱内备用。
尿毒症培养液的配制方法:DMEM 培养液45 ml,加入尿毒症血清5 ml,加入双抗(青链-霉素混合液)1 ml。
1.2.3 平行板流动室模型建立
剪切力的大小及循环流速的确定,采用下式

式中:μ 是液体黏度,Q 是液体流量,r 是管腔半径。
所有实验器材在使用前进行高温高压处理。提前1 天将静脉内皮细胞转移至载玻片上并放置于培养皿中培养。用泵管连接实验器皿(锥形瓶、水准瓶)和恒流泵/注射泵,在铺满细胞的载玻片上放置硅胶垫片,然后与平行板固定,放入平行板流动室的固定装置中。将上述装置放置于细胞培养箱之中,注入DMEM 培养液或含尿毒症血清的DMEM培养液(均含体积分数为5%的FBS)。
采用恒流泵模拟层流剪切力作用,通过调整不同的流速和时间,模拟不同的剪切条件。设置3 个剪切组、1 个振荡组和2 个对照组。在生理对照组和尿毒症对照组中,样品保持静态状态,即不受剪切力的作用。3 个实验组为低剪切力组(LSS)、正常剪切力组(生理强度)(NSS)和高剪切力组(HSS)。其中,LSS 组的剪切力为0.4Pa,对应泵流速为18ml/min;NSS 的剪切力为1.2 Pa,对应泵流速为52 ml/min;HSS组的剪切力为2 Pa,对应泵流速为86 ml/min。振荡剪切力组(OSS)中,采用恒流泵联合注射泵产生周期性的流体运动,以模拟振荡剪切力,强度为±0.4 Pa。
实验中,生理状态采用DMEM 培养基,尿毒症状态采用含有10%(体积分数)尿毒症血清的DMEM培养基;对照组不进行任何处理;分别在生理状态和尿毒症状态下,在平行板流动腔内模拟不同剪切力,用剪切力作用各组静脉内皮细胞4、12、24 h。
1.2.4 免疫荧光方法
将静脉内皮细胞在细胞爬片上培养,然后放置在循环装置中循环,结束后取出,用4℃磷酸盐缓冲液冲洗,4%多聚甲醛固定细胞,0.25%通透液对细胞进行通透,血清封闭,加入KLF2 及eNOS 抗体(稀释比例1∶50)对细胞进行过夜孵育,加入荧光抗体(稀释比例1∶50)孵育,最后滴加4"6-二脒基-2-苯基吲哚(DAPI)封片,进行细胞核染色,处理后的细胞法倒置显微镜下观察细胞抗原表达情况。应用ImageJ 图像处理软件进行免疫荧光度的测定。
1.2.5 RNA 提取及聚合酶链式反应
将提取的细胞应用Trizol 法进行RNA 提取,取2 μl RNA 用无酶水稀释5 倍后进行浓度测定,采用反转录试剂盒和PCR 试剂盒,按步骤进行RNA 测定。所用的基因引物序列见表1。
1.3 统计学方法
使用SPSS25.0 统计学软件处理数据。符合正态分布的计量资料用均值±标准差(Mean±SD)表示,多组间比较采用单因素方差分析,以P<0.05 为差异有统计学意义。
2 结 果
2.1 生理条件下剪切力对静脉内皮细胞KLF2 表达的影响
如图1 所示,随剪切力作用时间的增长,对照组的KLF2 表达水平基本没有变化,而HSS 组和NSS 组的KLF2 表达增强;实验24 h 后,HSS 组和NSS 组的KLF2 表达水平明显超过4 h(均P<0.05)和12 h(均P<0.05),且HSS 组的KLF2 表达增强更为明显;剪切作用24 h 后,HSS 组的KLF2 表达水平明显高于OSS 组(P<0.01)。图1B 显示的是差异倍数,其反映实验组和振荡组的KLF2 mRNA 表达量与对照组表达量的差异倍数,大于1 表示表达量较对照组高,小于1 表示表达量较对照组低。
免疫荧光检测结果显示,KLF2 主要在细胞核内表达,随着剪切力的作用KLF2 在细胞质中表达增强(图2)。上述结果说明,KLF2 可以被高强度层流剪切力激活。
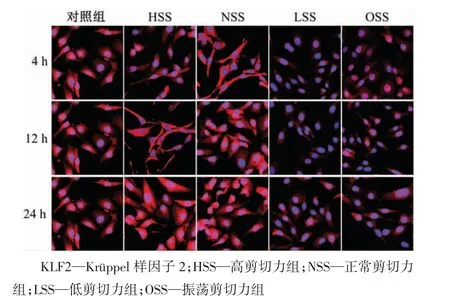
图2 正常条件下KLF2 蛋白的免疫荧光检测结果(×600)
2.2 生理条件下剪切力对静脉内皮细胞eNOS 表达的影响
如图3 所示,HSS 组和NSS 组的eNOS 表达水平明显高于LSS 组和OSS 组(均P<0.05);随剪切作用时间的增长,对照组的KLF2 表达水平基本没有变化,而HSS 组的eNOS 表达水平总体上呈增强的趋势,实验24 h 后,HSS 组的eNOS 的表达水平明显高于4 h(P<0.05)和12 h(P<0.05);此外,随剪切作用时间的增长,LSS 和OSS 组的eNOS 表达虽有所下降,但并不明显(均P>0.05)。
免疫荧光检测结果显示,eNOS 主要在细胞质和细胞核内呈颗粒样表达(图4)。上述结果说明,eNOS 的表达可以被高强度层流剪切力激活,被振荡剪切力及低强度层流剪切力抑制,eNOS 的表达特征与KLF2 基本同步。
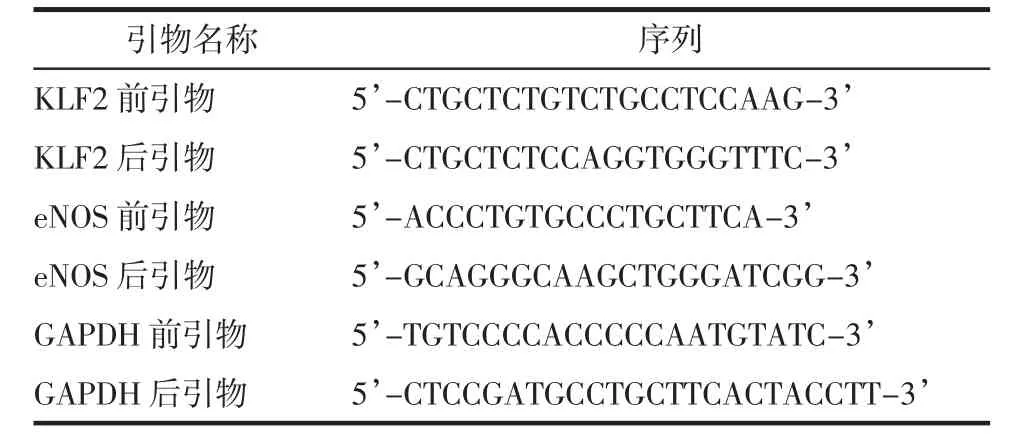
表1 基因引物序列
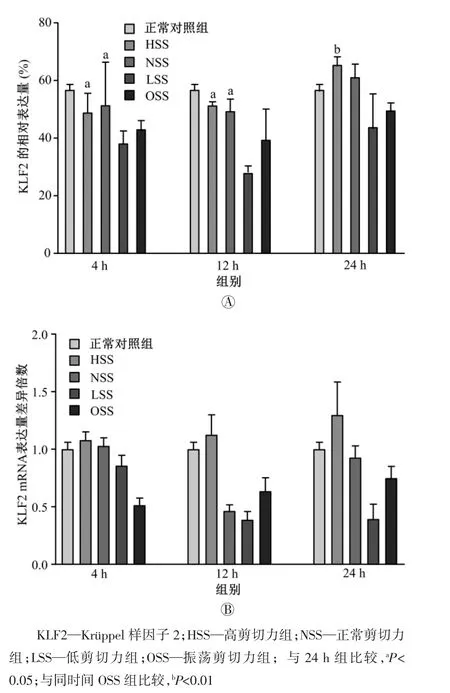
图1 正常条件下剪切力对静脉内皮细胞中KLF2 表达的影响
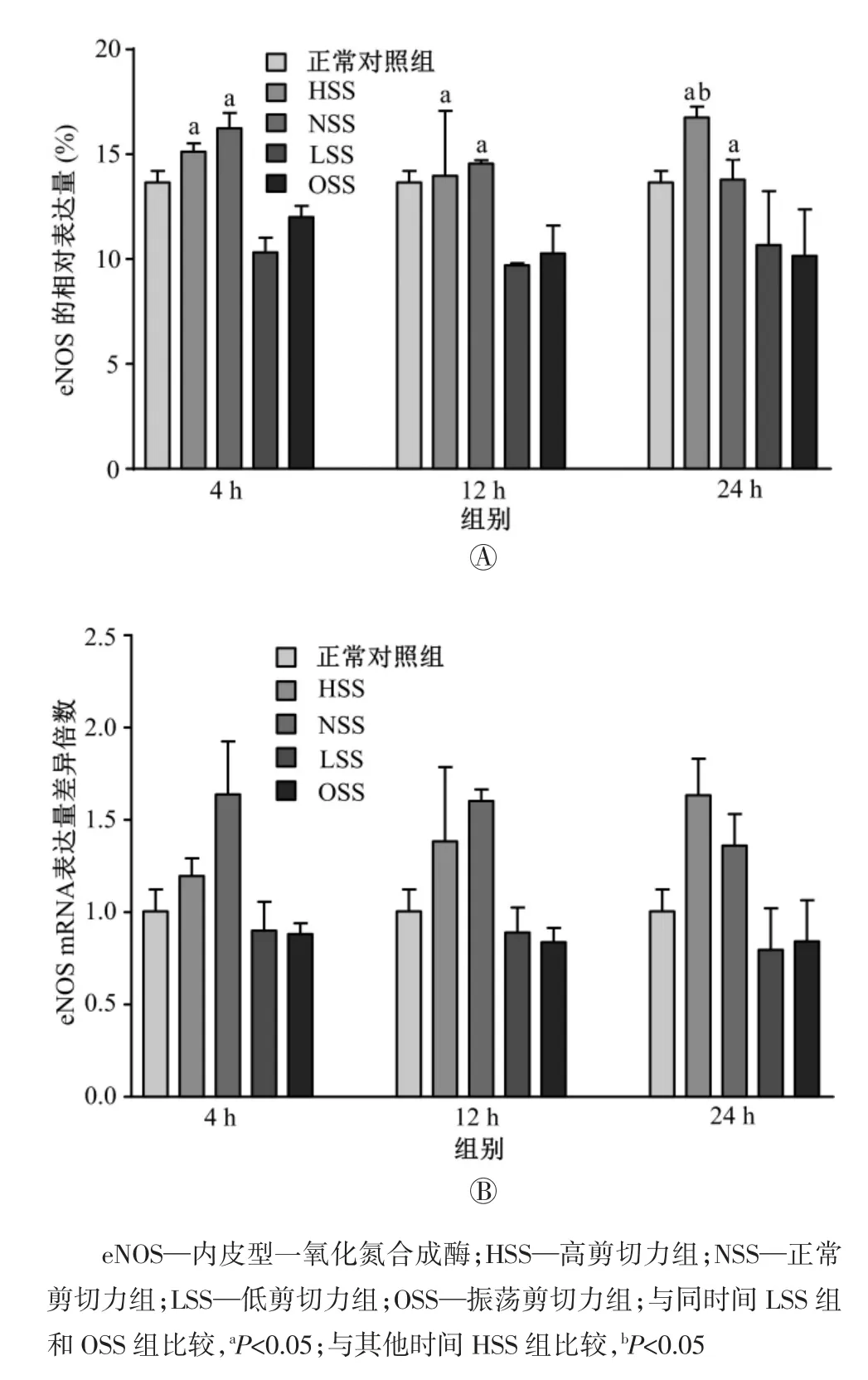
图3 正常条件下剪切力对静脉内皮细胞中eNOS 表达的影响
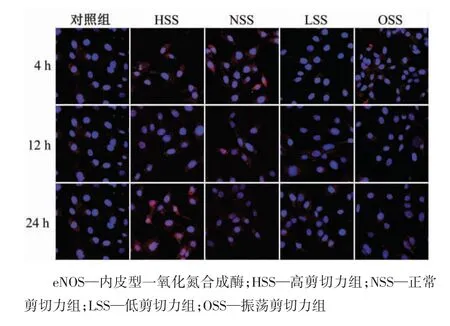
图4 正常条件下eNOS 蛋白的免疫荧光检测结果(×600)
2.3 尿毒症条件下剪切力对KLF2 表达的影响
如图5 所示,与正常对照组相比,尿毒症对照组中的KLF2 表达很低(P<0.01);剪切作用24 h 后,各剪切组中KLF2 的表达有所增强,其中OSS 组的KLF2 表达量低于HSS 组(P<0.01)。免疫荧光检测结果显示,在尿毒症条件下KLF2 主要在静脉内皮细胞的细胞核内表达;剪切作用后,KLF2 的表达不仅在细胞核内表达,在胞质中也有表达(图6)。

图5 尿毒症条件下剪切作用24 h 后静脉内皮细胞中KLF2 的表达
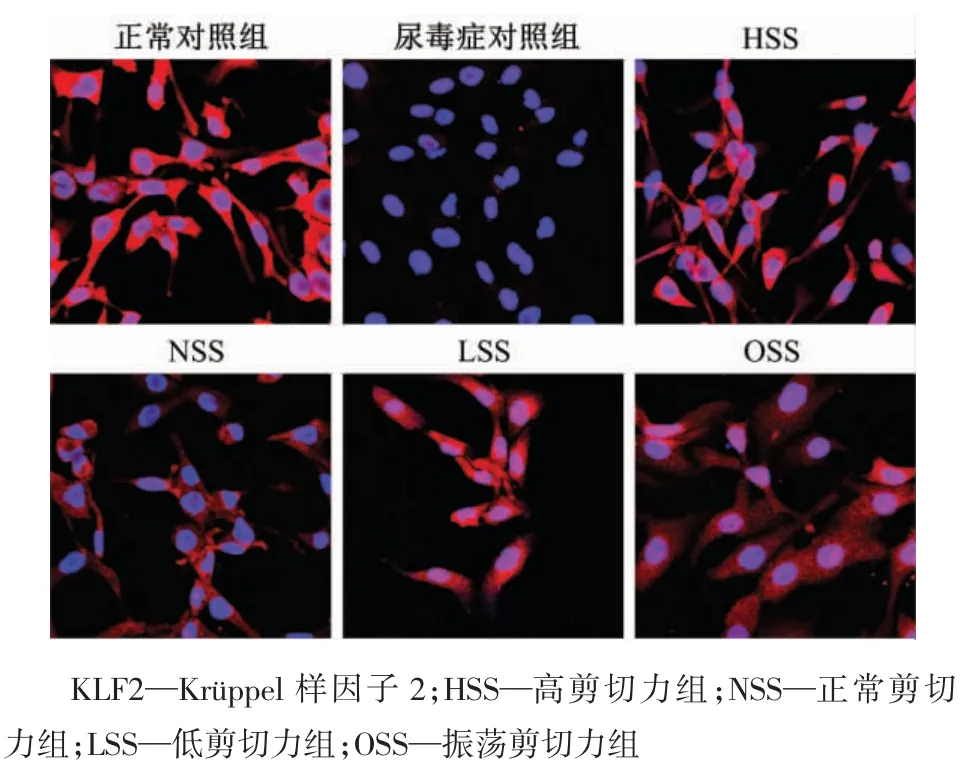
图6 尿毒症条件下KLF2 蛋白的免疫荧光检测结果(×600)
2.4 尿毒症条件下剪切力对eNOS 表达的影响
如图7 所示,与正常对照组相比,尿毒症对照组中的eNOS 表达降低(P<0.01);与尿毒症对照组比较,剪切作用24 h 后,HSS 组的eNOS 表达增强(P<0.01),而LSS 组和OSS 组的eNOS 表达明显降低(均P<0.01)。免疫荧光检测结果显示,在尿毒症条件下,eNOS 主要在静脉内皮细胞的胞质中表达(图8)。

图7 尿毒症条件下剪切作用24 h 后静脉内皮细胞中eNOS 的表达
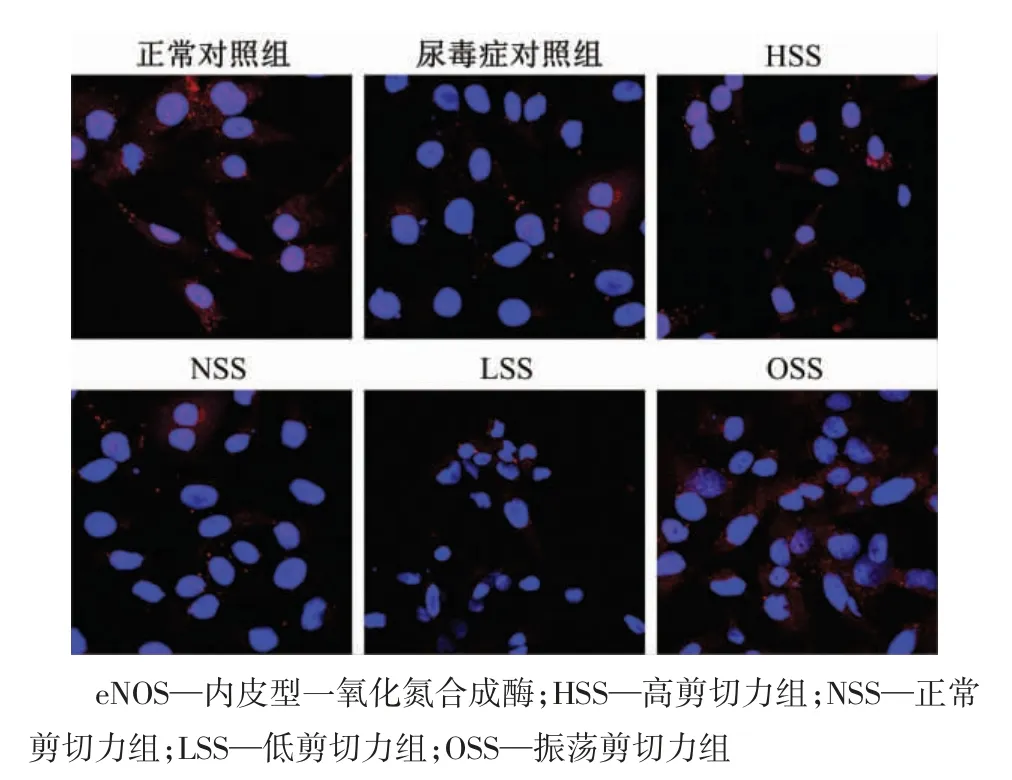
图8 尿毒症条件下eNOS 蛋白的免疫荧光检测结果(×600)
3 讨论与结论
目前,自体动静脉内瘘(autogenous arteriovenous fistulas,AVF)是需要维持性血液透析的尿毒症患者的首选血管通路。其具有方便操作、感染风险小等优势,但AVF 技术现状仍不乐观,其1年的成熟率仅为60%[2-5]。AVF 失功与多重因素相关,研究者在分子生物学、细胞信号转导等方面对此进行了大量研究,以探讨AVF 失功的病理生理机制,提高AVF成熟率及通畅率。对于尿毒症患者,尿毒症毒素、尿毒症基础原发病(如糖尿病、高血压等)、氧化应激、炎症、缺氧、酸中毒等都会导致其静脉内皮细胞损伤加重,产生静脉内皮细胞功能障碍,导致一系列病理生理改变,最终导致内膜增生、血管狭窄[6-11]。此外,AVF 引起的血流动力学改变也非常重要。剪切力的变化贯穿内瘘成熟的全过程,且动静脉的剪切力变化也存在明显差异。在本研究中,不仅考虑了剪切力的作用,而且模拟了尿毒症的环境条件,这是以往研究所没有涉及的。考察这两种双重因素的共同作用更能准确反映尿毒症患者AVF 时的病理生理改变。
静脉内皮细胞在受到剪切力作用后,其细胞膜表面的压力感受器会发挥作用,将力学信号转变为化学信号,并通过各种信号通路,影响下游的靶因子及蛋白的调控,发挥各自的病理生理作用[12-14]。以往研究发现,剪切力可以直接调控静脉内皮细胞内的敏感细胞因子(如KLF2)。KLF2 是KLF 家族中的重要成员,除了调控T 细胞成熟和脂肪分化过程之外,还在抗炎、抗凝、抗血栓、抗氧化、血管生成、内分泌调控等方面发挥重要的作用。
血流动力学的改变与KLF2 表达水平密切相关。血流剪切力是生理情况下诱导静脉内皮细胞KLF2 表达的唯一因素[15]。在层流剪切力作用的直段血管,KLF2 表达明显增高。已有研究结果证实,层流剪切力是诱导KLF2 高表达的剪切力类型,两者之间有明显的线性关系。与之相反,在受振荡剪切力作用的血管弯曲及分叉部位,KLF2 表达明显被抑制。本研究结果显示,KLF2 明显受剪切力作用调节,高强度剪切力和生理强度剪切力会上调KLF2 的表达,而低强度剪切力和振荡剪切力会下调KLF2的表达,但随作用时间的延长,KLF2 的表达也会有所上调。在AVF 的吻合口附近的血流多为湍流模式,表现为低强度剪切力及振荡剪切力,使KLF2 的表达受抑制,不能正常发挥抗炎、抗凝、抗氧化及血管调节作用,长期作用时,将导致静脉内皮细胞功能障碍、内膜增厚,最终导致血管狭窄、AVF 失功。此外,本研究中发现在尿毒症状态下,KLF2 表达明显被抑制,即使给予高剪切力作用,KLF2 水平也不及正常生理状态;在低剪切力及振荡剪切力作用下,KLF2 表达更明显地被抑制。因此,KLF2 在尿毒症环境及振荡剪切力双重作用下的表达被抑制,可能在AVF 失功的病理生理机制上发挥很重要的作用。
eNOS 的表达受多种因素的调节。eNOS 是KLF2 的靶基因,因此KLF2 的表达可以直接调控eNOS 的表达。本研究中,在高强度及正常强度(生理强度)层流剪切力作用下,eNOS 表达明显上调,而低强度剪切力及振荡剪切力则抑制了eNOS 的表达,该结果与针对KLF2 的研究结果一致。eNOS 的表达受抑制,会使NO 合成减少,血管调节功能异常,导致血栓形成、血管平滑肌细胞增殖,这些均是AVF 失功的机制。除剪切力影响之外,尿毒症状态也影响eNOS 的表达,在尿毒症状态下,eNOS 的表达较正常生理状态下明显下降,并且在振荡剪切力作用下,eNOS 的表达更进一步被抑制,不能发挥正常的生理功能,最终会导致静脉内皮细胞功能障碍,这与AVF 失功有着密切的关系。
综上所述,AVF 术后在尿毒症环境及剪切力的多重因素作用下,会使静脉内皮细胞内具有保护性的因子(如KLF2、eNOS)的表达受到抑制。该结论提示尿毒症状态更容易出现炎症、氧化应激、血管调节功能下降,进而出现静脉内皮细胞内一系列细胞信号转导通路异常,再加之振荡剪切力的进一步作用,会使上述蛋白或因子的表达进一步下调。这些因素可能是导致静脉内皮细胞功能紊乱、内膜增生、AVF 失功的病理生理机制。本研究中所得结果均在体外细胞条件下取得,相关机制尚需动物实验加以证实。
利益冲突所有作者均声明不存在利益冲突

