胺碘酮促进小鼠HL1 心房肌细胞热处理诱导的凋亡、炎症及氧化应激
赵海玉,谭振林,何利伟,朱世杰,颜如玉,寇宏强,彭 健
南方医科大学南方医院心血管内科,广东 广州510515
房性快速性心律失常是一组临床上常见的快速性心律失常,包括心房颤动、心房扑动、房性心动过速,药物治疗效果不满意,并发症严重。近年来经导管射频消融(RF)已成为房性快速性心律失常治疗的有效手段之一,原理是通过电极释放能量产生高温引起组织的热损伤,阻断异常电位的传导。术后复发是目前房性快速性心律失常特别是心房颤动治疗中存在的主要问题。房颤导管消融的基石是肺静脉电隔离(PVI)[1-2],研究表明房颤消融术后复发的主要原因是肺静脉和心房之间电传导的恢复[3-4],这归咎于消融点未实现连续透壁损伤[5],组织学研究表明不完全的PVI消融区的心肌损伤程度与房颤术后复发率有负相关性[6]。连续线性消融对提高房性快速性心律失常的治疗成功率尤为重要[7-8]。目前提高RF效率的研究主要着眼于物理材料及技术的更新,而RF的操作是通过点与点连接形成消融线,点与点之间的组织因未接受足够的热量易造成亚致死性损伤,导致留有消融“间隙”或后期传导恢复[9],仅通过物理方法做到电位被完全隔离阻断仍存在困难。
胺碘酮是一种常用的Ⅲ类抗心律失常药,在临床上常被用于控制节律,在射频消融围手术期作为辅助用药可预防和治疗房颤[10],有研究表明术前应用胺碘酮可减少RF完成PVI的消融点数[11]。本团队前期一项前瞻性临床研究表明,射频消融术中经导管灌注胺碘酮溶液可有效提高术中肺静脉电隔离效率和窦律转复率,降低术后复发率[12]。
既往文献报道,RF造成的组织热损伤主要为高热造成的坏死以及凋亡和炎症[13]。然而,胺碘酮在RF中对心房肌细胞损伤的影响尚无研究报道。研究胺碘酮对受热损伤后的心房肌细胞的作用对探明其是否能促进消融病变从而提高房性心律失常的消融效率具有重要意义。本研究拟建立不完全射频消融的细胞模型,胺碘酮加以干预,初步探索热处理对心房肌细胞的损伤作用,及胺碘酮对心房肌细胞热损伤的影响。
1 材料和方法
1.1 材料与试剂
小鼠HL1心房肌细胞(永诺生物);HWS-20恒温水浴箱(江苏太仓市实验设备厂),盐酸胺碘酮(Amiodarone)注射液(赛诺菲);细胞活性检测试剂盒(MTS)G3580、超氧化物歧化酶(SOD)S0101试剂盒、丙二醛(MDA)S0131试剂盒(碧云天);小鼠白介素1β(IL-1β)ELISAKit、小鼠白介素6(IL-6)ELISAKit、小鼠肿瘤坏死因子α(TNF-α)ELISAKit(武汉华美生物)。
1.2 方法
1.2.1 细胞培养 将HL-1心房肌细胞在含10%胎牛的Dulbecco改良版Eagle培养基(DMEM)中进行培养,培养基含10%血清(FBS,Gibco)和1%青霉素-链霉素(Invitrogen),置于37°C、5%CO2的培养箱中培养。
1.2.2 热处理 参考Yoshida等[14]的肝脏射频消融体外模型方法,水浴热诱导小鼠HL1心房肌细胞,体外模拟射频消融术中亚致死的心房肌细胞。当HL1小鼠心房肌细胞生长至80%汇合时,通过胰蛋白酶消化,洗涤并在1.5 mL微量离心管中用1 mL含10%FBS的DMEM重悬细胞(5×104)并立即在温度37、46、49、52、55、58 ℃的恒温水浴箱中培养10 min,然后将细胞接种到含10%FBS的100 μLDMEM中的96孔培养板中(1×104/孔),继续在37 ℃、5%CO2培养箱中培养12 h,MTS法测量吸光度显示存活率,得出对比于37 ℃细胞活力降低25%的温度,数据用于后续实验。
1.2.3 药物干预 先用盐酸胺碘酮注射液与DMSO配成100 mmol/L的母液,HL-1心房肌细胞接种于96孔板,待细胞汇合度到80%时,分别加入不同剂量的胺碘酮母液滴定至浓度为0、3、10、30、60、90 μmol/L,在37 ℃恒温水浴箱中持续1 h,继续在37 ℃,5%CO2下培养12 h,用MTS法测量吸光度,得出对比于无药物(0 μmol/L)时细胞活力降低25%的药物浓度,此浓度用于后续实验。
1.2.4 实验分组 HL1心房肌细胞按前述1.2.1的方法培养并接种至96孔培养板(1×104/孔)后按下列方式分组:空白对照组:置于37 ℃恒温水浴箱;热处理组:置于1.2.2选出的温度水浴箱;胺碘酮组:滴定至实验1.2.3所选的胺碘酮浓度再立即置于1.2.2选出的温度水浴箱,3组细胞均置于相应水浴箱10 min后继续在37 ℃、5%CO2下复温培养12 h进行后续指标测定。
1.2.5 MTS检测细胞活性 3个实验组细胞接种于96孔板,每组设置3 个复孔,加入5 mg/mL 的MTS 溶液(20 μL/孔),室温孵育4 h,弃孔内培养液,加入DMSO(150 μL/孔),放入振荡仪匀速振荡15 min,采用酶标仪检测波长为490 nm处各孔的吸光度A490nm,计算细胞存活率。
1.2.6 流式细胞术检测细胞凋亡 收集各组细胞,采用0.25%胰蛋白酶消化,PBS洗涤细胞3次,调整细胞密度至2×106/mL,细胞悬液转移至离心管,4 ℃,1000 r/min离心10 min,弃上清,加入预冷PBS重悬细胞,相同条件下离心10 min,PBS 洗涤,加入200 μL Binding Buffer,分别加入5 μLAnnexin V-FITC与PI充分混匀,室温避光孵育15 min,加入300 μL Binding Buffer,置于FACS Calibur流式细胞仪及应用Cellauest软件检测各组细胞凋亡率。
1.2.7 检测炎症因子IL-1β、IL-6、TNF-α的水平 收集各组细胞培养上清液,采用ELISA试剂盒测定炎症因子IL-1β、IL-6、TNF-α的含量,严格按照试剂盒说明书进行操作。
1.2.8 检测MDA与SOD活性 采用不含血清的培养液稀释DCFH-DA(稀释比1∶1000),DCFH-DA 终浓度为10 μmol/L,将DCFH-DA分别加入“1.2.4”实验分组的细胞中,室温避光孵育20 min,采用0.25%胰蛋白酶消化各组细胞,预冷PBS洗涤细胞,加入500 μL PBS重悬细胞,使用超声波裂解细胞,4 ℃,4000 r/min离心15 min,吸取上清液,按照MDA和SOD的ELISA试剂盒检测活性。
1.3 数据统计与分析
采用SPSS22.0软件进行统计处理。首先对组间各样本量参数行正态检验,符合正态分布的计量资料以均数士标准差表示,组间比较采用单因素方差分析,因本研究样本量较少,均经Mann-Whitney U检验校验结果相符;所有检验均为双侧检验,P<0.05为差异有统计学意义。
2 结果
2.1 不同温度梯度下的细胞活性
以对照组(37 ℃)的细胞存活率为参照,心房肌细胞存活率在46 ℃温度干预后下降[(89.28±3.11)%vs(100.00±4.75)%,P<0.01],且随温度的升高,HL1细胞存活率进一步降低,52 ℃的细胞存活率为(75.43±1.38)%,该温度下细胞失活率约为25%,与对照组的细胞存活率差异及显著(P<0.001,图1),而55 ℃与52 ℃下心房肌细胞的存活率差异并无统计学意义(P=0.223),故后续实验中采用52 ℃作为加热温度。
2.2 不同胺碘酮浓度下的细胞活性
MTS法检测37 ℃下不同胺碘酮浓度时的细胞活性,与对照组(0 μmol/L)比较,3 μmol/L的干预对HL1细胞存活率并无明显影响(P=0.507),心房肌细胞存活率在10 μmol/L浓度的胺碘酮干预后显著降低[(100.00±0.65)%vs(94.42±0.69)%,P<0.001];30 μmol/L的胺碘酮浓度引起心房肌细胞存活率明显下降,存活率为(75.70±1.99)%,失活率约25%,后续60、90 μmol/L浓度下的存活率与30 μmol/L 差异并无统计学意义(P=0.126,0.789,图2),后续实验中采用30 μmol/L作为药物干预浓度。
2.3 胺碘酮可进一步降低加热导致的小鼠HL1心房肌细胞存活率
与对照组相比,52 ℃热处理组的HL1心房肌细胞活性显著降低[(75.74±3.28)%vs(99.67±3.26)%,P<0.001];加热同时加30 μmol/L的胺碘酮导致细胞活性进一步降低至(64.15±0.71)%(P<0.01,图3)。
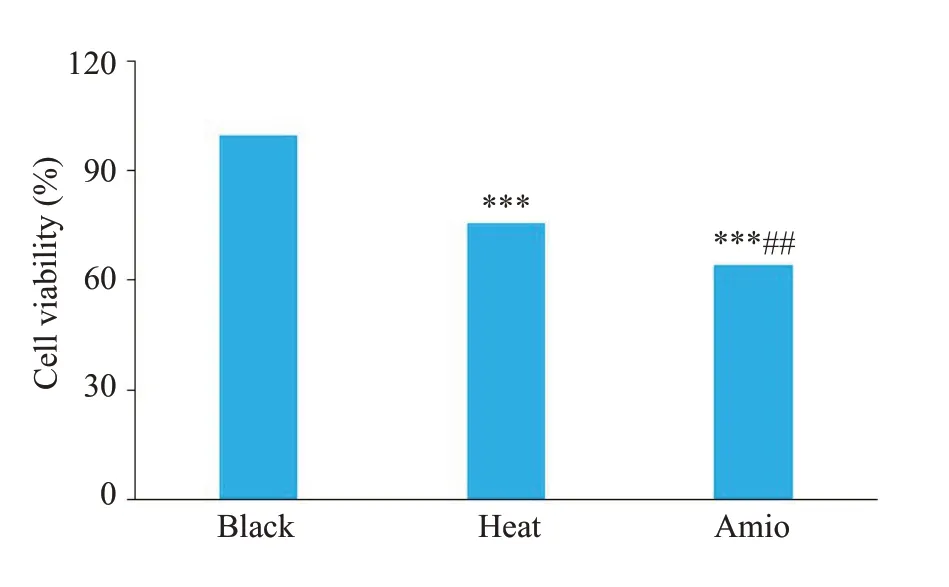
图3 3组细胞的细胞存活率Fig.3 Cell viability in different groups. ***P<0.001 vs the blank group,##P<0.01 vs heat group(Mean±SD,n=3).
2.4 胺碘酮促进热处理导致的小鼠HL1心房肌细胞凋亡
流式细胞术结果显示,相比空白组,热处理组小鼠HL1 心房肌细胞凋亡率显著升高[(3.80±0.80)% vs(27.66±0.96)%,P<0.001],与热处理组相比,胺碘酮组小鼠HL1 心房肌细胞凋亡率进一步增加至(29.79±0.32)%(P<0.05,图4)。
2.5 胺碘酮促进热处理后小鼠HL1心房肌细胞炎症因子表达
ELISA检测结果显示,加热组心房肌细胞的IL-1β水平升高(P<0.01),IL-6 水平显著升高(P<0.001),TNF-α数值有所升高但无统计学意义(P=0.383),而联合胺碘酮处理后,IL-1β和IL-6 水平进一步增加(P<0.01),TNF-α水平的增加显著(P<0.001,表1)。
2.6 胺碘酮对加热后小鼠HL1心房肌细胞氧化应激的影响
分光光度计检测细胞MDA、SOD结果显示,和空白对照组相比,加热及加热联合胺碘酮导致MDA表达升高(P<0.01),胺碘酮导致细胞的氧化应激因子MDA进一步升高(P<0.01),加热导致SOD 活性降低(P<0.001),胺碘酮的应用则导致SOD活性进一步降低(P<0.05,表2)。
3 讨论

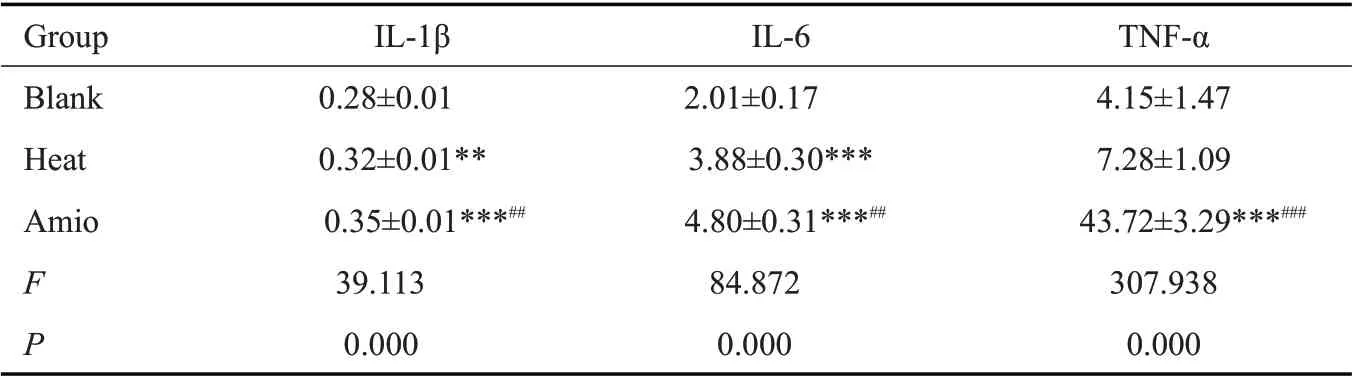
表1 胺碘酮对热处理诱导的小鼠HL1心房肌细胞IL-1β、IL-6和TNF-α分泌的影响Tab.1 Effect of amiodarone on heat-induced IL-1β,IL-6 and TNF-α expression in mouse HL1 atrial myocytes(pg/mL,Mean±SD,n=3)
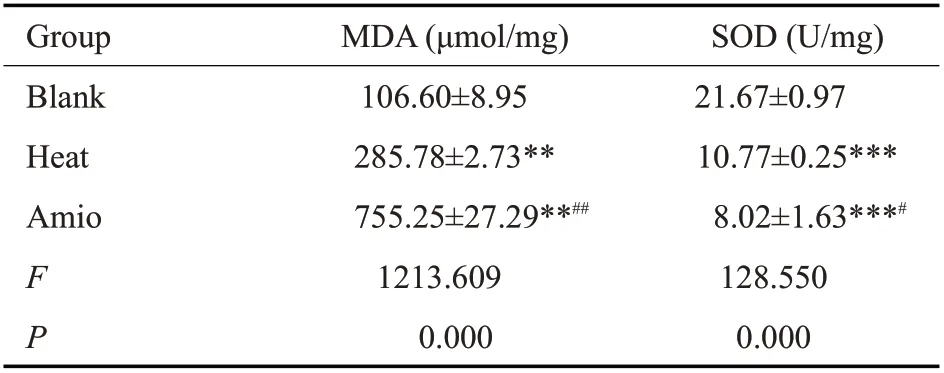
表2 胺碘酮对热处理诱导的小鼠HL1心房肌细胞MDA和SOD产生的影响Tab.2 Effect of Amiodarone on heat-induced MDA and SOD production in mouse HL1 atrial myocyte(Mean±SD,n=3)
目前鲜有研究报道射频消融对心房肌细胞的损伤影响,RF的治疗原理是射频电流的热损伤,参考肿瘤细胞RF体外研究模型,用恒温水浴箱加热心房肌细胞建立RF细胞体外热损伤研究模型[15],以37 ℃下的细胞存活率为参照,46 ℃,49 ℃,52 ℃,55 ℃,58 ℃等不同温度梯度加热均引起不同程度的小鼠心房肌细胞存活率下降,提示加热模型构建成功。设52 ℃为加热温度作为热处理组,小鼠HL1心房肌细胞的凋亡率、炎症介质IL1β和IL6以及丙二醛释放均增加,细胞存活率及SOD活性下降,该结果提示,热损伤效应可造成心房肌细胞凋亡、炎症和氧化应激。符合既往研究中RF及热处理对组织细胞产生损伤的研究结果[16-17]。
快速性心律失常射频消融治疗中导管大头材料的更新允许我们在RF术中可经导管灌注不同药物,目前常规用冷盐水灌注冷却导管减少阻抗上升从而造成有效消融[18],本团队前期临床研究表明经导管灌注胺碘酮溶液可有效提高RF效率,降低术后复发率[12]。胺碘酮因广谱抗心律失常作用被广泛应用于临床,其不良反应也逐渐被报道:最严重的副作用是肺毒性[19-20],也可引起肝毒性[21]、甲状腺毒性[22]、视神经毒性[23]等,静脉注射时可引起静脉炎[24]。研究表明胺碘酮可促进大鼠肾组织MDA和IL-6显著增加[25];可引起大鼠肺组织MDA的增加和SOD的减少[26];胺碘酮能提高人肺上皮细胞的Bax和Caspase 3的表达诱导凋亡[27];可剂量依赖性地增加视网膜色素上皮细胞活性氧ROS 的产生,引发脂质过氧化和细胞凋亡[28],还可诱导肺上皮细胞和肝癌细胞发生自噬[29-30]。这些研究表明胺碘酮可能通过凋亡、炎症、氧化应激促进组织细胞的损伤,胺碘酮作为抗心律失常药应用于射频消融围手术期符合临床规范,本团队前期创新性使用胺碘酮灌注于房颤射频消融病灶处,发现可提高术中转窦率,减少术后复发[12],基于这一发现,结合胺碘酮对组织细胞的毒性作用,我们推断其原因可能为胺碘酮在RF术中的灌注应用导致消融点之间的心房肌组织损伤加重从而达到更有效的肺静脉隔离,本研究用动物心房肌细胞加热加药模型模拟RF联合应用胺碘酮探索损伤变化,预实验用0、3、10、30、60、90 μmol/L等不同浓度的胺碘酮干预后测定细胞存活率变化,发现6个浓度梯度下的胺碘酮溶液均可降低心肌细胞存活率,最终选用降低25%细胞存活率的30 μmol/L胺碘酮浓度作为后续实验条件,加入胺碘酮溶液后的心房肌细胞存活率进一步下降,SOD活性进一步下降,凋亡率进一步增加,炎症因子、丙二醛进一步增加,说明胺碘酮促进了热损伤引起的小鼠心房肌细胞凋亡、炎症和氧化应激的发生。此结果亦符合前述胺碘酮促进组织细胞损伤增加的既往研究。
本实验的加热条件52 ℃未造成细胞全数死亡,仅造成约25%的细胞活性下降,模拟了临床上射频消融治疗时消融点之间不完全损伤的受热环境,本研究中将胺碘酮加入水浴加热的心房肌细胞模拟了临床上心房射频消融术中经大头导管灌注胺碘酮的应用。胺碘酮促进加热后小鼠HL1心房肌细胞的凋亡、炎症反应和氧化应激。此为本实验的创新发现。可能为胺碘酮提高房性快速性心律失常射频消融手术效率提供了细胞层面的依据,也引发了射频消融可联合灌注不同药物从而改善手术效率的思考与探索。
综上所述,本研究揭示了热处理可诱导小鼠HL1心房肌细胞的凋亡、炎症、氧化应激的表达,胺碘酮可通过促进凋亡、炎症、氧化应激从而加重热处理造成的细胞损伤。我们首次揭示胺碘酮对热处理的心房肌细胞有促损伤作用,但促进细胞损伤的具体机制有待进一步研究。尽管本研究采用体外水浴加热的方法较好地模拟了热消融术中消融点之间的亚致死性高热区损伤,但是,研究对象小鼠HL1心房肌细胞却脱离了体内环境。在细胞水平上探索得到的作用效果与动物实验及临床实践尚存在一定差距。因此,胺碘酮对射频消融心房肌组织的影响及其作用机制仍需结合临床及动物实验进行深入研究。

