Angiotensin II 通过氧化应激引起巨噬细胞AMPK/SIRT1 能量信号紊乱
肖 珊,马郁文,李 婧,张彦红,何 泓,方春香,王万铭
1华中科技大学同济医学院附属武汉市中心医院药学部,湖北 武汉430014;2广州中医药大学中药学院,广东广州511400;3广州市第一人民医院中医科,广东 广州511400;4广州医科大学第三附属医院妇产科,广东 广州511400;5长江航运总医院,湖北 武汉430000;6武汉脑科医院,湖北 武汉430000
心血管疾病在全球范围内有着很高的致死率,其发病机制是一个非常复杂的过程,包括了炎症的发生以及血管的病变等[1-2]。血管紧张素II(Ang II)是RAAS的血管活性肽,具有强效收缩血管作用,与心血管疾病的发生发展密切相关,在高血压调节中起重要作用[3-4]。Ang II通过与特定受体结合来调节自身作用从而调节心血管稳态,AT1受体参与血管紧张素的主要病理生理作用[5-6]。在低血压状态下,Ang II通过AT1激活RAS系统后,通过促进Ca2+流入增加引起的血管收缩,减少NO 产生并且刺激醛固酮的产生,同时增加炎症因子的表达,从而能促进自身免疫功能障碍的发展[7-8]。单磷酸腺苷活化蛋白激酶AMPK是一种应激活的蛋白酶,是细胞ATP水平的代谢传感器,是关键调节因子也是一种氧化还原敏感酶[9]。SIRT1是一种NAD+依赖的去乙酰化酶,在炎症反应和免疫中发挥多种作用[10]。研究发现AMPK 的激活可提高细胞内NAD+浓度,从而激活SIRT1的表达。AMPK和SIRT1对机体的能量代谢敏感,两者发挥着协调作用共同维持着机体能量稳态[11]。近年来有文献报道,Ang II通过抑制AMPK/SIRT1通路促进心血管疾病的发生发展[12-13],但是具体的机制尚未阐明。本研究通过构建Ang II抑制巨噬细胞AMPK/SIRT1通路的活化的细胞模型进一步探讨其具体机制。
1 材料和方法
1.1 药品与试剂
Ang II(SIGMA,SML0142),Lipofec-tamine 3000转 染 试 剂 盒(Invitrogen,L3000075),DMED-F12(Gibco,C11875500BT);胎牛血清(Gibco,10091148);0.25%EDTA 胰酶(Gibco,25100-056);青霉素/链霉素(Gibco,15140-122);活性氧ROS 试剂盒(南京建成,E004);SOD试剂盒(南京建成,A001-3);MDA试剂盒(南京建成,A003-1);AT1 抗体(Affinity,DF4910)PAMPK 抗体(Abcam,ab18528);AMPK 抗体(CST,5832S);SIRT1 抗体(Santa,SC-515045);β-actin 抗体(Boster,BM0627);Anti-Rabbi(CST,7074S);Anti-Mouse(CST,7076S)。
1.2 仪器与设备
Western blot 电泳仪(型号:PowerPacTM HC,BIO-RAD);化学发光成像仪(型号:TANON 5200,TANON)。激光共聚焦荧光显微镜(型号:LSM800,ZEISS)。
1.3 实验方法
1.3.1 细胞培养 小鼠巨噬细胞(RAW264.7)购于ATCC。RAW264.7 细胞的培养用含10%胎牛血清和1%青霉素-链霉素的DMEM-F12 完全培养基,37 ℃的5%CO2细胞培养箱。将细胞接种到6 孔板,待细胞融合度达60%时,给予不同浓度的Ang II(0、0.5、1、3、10、20 μmol/L)刺激,24 h后进行试验。
1.3.2 Western blot 检测 AT1,AMPK,P-AMPK,SIRT1的表达,RIPA 细胞裂解液(Themor Scientific,Rockford,USA)提取各分组的总蛋白,用BCA(碧云天)试剂盒测定浓度,加入5×蛋白上样缓冲液,然后金属浴100 ℃蛋白变性5 min,于-20 ℃保存。配制12%分离胶和5%浓缩胶进行凝胶电泳,电泳结束后将蛋白转移到0.22 μmol/L PVDF膜上,5%脱脂牛奶封闭1 h,分别用AT1,AMPK,P-AMPK,SIRT1,β-actin 抗体孵育,先室温孵育1 h,然后4 ℃过夜,TBST洗3次后,二抗孵育2 h,TBST 洗3 次,再使用ECL 法曝光显影。采用Image J 软件进行对蛋白条带灰度值的计算。
1.3.3 检测SOD 和MDA 的表达 96 孔板接种细胞,待RAW264.7细胞融合度达60%时给予Ang II 刺激,24 h后吸取细胞上清液,用来检测SOD活性和MDA表达量。
1.3.4 实时细胞检测仪检测细胞ROS 96孔板接种细胞,1万/孔巨噬细胞,5~6 h后给予不同浓度的Ang II干预,刺激24 h后,吸出细胞培养基,用含DCFH-DA探针20 μmol/L的PBS避光37 ℃孵育细胞30 min,然后用PBS清洗细胞2遍,最后加入150 μL/孔PBS,放入实时细胞检测仪里,用其荧光显微镜拍照记录。
1.3.5 shRNA细胞转染 巨噬细胞内AT1R 受体的沉默运用shRNA 技术,利用CRISPR 设计工(gttp://crispr.mit.edu/)编辑CRISPR/Cas9 系统的AT1R受体的基因序列,shRNA 序列合成后,由BBSl酶切导入PX459质粒中。AT1R 受体shRNA 的序列为:5'-CTTTCTTCT AAATCTCGCCC-3'。采用Lipofectamine 3000转染试剂盒转染细胞。
1.3.6 ROS 抑制剂干预 将细胞接种到六孔板中,分组为Ang II刺激组和Apocynin抑制组,贴壁后用20 μmol/L Ang II以及100 μmol/L Apocynin刺激细胞24 h,提取蛋白。
1.4 统计学方法
用SPSS17.0 对数据进行统计学分析,所有数据均以均数±标准差表示,多组间采用单因素方差分析进行统计,两组间采用独立样本t检验,P<0.05 为差异具有统计学意义。
2 结果
2.1 Ang II抑制巨噬细胞AMPK/SIRT1信号通路
分别给予RAW264.7不同浓度的Ang II(0、0.5、1、3、10、20 μmol/L),刺激24 h后检测P-AMPK、AMPK、SIRT-1 蛋白的表达量。与对照组相比,0.5~10 μmol/L的Ang II 的干扰对细胞蛋白的表达无明显变化,但20 μmol/L的Ang II的刺激能显著抑制蛋白AMPK的磷酸化(图1A、B),同时抑制SIRT1 的表达(图1C、D)。
2.2 Ang II活化巨噬细胞的氧化应激反应
分别不同浓度剂量的Ang II(0、0.5、1、3、10、20 μmol/L)刺激巨噬细胞,刺激24 h后用实时细胞检测仪显微镜拍照细胞内ROS 的荧光强度。结果显示,与对照组相比,0.5~10 μmol/L Ang II 处理后细胞的ROS 的释放没有明显增加,而20 μmol/L 的Ang II刺激明显增加了细胞ROS的释放(图2A、B)。在检测SOD活性和MDA表达量时,0.5~10 μmol/L的Ang II对细胞无明显改变,20 μmol/L的AngII明显抑制SOD 活性(图2C),能显著增加MDA的产生(图2D)。

图1 Angiotensin II 对巨噬细胞AMPK/SIRT1 信号通路的影响Fig.1 Effect of angiotensin II on AMPK/SIRT1 signaling pathway in macrophages. A, B: Western blotting of AMPK and p-AMPK in angiotensin II-treated macrophages(n=3).*P<0.05 vs 0 μmol/L.C,D:Western blotting of SIRT1 in angiotensin II-treated macrophages(n=3).*P<0.05 vs 0 μmol/L.
2.3 shAT1R 巨噬细胞阻断了Ang II 对AMPK/SIRT1信号通路的抑制作用
将细胞分为scramble组和shAT1R组,给予20μmol/L有效剂量Ang II的刺激,24 h后检测P-AMPK、AMPK、SIRT1蛋白的表达量。Scramble 组与对照组相比,刺激组的AMPK 的磷酸化和SIRT1蛋白的表达量均减少;但shAT1R组中,与对照组相比较,Ang II 刺激后细胞的AMPK的磷酸化水平和SIRT1蛋白的表达量均没有明显改变(图3)。
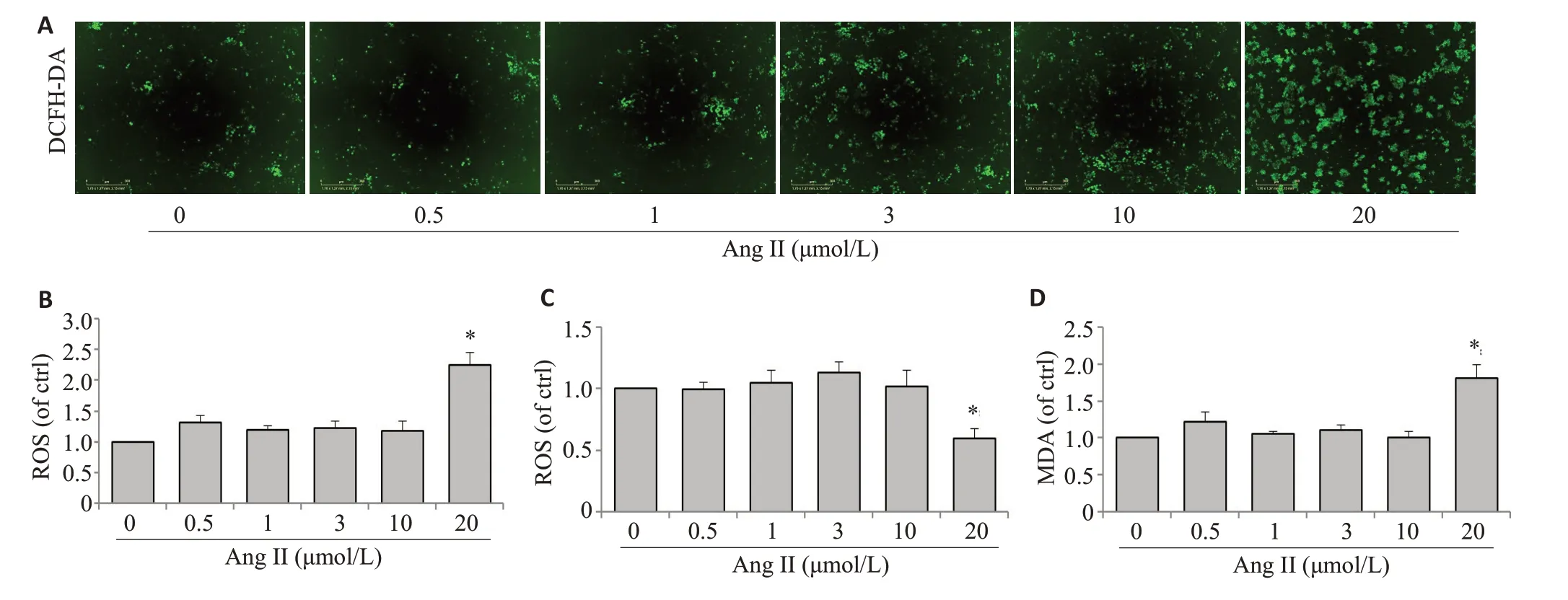
图2 Angiotensin II 对巨噬细胞的氧化应激反应的影响Fig.2 Effect of angiotensin II on oxidative stress response in macrophages.A,B:Quantitative analysis of ROS expression stained with DCFH-DA by flow cytometry.C:SOD activity in RAW264.7 cells stimulated with 0,0.5,1,3,10,and 20 μmol/L angiotensin II.D:MDAlevels in RAW264.7 cells stimulated with 0,0.5,1,3,10,and 20 μmol/Langiotensin II.*P<0.05 vs 0 μmol/L.
2.4 shAT1R巨噬细胞抑制Ang II对活性氧的释放
将细胞分为scramble 组和shAT1R 组,给予20 μmol/L有效剂量Ang II的刺激,24 h后分别检测细胞内ROS 的释放量,以及SOD 活性和MDA 的表达量。单纯对比Ang II刺激组,scramble组的ROS释放量和MDA的表达量明显高于shAT1R组,且scramble组的SOD活性低于shAT1R组(图4)。
2.5 ROS 抑制剂APO 能阻断Ang II 对AMPK/SIRT1信号通路的抑制作用
将细胞分为对照组、Ang II刺激组和APO 抑制剂组,Ang II刺激组给予20 μmol/L有效剂量Ang II的刺激,APO抑制剂组在给予20 μmol/L 有效剂量Ang II的刺激的同时,加入100 μmol/L的APO处理24 h。结果显示,与Ang II刺激组相比,APO抑制剂组中AMPK的磷酸化和SIRT1蛋白的表达水平有所增加。

图3 Angiotensin II 对shAT1R 巨噬细胞AMPK/SIRT1 信号通路的影响Fig.3 Effect of angiotensin II on AMPK/SIRT1 signaling pathway in macrophages with AT1R gene silencing.A, B: Western blotting showing the efficiency of AT1R gene silencing (*P<0.05). C, D: Western blotting showing the effects of Ang II and AT1R gene silencing on the expressions of AMPK and p-AMPK(n=3).**P<0.05;##P<0.01.E,F:Western blotting showing the effects of Ang II and AT1R gene silencing on the expression of SIRT1 (n=3).**P<0.05.##P<0.01.
3 讨论
本研究证明了在巨噬细胞中,过多的ROS合成可以抑制AMPK/SIRT1信号通路激活。结果证明,Ang II激活AT1受体会促进ROS的合成增加,从而抑制了磷酸化AMPK和SIRT1的表达,shRNA敲减AT1受体后会抑制巨噬细胞中ROS的生成以及促进AMPK磷酸化水平和SIRT1的表达。使用ROS抑制剂APO可以阻断AT1受体激活后对AMPK磷酸化水平和SIRT1蛋白表达的抑制作用。
AMPK是一种丝氨酸/苏氨酸蛋白激酶,在调节细胞代谢中充当能量传感器[14]。SIRT1主要位于细胞核中,它参与了心脏中能量产生,氧化应激,细胞凋亡和细胞内信号传导的生物学功能[15-16]。SIRT1是一种AMPK调控的NAD+依赖性蛋白去乙酰化酶,AMPK可以通过增加NAD+/NADPH比值来充当SIRT1激活剂,同时SIRT1也能调节AMPKα的活性[17-19]。文献报道AMPK/SIRT1通路可以调节血管紧张素II在体内和体外诱导心脏肥大和损伤[20],使用基因突变小鼠模型的研究表明SIRT1 具有抗动脉粥样硬化的作用,过表达SIRT1减轻了Ang II诱导的小鼠血管重构和高血压[21]。炎症与心血管疾病的发病机制和预后密切相关,巨噬细胞在心血管疾病中扮演着重要作用角色[22-23]。近年来有文献报道,血管紧张素Ⅱ处理的小鼠体内巨噬细胞向M1型转化,炎症反应增加,出现血压升高,血管功能障碍的现象。其机制可能与巨噬细胞的AMPK/SIRT1信号通路有关[24-25]。本研究数据表明,在20 μmol/LAng II的刺激下,巨噬细胞中磷酸化的AMPK的表达水平降低,SIRT1的蛋白表达下降,这说明Ang II在巨噬细胞中能抑制AMPK/SIRT信号通路的活化。
氧化应激反应代表细胞内存在过多的活性氧(ROS),可促进炎症反应的发生并极大地促进心血管疾病的发展。细胞通过连续产生活性氧,以调节细胞的增殖,分化和凋亡等反应[20,26]。Ang II可以通过烟酰胺腺嘌呤二核苷酸磷酸氧化酶刺激ROS的产生并引起炎症[27]。本研究实验数据证明了Ang II能诱导巨噬细胞的ROS 的过度释放,抑制超氧化物歧化酶(SOD)的活性,降低了细胞清除由于细胞新陈代谢产生废物的能力,增加了氧化终产物丙二醛表达量。
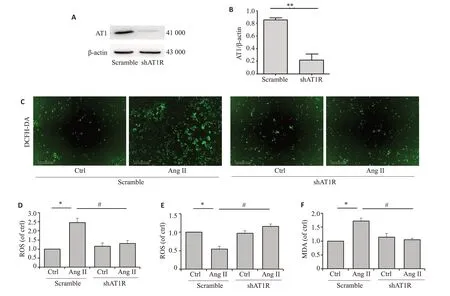
图4 Angiotensin II 对shAT1R 巨噬细胞氧化应激的影响Fig.4 Effect of angiotensin II on oxidative stress response in macrophages with AT1R gene silencing. A, B: Western blotting showing the efficiency of AT1R gene silencing (**P<0.01). C, D: Quantitative analysis of ROS expression in the macrophages stained with DCFH-DA by flow cytometry(*P<0.05;#P<0.05).E:Effect of 20 μmol/L angiotensin II stimulation on SOD activity in RAW264.7 cells transfected with in scramble and shAT1R constructs(*P<0.05;#P<0.05).F:Effect og 20 μmol/L angiotensin II on MDAlevel in RAW264.7 cells transfected with in scramble and shAT1R constructs(*P<0.05;#P<0.05).
血管紧张素Ⅱ1型受体(AT1受体)是肾素-血管紧张素-醛固酮系统的关键分子之一。AT1受体促进多种细胞内信号通路,导致高血压、内皮功能障碍、血管重塑和终末器官损伤。通过激活AT1,血管紧张素(Ang)II驱动血流动力学损伤,随后单核细胞和其他炎症细胞在高血压期间进入心脏、血管和肾脏[28]。目前文献报道激活AT1受体对巨噬细胞的功能有影响。巨噬细胞中的AT1可以调控NF-kappaB的活性,AT1的激活会促进脂质的积累、迁移和细胞因子的产生,同时使动脉粥样硬化病变内巨噬细胞群的分布向促炎性M1表型发展,减少M2巨噬细胞的表型,巨噬细胞中AT1受体敲除后,阻碍了UNX对M2巨噬细胞表型的转化的影响[29]。有文献报道,使用AT1 受体拮抗剂替米沙坦会增加AMPK 的磷酸化水平,促进AMPK信号通路的活化来抑制内质网应激[30]。为了验证巨噬细胞中AT1受体和AMPK/SIRT1的关系,在本实验中,成功沉默了巨噬细胞的AT1R受体后,发现Ang II的刺激对AMPK的磷酸化无影响,同时SIRT1蛋白的表达量也没有变化,证明在巨噬细胞中Ang II是通过AT1 受体对AMPK/SIRT1通路进行调控的。在动脉粥样硬化模型中,选择性血管紧张素Ⅱ1型受体阻断剂氯沙坦可抑制ROS的产生[31]。为了验证巨噬细胞中AT1受体是否会影响ROS的合成,本研究在敲除AT1受体的巨噬细胞中,检测ROS的水平。实验结果证明沉默AT1 受体后,Ang II无法增加ROS的合成,以及抑制了抗氧化酶SOD的活性。
有文章报道ROS 可以作用于AMPKα 亚基上对氧化还原敏感的半胱氨酸残基(Cys-299/Cys-304)来调控AMPK的活性[32],另外使用ROS抑制剂N-乙酰半胱氨酸可以降低SIRT1的磷酸化[33]。为了进一步验证巨噬细胞中ROS跟AMPK/SIRT1的关系,本研究使用ROS的抑制剂APO后,Ang II的刺激不能减弱AMPK 磷酸化水平,也无法降低SIRT1 的蛋白表达量,这证明Ang II 通过AT1 受体促进ROS 氧化应激反应来调控AMPK/SIRT1信号通路。

图5 抑制巨噬细胞氧化应激反应对AMPK/SIRT1 的影响Fig.5 Effect of inhibition of oxidative stress response on AMPK/SIRT1 signaling in macrophages.A, B: Western blotting for detecting the expression of p-AMPK (n=3). C, D: Western blotting for the expression of SIRT1(n=3).**P<0.01;#P<0.05.
综上所述,本文确定了Ang II通过AT1受体可以调控巨噬细胞中的氧化应激反应,从而抑制AMPK/SIRT1信号通路的活化。揭示了AT1受体在Ang II诱导的氧化应激反应中的重要作用。

