土壤微生物燃料电池电极微生物分析及其运行对水稻生长活性的影响
欧阳湖,周 建,任建国,2,王俊丽*
土壤微生物燃料电池电极微生物分析及其运行对水稻生长活性的影响
欧阳湖1,周 建1,任建国1,2,王俊丽1*
(1. 贵州医科大学公共卫生学院, 环境污染与疾病监控教育部重点实验室, 贵阳 550025;2. 贵州省食品营养与健康工程研究中心, 贵阳 550025)
采用盆栽水稻试验,研究微生物燃料电池电极富集微生物种类及其运行对水稻生长活性的影响。用双层琼脂平板法对阳、阴极碳毡微生物进行培养,通过平板计数法计算碳毡富集微生物数量。通过细菌个体形态、生理生化试验及16SrDNA分析确定其分类地位;用称重、α-萘胺氧化法研究微生物燃料电池运行(闭路组)对水稻生长活性的影响。成功构建微生物燃料电池。闭路组阳极细菌B1、B2和B3总量是3.4×108CFU·g-1,其中优势微生物B1为2.9×108CFU·g-1。开路组(组装有微生物燃料电池,但处于断路状态)阳极细菌B1、B3和B4总量是1.5×108CFU·g-1,其中优势微生物B3为1.1×108CFU·g-1,闭路组与开路组阴极都只培养出B3和B4,闭路组阴极B4数量是开路组的7倍;闭路组与空白组(未组装有微生物燃料电池)、开路组相比,在水稻须根数方面无显著差异,但在植株鲜重、干重及根系活力方面存在明显差异。在所有分析指标中,空白组和开路组间无明显差异。微生物燃料电池(MFC)运行能促进水稻的生长和产电微生物B1()和B2(sp.)在阳极碳毡的富集。
微生物燃料电池;优势微生物;水稻;生长;产电微生物
微生物燃料电池[1-2](microbial fuel cell,MFC)利用具有产电能力的微生物在分解有机物的同时产生电子,利用这些电子的定向移动构建闭合回路就能产生电流。通常阴极为有氧化剂存在的环境,如氧气。阳极为厌氧环境,此类为最基础的微生物燃料电池。若阴极为厌氧环境,表明阴极存在作为电子受体的物质,如尿素和硝酸盐等化合物,此类称为生物阴极型MFC。因为MFC可以将有机物的化学能转换为电能,存在清洁无污染、成本低、效率高、可持续且适用性广泛等优点,所以对解决有机物污染严重的环境问题具有较好的实用性[3-4],同时对于开发新的清洁能源有前瞻性的意义。
利用土壤中的产电微生物修复土壤[5]同步产电的研究越来越热门,Wang等[6]采用微生物燃料电池处理石油污染土壤的研究中发现,运行微生物燃料电池显著加速土壤中烷烃和多环芳烃化合物的降解。Habibul等[7]对MFC驱动的有毒金属污染土壤原位电动修复的可行性进行了研究,经过143 d和108 d的运行,阳极区Cd和Pb的去除率分别达到31.0%和44.1%。在田静[5]的研究中,以石油污染的土壤作为基质构建微生物燃料电池,结果表明该电池在长时间产电的同时还强化了微生物对石油的降解作用,在阳极和土壤中均检测出了假单胞菌属()、微杆菌属()等产电微生物,而阳极表面的优势菌为地杆菌属()。土壤微生物燃料电池用于修复多环芳烃污染土壤的研究中表明电极间距越小,多环芳烃的产电量和去除率越高,以为主的细菌会在电池阳极表面富集[8]。Cao等[9]构建无膜单室土壤MFCs降解土壤中难降解的有机农药六氯苯(HCB),结果表明,40 mg·kg-1、80 mg·kg-1和200 mg·kg-1土壤中HCB的去除率分别为71.14%、62.15%和50.06%,分别比对照高18.65%、18.46%和19.17%。林博[10]对水稻土微生物燃料电池的阳极微生物群落进行检测,通过16S克隆文库进行测序表明,主要的细菌群体为、、、、、、和。不是所有微生物都能作为产电微生物,至今发现的产电菌以变形菌()为主,厚壁菌因为在电子的传导过程中存在很大缺点而被研究的较少。近年来,酵母菌也被学者发现可以用于MFC的研究。所以对于阳极微生物群落的多样性[11-12]及优势微生物的研究将会对产电微生物的筛选与运用提供参考。为此,本研究计划通过室内水稻种植模拟试验,研究微生物燃料电池运行对水稻生长活性的影响并对其电极微生物进行分析,为MFC的推广应用提供参考。
1 材料与方法
1.1 供试材料
水稻幼苗(4叶期)取自贵州省农科院水稻所,品种为粳稻‘日本晴’,属于耐冷型品种。
1.2 试验方法
1.2.1 微生物燃料电池构建 微生物燃料电池为无膜单室微生物燃料电池[13],阴阳极之间用直径为5 mm,长134 cm的铜导线串联一个10 Ω的可调节电阻箱,另用60 cm长的同规格导线接入一个毫伏表并联到电路中;电池的阴阳极均由树脂固定直径为6 mm,长300 mm的碳棒(含碳量99.999%)于长70 cm,宽50 cm,厚5 mm的碳毡上制作而成,其中阳极碳毡中心剪除60 cm×40 cm,空露部分用以种植水稻。在塑料容器(长75 cm,宽52 cm,高35 cm)中,称取11 kg未种植过水稻的土壤(pH6.16,有机质44.265 g·kg-1,全氮2.712 g·kg-1,全磷1.264 g·kg-1,全钾12.011 g·kg-1)均匀铺在容器底部,将制作好的阴极放在土壤上方后用23 kg土壤覆盖,再向容器中加入12 L水,阳极材料悬浮于水面。实验设置有开路组(组装有微生物燃料电池,但处于断路状态)、闭路组(组装有微生物燃料电池,且处于闭路状态)和空白组(未组装有微生物燃料电池),各有3个重复。电阻两端的电压通过毫伏表(上海第二表厂)定时采集(每隔8 h采集一次数据)。MFC装置如图1。
1.2.2 水稻种植及敌百虫的喷施 选取同一品种大小相似的5叶期水稻苗种植于已运行的MFC中,每个塑料容器内梅花点状式选取5个点,每个点种植2株,种植20 d后给植株喷施尿素,26 d后开始施用敌百虫,连续喷洒2次,间隔期为10 d。每个容器喷施的敌百虫溶液的体积(50 mL)和浓度相同(2 g 90%的敌百虫溶解于50 mL的水中)。
1.2.3 电极微生物的分离培养与鉴定 电池运行60 d后,分别称取闭路组和开路组阴、阳两极的碳毡10 g(含水量为77.64%),参考黄燕新等[14]的方法对微生物进行分离计数,再通过普通肉汁胨琼脂平板划线法进行纯化。纯化出的细菌按照李振高等[15]的实验方法进行传统分类鉴定,并对阴、阳极优势细菌进行16SrDNA分析。使用DNA提取试剂盒提取优势细菌DNA,选择引物27F和1495R 进行DNA扩增[16],将未纯化PCR扩增产物送往贵阳NEST生物技术公司(金斯瑞分公司)测序,测定结果通过NCBI网站中的BLAST程序搜寻近缘物种,用MAGA5.0构建系统进化树,结合细菌传统分类鉴定结果以此确定细菌的属种。

图1 MFC装置示意图(侧面)
Figure 1 Schematic diagram of MFC (side)
1.2.4 水稻生物量及根系活力测定 第2次喷洒敌百虫35 d(抽穗期)后测定水稻的生物量,包括须根数、植株鲜重、干重和水稻根系活力,不同处理组(开路组,闭路组和空白组)各重复3次。取不同处理组的水稻苗于自来水下冲洗干净后,置于滤纸上室温阴干,称其鲜重,同时计数须根数。清洗干净的水稻植株置于105 ℃烘箱中至恒重,测定其干重。在水稻返青分蘖生长45 d后随机选取水稻苗,将其根系依次用自来水和蒸馏水洗净,滤纸吸干后称取1~2 g放入锥形瓶中用于根系活力测定,具体测定方法参考丁汉卿方法[17]。
2 结果与分析
2.1 微生物燃料电池运行特性
MFC部分运行采集数据如图2所示,96 h采集数据后给水稻施用尿素,240 h和472 h采集数据后喷施敌百虫溶液。从图2中发现,施肥和施药后电压都有明显增大趋势,且能持续一段时间,但表现方式有所不同。施肥(尿素)后的72 h内电压有小幅度的增加,72~120 h内电压有较大幅度的增加,引起这种现象变化的主要原因可能是由于尿素在土壤中一系列转变引起的,包括尿素的氨化作用、氨在土壤中沉积(铵离子形成)和铵离子的微生物氧化作用(释放质子)[18]。在外阻(10 Ω)恒定的条件下,电压大幅度的增加意味着更多铵离子参与到微生物的氧化作用中产生更高电流强度。连续施用2次(间隔232 h)敌百虫溶液后电压变化趋势基本一致,施药后40 h电压达到最大值,其后随着时间的延长,电压呈现下降趋势。在施肥与施药后,微生物燃料电池电压出现高峰值的时间有所不同,这可归咎于微生物燃料电池中“燃料”(可氧化底物)存在与否及其浓度大小。土壤施用尿素后转变为铵离子(燃料)需要一系列过程[17],因而其经微生物氧化产电达到电压高峰值所需时间较长,而敌百虫可直接被微生物氧化降解[19],因而电池电压出现高峰值所用的时间较短。施肥或施药后微生物电池电压高峰值有所不同,或许与不同时期土壤微生态中微生物种类、数量[20]或根系发育[21]有关。
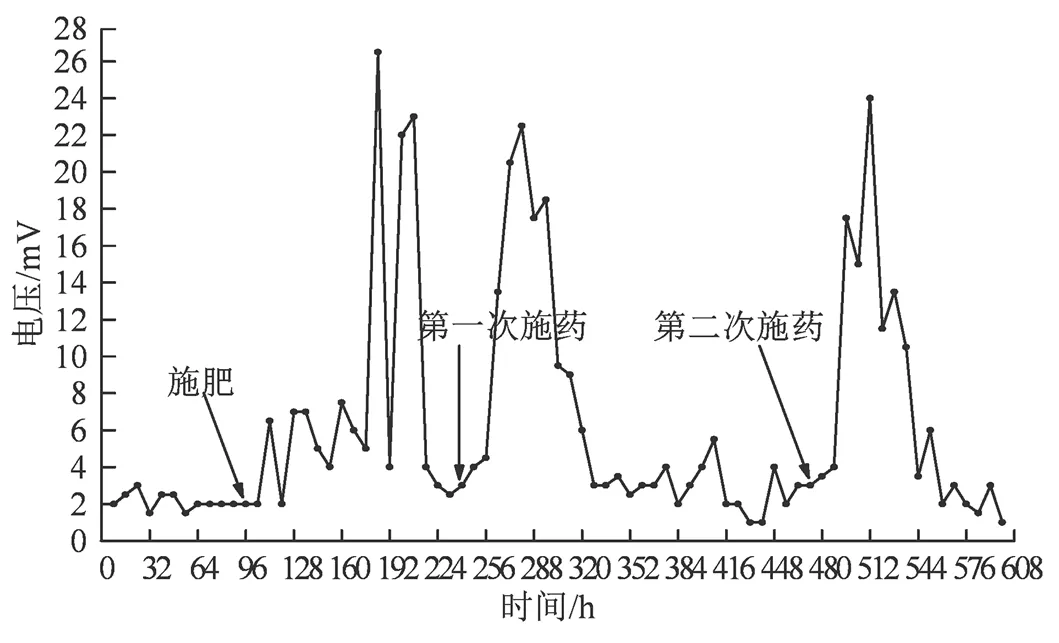
图2 闭路组电压变动图
Figure 2 Fluctuation diagram of closed circuit group voltage
2.2 MFC电极微生物分析
闭路组和开路组阴、阳极共培养出4种细菌,分别编号为B1、B2、B3和B4,结果如表1(选取10-7稀释度平板计数)。闭路组阳极细菌有B1、B2和B3,优势细菌是B1,开路组阳极细菌有B1、B3和B4,优势细菌是B3,闭路组阳极细菌总量是开路组的2倍,优势细菌是开路组的2.9倍。细菌B2仅在闭路组阳极培养出。这些结果与吴义诚等[22]的试验结果相似,其结果表明沉积型微生物燃料电池在开、闭路条件下启动阳极不同生物膜形成,细菌群落在门水平差异最明显的为不同比例的、和存在,即MFC开路、闭路条件影响电极的微生物群落结构。本研究中开、闭路组阴极都只培养出B3和B4细菌,且闭路组阴极的B4细菌数量是开路组的7倍,而开路组阴极细菌B3的数量是闭路组的1.8倍,说明MFC的运行对阴、阳极的细菌种类和数量有影响。另外在本研究构建的生物阴极型MFC中,细菌B4很可能参与阴极生物学反应,这与Holmes等[23]发现的沉积型MFC的产电运行与阴极微生物()参与生物学反应有关。B4-不动杆菌()的存在有利于生物膜的形成,MFC阴极生物膜的存在可以提高MFC的放电性能[24-26]。说明在闭路组阴极富集的B4(sp.)有利于MFC良好运行。

表1 闭路组和开路组阴、阳极细菌数量
注:同列数据间小写字母不同者为差异显著(<0.05)。下同。

表2 4株细菌传统分类试验结果
注:“+”代表阳性,“-”代表阴性,“NS”为未做。
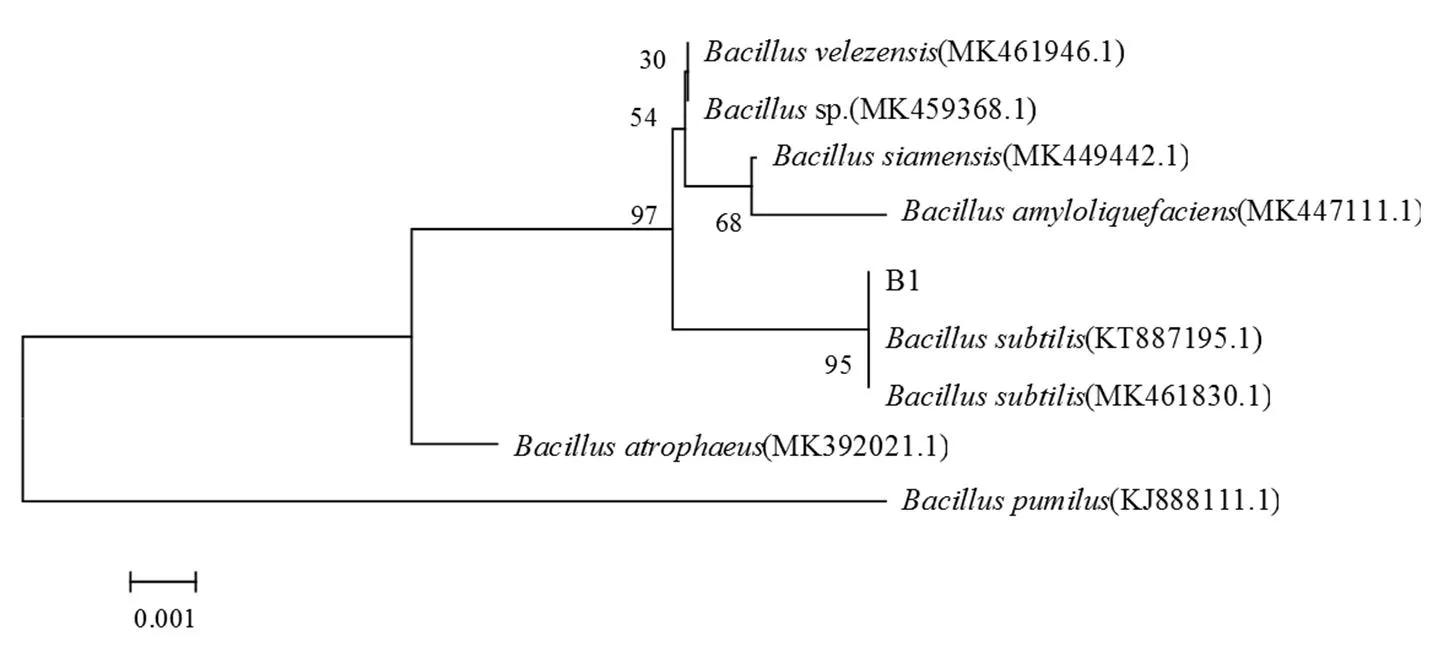
图3 基于16S rDNA序列的B1系统进化树构建
Figure 3 Construction of B1 phylogenetic tree based on 16S rDNA sequence

表3 不同处理组对水稻生物量和根系活力的影响
4株细菌的革兰染色和系列生理生化试验分析,结果见表2。利用测序获得的细菌B1 16S rDNA序列进行Blast分析,利用MEGA5.0构建系统进化树见图3,而细菌B2,B3和B4测序结果进行Blast同源性收索,结果分别与sp.(MN519570.1),(MH261024.1),(MK286953.1)等;(MK743993.1),sp.(MT071.452.1),(AP022643.1)等;(NR117624.1),sp.(LR735479.1),sp.(MN988672.1)等菌株序列相似性达100%。根据细菌种属检索表[15]和分子鉴定结果,将B1、B2、B3和B4分别鉴定为,sp.,sp.和sp.。B1()在闭路组MFC阳极上数量最多,这与谢作甫等[27]总结的关于产电微生物种类结果相符—枯草芽孢杆菌()是常见的产电微生物。 Nimje等[28]的研究结果也表明,枯草芽孢杆菌具有电化学活性,是一种可以产生64.0 mAm-2电流密度的潜在产电细菌[29]。在MFC中,用枯草芽孢杆菌纯培养法对甘油进行了产电降解,稳态极化曲线表明其最高功率密度为0.06 mWcm-2[30]。Hassan等[31]对石化工业微生物集合体(IMC)和本地微生物集合体(DMC)接种的MFC降解2,4-二氯苯酚反应器中的微生物群落鉴定中发现以sp.为主的IMC菌群具有较高的产电量(156 mAm-2),酚降解率达41%。Wang等[32]研究表明湿地MFC运行对菲、蒽的平均清除率为88.5%~96.4%,细菌群落分布研究表明对难降解有机物有降解能力的、、和的丰度显著增加,特别是能够分泌过氧化氢酶的芽孢杆菌属(sp.)。本研究构建可降解敌百虫的生物阴极MFC(另文发表)的阳极微生物分析表明,(B1)和sp.(B2)存在富集,这与前人关于sp.具有产电性能的报道相符。
2.3 MFC运行对水稻生物量及根系活力影响
闭路组、开路组及空白组水稻根系须根数、鲜重、干重和根系活力数据见表3,3组的须根数、鲜重、干重和根系活力分别为(16±3)、(18±6)、(17±2)个;(3.444±0.441)、(1.734±0.601)、(1.916±0.369 )g;(0.916±0.123)、(0.625±0.249)、(0.720±0.221)g和(363.904±20.695)、(179.345±3.642)、(189.616±189.8)µg(g·h)-1。在须根数量上,3个处理组间无显著差异,但在鲜重、干重和根系活力方面,闭路组与开路组、空白组间存在明显差异,而开路组与空白组间差异不明显。三种不同处理下水稻须根数量没有发生明显变化,这与水稻须根发育形成受其基因所调控有关[33]。在水稻鲜重和干重方面,闭路组明显高于开路组(或空白组),其结果与张海芹等的MFC应用试验结果相同[34],究其原因可能是MFC的运行降低了土壤敌百虫的浓度,进而缓减了其对水稻的不利作用或发挥了MFC清除逆境胁迫下自由基的作用[35]。在水稻根系活力方面,闭路组明显高于开路组(或空白组),有研究表明芽孢杆菌属对于水稻生长具有明显的促进作用[36-37],MFC运行在阳极富集了大量芽孢杆菌,这对水稻的生长具有良好作用,进而反映了MFC运行下水稻根系强的代谢活性。开路组与空白组在水稻上述各性状间的影响作用不明显,说明了稻田组建应用微生物燃料电池的可行性(无负面影响作用)。
3 结论
敌百虫是稻田虫害化学防治的常用有机磷农药,其在土壤中的残留会通过食物链进而影响人类健康。本研究以经施用过敌百虫的水稻土壤成功构建了单室微生物燃料电池,该电池不仅能促进水稻的生长,提高水稻的生物量,还能显著增强水稻的根系活力,这与微生物燃料电池产电运行有关。而MFC电极微生物群落结构的变化是维持MFC运行的主要原因,且芽孢杆菌B1和B2与产电密切相关。本研究将为MFC在稻田中的应用提供参考。
[1] 王维大, 李浩然, 冯雅丽, 等. 微生物燃料电池的研究应用进展[J].化工进展, 2014, 33(5): 1068-1070.
[2] 林乔, 王黎, 张捷, 等.微生物燃料电池的研究进展[J]. 湖北农业科学, 2014, 53(18): 4257-4260.
[3] 杨永刚, 孙国萍, 许玫英. 微生物燃料电池在环境污染治理研究中的应用进展[J]. 微生物学报, 2010, 7(4): 847-850.
[4] 吴春英, 谷风, 白鹭. 微生物燃料电池应用于环境领域的最新研究进展[J]. 桂林理工大学学报, 2015, 35(3): 5572-574.
[5] 田静. 土壤微生物燃料电池修复复合污染土壤的实验研究[D]. 北京: 北京化工大学, 2016.
[6] WANG X, CAI Z, ZHOU Q, et al. Bioelectrochemical stimulation of petroleum hydrocarbon degradation in saline soil using U‐tube microbial fuel cells[J]. Biotechnol Bioeng, 2012, 109(2): 426-433.
[7] HABIBUL N, HU Y, SHENG G P. Microbial fuel cell driving electrokinetic remediation of toxic metal contaminated soils [J]. J Hazard Mater, 2016, 318: 9-14.
[8] YU B, TIAN J, FENG L. Remediation of PAH polluted soils using a soil microbial fuel cell: Influence of electrode interval and role of microbial community[J]. J Hazard Mater, 2017, 336: 110-118.
[9] CAO X, YU C, WANG H, et al. Simultaneous degradation of refractory organic pesticide and bioelectricity generation in a soil microbial fuel cell with different conditions[J]. Environ Technol, 2017, 38(8): 1043-1050.
[10] 林博. 水稻土微生物燃料电池阳极微生物群落结构及对底物的差异响应[D]. 北京:中国农业大学, 2015.
[11] 朱娟平, 王健, 张太平, 等. 湿地植物-沉积物微生物燃料电池阳极微生物群落多样性研究[J]. 环境科学学报, 2016, 36(11): 4017-4024 .
[12] LI C, ZHANG L B, DING L L, et al. Effect of conductive polymers coated anode on the performance of microbial fuel cells (MFCs) and its biodiversity analysis[J]. Biosens Bioelectron , 2011, 26(10): 4169-4176.
[13] 王辉, 李蕾, 曹羡, 等. 土壤微生物燃料电池在不同条件下的产电性能及微生物群落结构分析[J].东南大学学报(自然科学版), 2017, 47(6): 1141-1147.
[14] 黄燕新, 李萍, 颜幼平. 微生物燃料电池阳极产电菌的选育[J]. 广东化工,2010, 37(7): 137-1383.
[15] 李振高, 骆永明, 滕应. 土壤与环境微生物研究法[M]. 北京: 科学出版社, 2008.
[16] 郑丹, 王吉腾, 张志勇, 等. 梨园土壤细菌群落参数及优势细菌的16SrDNA分析[J]. 中国农学通报, 2008, 24(6): 379-383.
[17] 丁汉卿. 土壤磷铁比和过氧化尿素对水稻根表铁膜形成和水稻镉吸收的影响[D]. 广州:华南农业大学, 2016.
[18] SIGURDARSON J J, SVANE S, KARRING H. The molecular processes of urea hydrolysis in relation to ammonia emissions from agriculture [J]. Rev Environ Sci Bio/Technology, 2018, 17(2): 241-258.
[19] 田江.微生物降解农药的特性及其在土壤复合农药污染修复中的应用[D]. 武汉: 武汉大学, 2017.
[20] JOTHINATHAN D, WILSON R T. Comparative analysis of power production of pure, coculture, and mixed culture in a microbial fuel cell [J]. Energy Sources Part A: Recover Util Environ Eff, 2017, 39(5):520-527.
[21] TIMMERS R A, STRIK D P, HAMELERS H V M, et al. Long-term performance of a plant microbial fuel cell with Spartina anglica[J]. Appl Microbiol Biotechnol, 2010, 86(3): 973-981.
[22] 吴义诚, 邓全鑫, 王泽杰, 等. 开闭路条件下沉积物微生物燃料电池阳极细菌群落差异解析[J]. 环境科学, 2016, 37(12): 4768-4772.
[23] HOLMES D E, BOND D R, O'NEIL R A, et al. Microbial communities associated with electrodes harvesting electricity from a variety of aquatic sediments [J]. Microb Ecol, 2004, 48(2): 178-190.
[24] 尹亚琳, 高崇洋, 赵阳国, 等. 好氧-厌氧混合污泥启动微生物燃料电池产电性能及微生物群落动态特征[J]. 微生物学报, 2014, 54(12): 1471-1480.
[25] ZHAO Y, LI P, WANG X B, et al. Influence of initial biofilm growth on electrochemical behavior in dual- chambered mediator microbial fuel cell[J]. J Fuel Chem Technol , 2012, 40(8): 967-972.
[26] 王井玉, 黄卫民, 王璇, 等. 生物膜电极在以苯酚为燃料的微生物燃料电池中的应用[J]. 高等学校化学学报, 2013, 34(4): 975-979.
[27] 谢作甫, 郑平, 张吉强, 等. 产电微生物及其生理生化特性[J]. 科技通报, 2013, 29(7): 33-34.
[28] NIMJE V R, CHEN C Y, CHEN C C, et al. Stable and high energy generation by a strain of Bacillus subtilis in a microbial fuel cell [J]. J Power Sources, 2009, 190(2): 258-263.
[29] HASSAN H, JIN B, DAI S, et al. Chemical impact of catholytes on Bacillus subtilis-catalysed microbial fuel cell performance for degrading 2, 4-dichlorophenol[J]. Chem Eng J, 2016, 301: 103-114.
[30] NIMJE V R, CHEN C Y, CHEN C C, et al. Glycerol degradation in single-chamber microbial fuel cells[J]. Bioresour Technol, 2011, 102(3): 2629-2634.
[31] HASSAN H, JIN B, DONNER E, et al. Microbial community and bioelectrochemical activities in MFC for degrading phenol and producing electricity: microbial consortia could make differences[J]. Chem Eng J, 2018, 332: 647-657.
[32] WANG J F, SONG X S, LI Q S, et al. Bioenergy generation and degradation pathway of phenanthrene and anthracene in a constructed wetland-microbial fuel cell with an anode amended with nZVI[J]. Water Res, 2019, 150: 340-348.
[33] YOO S C, CHO S H, PAEK N C. Rice WUSCHEL- related homeobox 3A(OsWOX3A)modulates auxin-transport gene expression in lateral root and root hair development[J]. Plant Signal Behav, 2013, 8(10): e25929.
[34] 张海芹, 殷瑶, 吴江, 等. 微生物燃料电池对去除稻田硫离子的影响[J]. 农业环境科学学报, 2013, 32(7): 1355-1360.
[35] KOLEVA R, YEMENDZHIEV H, NENOV V. Microbial fuel cell as a free-radical scavenging tool [J]. Biotechnol Biotechnol Equip, 2017, 31(3):511-515.
[36] CHUNG E J, HOSSAIN M T, KHAN A, et al. Bacillus oryzicola sp. nov., an endophytic bacterium isolated from the roots of rice with antimicrobial, plant growth promoting, and systemic resistance inducing activities in rice[J]. Plant Pathol J, 2015, 31(2): 152-164.
[37] 张荣胜, 戴秀华, 刘永锋, 等. 解淀粉芽孢杆菌 Lx-11 的促水稻生长作用及促生长物质分析[J]. 核农学报, 2018, 32(6): 1230-1238.
Analysis of electrode bacteria of soil microbial fuel cell (MFC) and the effects of its operation on rice growth activities
OUYANG Hu1, ZHOU Jian1, REN Jianguo1,2, WANG Junli1
(1. School of Public Health, Guizhou Medical University, Key Laboratory of Environmental Pollution Monitoring and Disease Control, Ministry of Education, Guiyang 550025; 2.Guizhou Provincial Engineering Research Center of Food Nutrition and Health, Guiyang 550025)
The enriched bacterial genus on the electrodes of MFC and the effects of MFC operation on rice growth activities were investigated in the present study with pot experiments. The bacteria of the carbon felt on the cathodes and anodes were cultured with a two-layer agar plate and counted according to the number of viable colonies on plates. The bacteria were identified based on the characteristics of cell morphology, the results of physiological and biochemical tests and the analysis of 16S rDNA sequence. The effects of MFC (closed circuit group) operation on the growth activities of rice were investigated with weighting and α-naphthylamine oxidation methods. MFC was successfully constructed in this experiment. The results showed that the total quantity of B1, B2 and B3 existing in the carbon felts of the anode in closed circuit group was 3.4×108CFUg-1, especially the dominant strain B1 was 2.9×108CFUg-1. While the whole quantity of B1, B3 and B4 living in the carbon felts of the anode in open circuit group was 1.5×108CFUg-1, and the dominant strain B3 was 1.1×108CFUg-1. Only culturable B3 and B4 appeared in the cathodes of the closed and open circuit group, and the quantity of B4 in the closed circuit group was seven times as that in open circuit group. Compared with open circuit and blank groups, no significant differences existed on the number of fibrous roots for closed circuit group, but the striking differences in fresh and dry weight and root activities. There were no obvious differences among all the items assayed in this experiment for open circuit and blank groups. MFC operation could promote the growth of rice and the enrichment of electrogenic microorganisms B1() and B2()on carbon felts of the anode in the closed circuit group.
microbial fuel cell; dominant bacteria; rice; growth; electrogenic microorganism
X172; S511.061
A
1672-352X (2021)01-0115-06
10.13610/j.cnki.1672-352x.20210319.016
2021-3-23 13:01:35
[URL] https://kns.cnki.net/kcms/detail/34.1162.S.20210319.1544.032.html
2020-04-29
贵州省2017年大学生创新创业训练计划项目(DC201710660008),贵州省科学技术基金项目(黔科合J字[2013]2057号),贵州省区域内一流学科建设项目-公共卫生与预防医学(黔教科研发2017[85]号),贵阳市科技局基金[筑科合同(20151001)社20号]和贵州省高等学校工程研究中心项目(黔教合KY字[2021]008)共同资助。
欧阳湖,硕士研究生。E-mail:923694845@qq.com
王俊丽,博士,副教授。E-mail:411395583@qq.com

