黄条金刚竹的花序建成及雌雄蕊发育
王 星,姜明云,林树燕*,姚文静,丁雨龙
黄条金刚竹的花序建成及雌雄蕊发育
王 星1, 2, 3,姜明云1, 2,林树燕1, 2*,姚文静1, 2,丁雨龙1, 2
(1. 南京林业大学,南方现代林业协同创新中心,南京 210037;2. 南京林业大学竹类研究所,南京 210037;3. 南京林业大学生物与环境学院,南京 210037)
黄条金刚竹(‘Aureostriatus’)是竹亚科东笆竹属()金刚竹的品种之一,叶子具黄条纹,是观赏价值较高的竹种之一。2015年 3月黄条金刚竹在国内出现了自1984年引种以来的首次开花。为了给研究竹类植物花器官的发育提供新的资料信息,通过形态观察和石蜡切片的方法对黄条金刚竹花序形态及胚胎发育过程进行观察与描述,结果如下。(1)花芽分化初期生长点呈半球形;早期花序上顶端小穗原基先发育,侧生小穗原基后发育,各小穗小花发育顺序从下往上;小花分化由外向内,外稃、內稃和浆片原基先分化,雄蕊和雌蕊原基后分化。(2)黄条金刚竹花药壁发育类型为单子叶型,绒毡层为腺质型;小孢子母细胞胞质分裂类型为连续型,花粉粒多为三细胞型。(3)黄条金刚竹胚珠为倒生胚珠,珠被双层,薄珠心,大孢子四分体呈线性,合点端1个大孢子分化成为功能大孢子,功能大孢子经过3次有丝分裂形成八核胚囊;胚囊为蓼型胚囊。研究明确了黄条金刚竹花序建成以及雌雄配子体发育过程,表明黄条金刚竹为混合花序,雌雄配子体发育正常。
黄条金刚竹;花芽分化;雌配子体;雄配子体
竹类植物为禾本科(Gramineae)竹亚科(Bambusoideae)植物的总称。我国竹林资源丰富,第9次森林资源清查(2014—2018)结果显示,目前全国现有竹林面积约641.16万hm2,约占全国森林总面积的2.94%,其中天然竹林面积约为390.38万hm2,人工经营的竹林面积约为250.78 万hm2 [1],主要生长在热带和亚热带,种类繁多,目前全世界共有88属约1 642种[2],其中我国有39属,500多种。竹子不仅是中华民族的精神象征,而且其用途与人民生活息息相关,涉及衣、食、住、行、用各个方面。目前,国内外学者已在竹类植物种质资源、系统分类及加工利用等方面进行了大量研究[3-5],但在花发育方面,由于竹类植物开花周期较长,因此竹类植物花芽分化以及胚胎学的研究工作相对较少。近十年来,对竹类植物花芽分化和花发育的系统研究也仅限十余个竹种[6-24]。这些工作将竹类植物花芽的外部形态与内部发育相联系,可为竹子成花机理以及花的发育提供重要参考。总的来说,竹类植物生殖生物学以及育种研究还非常匮乏。
黄条金刚竹(‘Aureostriatus’)原是大明竹属金刚竹的一个变种,是一种观叶竹种[25],由田中辛南于1972 年在名古屋市的守山镇发现,1984年8月由周芳纯教授从日本富士竹类植物园引种至南京林业大学竹种园,并扩大了国内的引种种植范围,引种至北京、安徽、浙江等地[18]。2015年以来,国内黄条金刚竹均有大面积开花的现象,繁殖器官形态特征是植物分类鉴定的一个重要依据,2017年作者根据黄条金刚竹开花特性和花器官形态将黄条金刚竹从大明竹属()修正为东芭竹属()[18]。同时,黄条金刚竹的开花,也为其胚胎学方面的研究提供了机会。因此,本研究以开花的黄条金刚竹为研究材料,利用植物解剖学方法对黄条金刚竹的花芽分化,大小孢子的发生过程以及雌、雄配子体发育等问题进行了系统研究,以期明确黄条金刚竹雌雄蕊发育的关键过程,为后续研究竹类植物花发育的分子机理奠定基础。
1 材料与方法
1.1 材料
本试验材料为开花的黄条金刚竹,分布于南京林业大学校园内,在开花期间,不定期采集黄条金刚竹不同发育时期的小穗及小花。
1.2 方法
花芽采集时间为2016年2月中旬至3月中旬,每隔3 d采1次,采集部位位于植株顶部花芽;小穗或小花采集时间为2016年3月初至4月底,每天上午9:00—10:00取样。样品采后均立即放入70% FAA(体积分数比为:70%酒精:冰醋酸:福尔马林= 90:5:5)中固定保存24 h 以上。石蜡切片制片前,在体视镜下剥离各样品外稃和内稃,根据样品的发育程度按雄蕊长度对样品发育先后顺序进行整理,各发育阶段收集样品5个,每阶段重复3次。材料采用常规石蜡法制片[26],切片机为Leica RM 2255型号,切片厚度8 μm,采用番红固绿染色,在Leica DM 2500显微镜下拍照。部分花芽材料在Leica S6D体剖镜下观察拍照。
2 结果与分析
2.1 花芽分化以及花序建成研究
黄条金刚竹花序发育类型为混合花序,每个花序包含交互排列的4~7个小穗,花序顶生为主,稀侧生,花序最上部小穗小花数最多(图1-1)。每个小穗由7~9朵小花与基部两片苞片组成,这些小花交错排列在小穗轴上。每朵小花从外到内包含外稃和内稃各1枚,浆片3枚,雄蕊6枚(稀3枚)以及雌蕊1枚。
黄条金刚竹2月中旬花芽长度约1~2 mm时,花芽顶端呈半球形,随后伸长增大分化产生1个突起,即为顶部小穗原基(图1-2)。顶部小穗原基分化的同时,侧生小穗原基也陆续分化。因此在黄条金刚竹的一个花序中,各小穗是由花序顶部向基部发育的,即花序最上部的小穗最先发育(图1-3),然后其余侧生小穗陆续发育。在各小穗发育的同时,组成小穗的小花也开始分化,小穗基部的小花先发育(图1-4),然后向上依次分化出其他小花。在一朵小花中,从外到内逐步分化出外稃、內稃、浆片原基和雄蕊原基,雌蕊原基在最内部(图1-5和1-6)。
2.2 小孢子的发生及雄配子体发育
黄条金刚竹每朵小花有6枚雄蕊,花丝顶端与纵裂的花药基部相连。花药中逐步发育为花粉囊(图2-1)。当花粉囊形成时,表皮下的4个角落出现孢原细胞(图2-2),其细胞核大、细胞质浓厚。花药1~2 mm时孢原细胞发育成小孢子母细胞(图2-3)。花药4 mm左右,小孢子母细胞各自分离,进入减数分裂期(图2-4)。花药5 mm左右,进入第一次减数分裂前期,之后进入中期(图2-5)、后期(图2-6)和末期,减数分裂第一次分裂后产生 2个子细胞即二分体(图2-7),随后进入第二次减数分裂(图2-8),形成左右对称型四分体(图2-9)。花药6~7 mm时,小孢子体积不断增大,液泡体积增大将细胞核推向细胞壁的一侧,为单核靠边期小孢子(图2-10)。花药7 mm左右,单核靠边期花粉粒的核进行一次有丝分裂后,形成两个子核,形成营养细胞和生殖细胞,构成了二细胞型花粉粒(图2-11)。少数生殖细胞再进行一次有丝分裂,形成 2 个精细胞,成为3核花粉粒(2-12)。

1. 黄条金刚竹花序;2和3. 花序中各小穗分化;4. 小穗中小花发育由基部到顶部;5. 小花原基;6.小花(示雄蕊和雌蕊)。Tf. 顶部小穗各小花;fp. 小花原基;S. 雄蕊;P. 雌蕊。
Figure 1 The flower bud differentiation and inflorescence morphology of‘Aureostriatus’
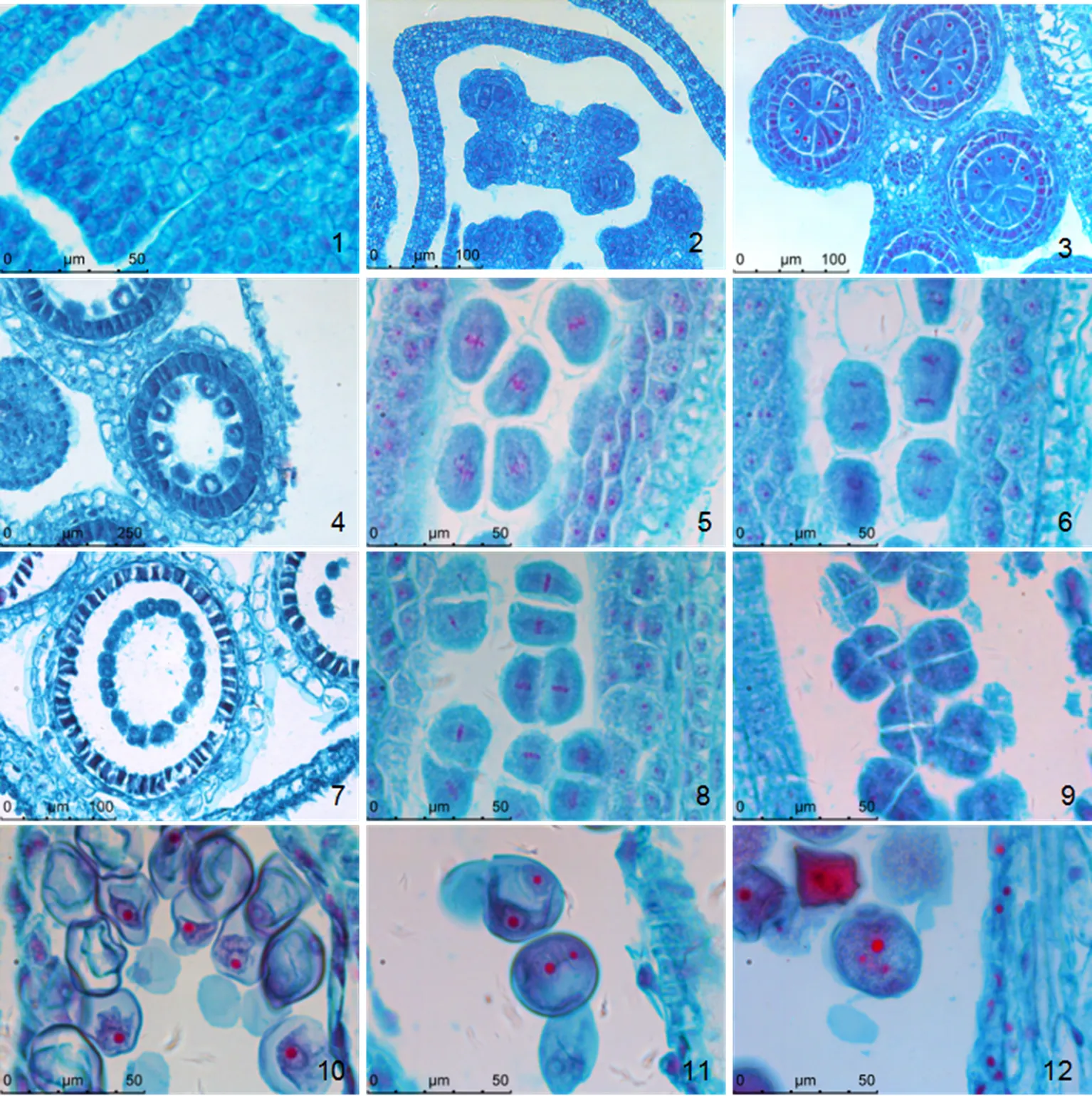
1. 未分化的花药;2.造孢细胞;3和4. 小孢子母细胞;5. 减Ⅰ中期;6. 减Ⅰ后期;7. 二分体;8. 减Ⅱ中期;9. 四分体;10. 靠边期小孢子;11. 二核花粉粒;12. 成熟花粉粒。
Figure 2 The microsporogenesis and development of male gametophyte of‘Aureostriatus’
2.3 花药壁的发育
黄条金刚竹雄蕊发育早期,表皮内孢原细胞进行平周分裂,形成初生壁细胞和初生造孢细胞(图3-1)。花药初生壁细胞分裂形成药室内壁细胞和内层次生壁细胞:内层次生壁细胞分化成2 层细胞(图3-2),花药1~2 mm即小孢子母细胞时期花药壁完全分化,形成4层药壁即表皮、药室内壁、中层和绒毡层细胞(图3-3);中层的细胞被周围细胞挤压,细胞扁平,呈狭长形。花药5 mm左右即小孢子母细胞减数分裂期,表皮细胞在横切面上可以看出呈波浪形(图3-4),中层这个时期消失。花药7 mm左右,绒毡层细胞因为小孢子发育提供营养物质其内容物不断的减少,由于绒毡层始终维持在原来的位置上,壁宿存,通过细胞内切向面释放物质,认定为腺质绒毡层细胞(图3-5)。花粉成熟时,绒毡层细胞物质完全解体,表皮细胞在横切面呈念珠状相连(图3-6)。
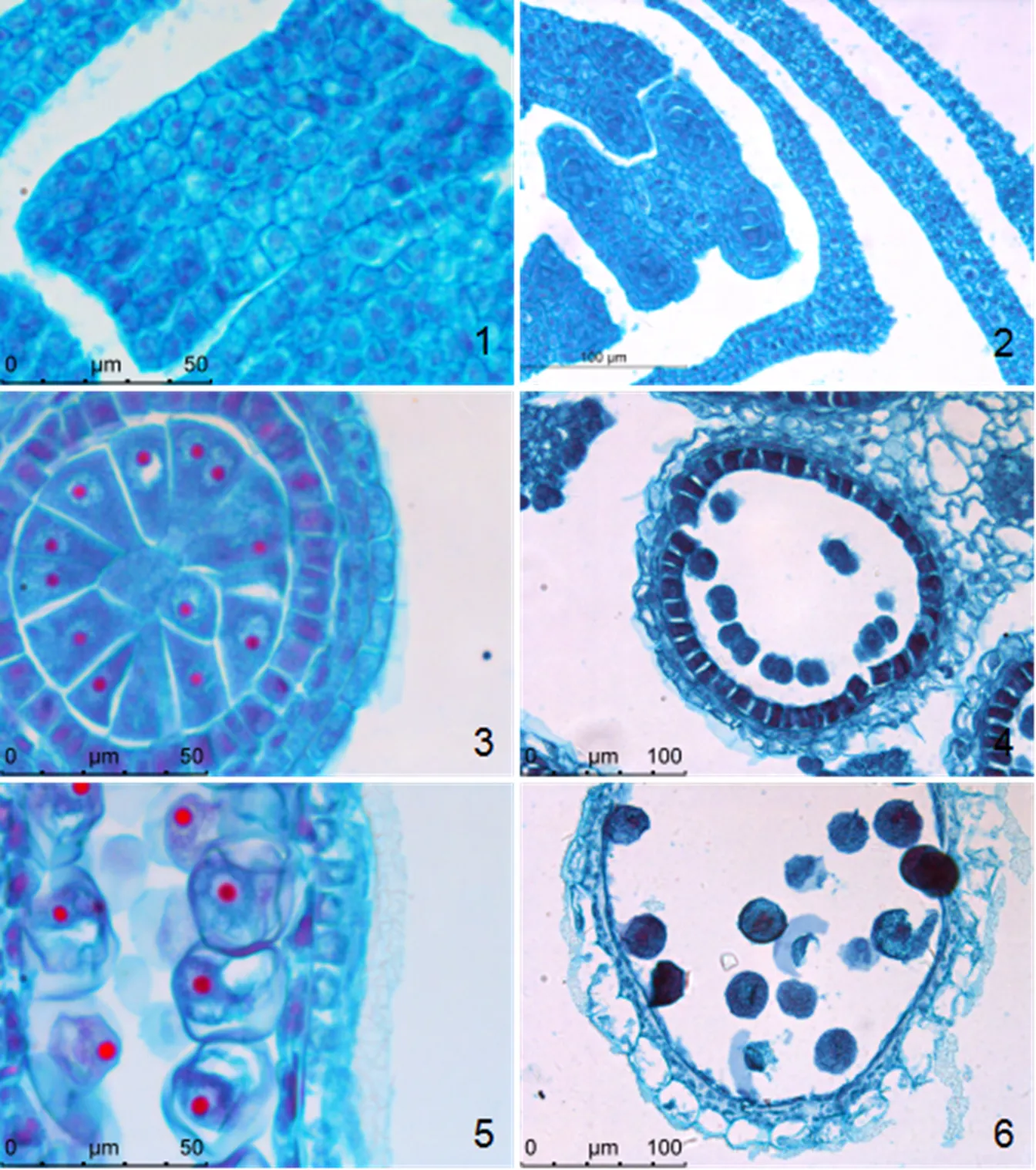
1. 花药未分化时期花药壁;2. 造孢细胞时期的花药壁;3. 小孢子细胞时期,形成4层药壁;4. 二分体时期,中层解体;5. 单核小孢子靠边期,绒毡层少量解体;6. 花粉成熟时,绒毡层消失。
Figure 3 The development of anther wall of‘Aureostriatus’
2.4 大孢子发生及雌配子体发育
当花药长为0.9~1.2 mm时,孢原细胞开始分化。孢原细胞位于珠孔端珠心表皮下方细胞,细胞体积大,细胞质浓厚,具有明显的细胞核。花药2~3 mm孢原细胞的细胞核变大,直接发育为大孢子母细胞(图4-1);花药3~4 mm时,大孢子母细胞进行减数分裂,一字排列为二分体、四分体(图4-2、4-3);功能大孢子由四分体中靠近合点端的一个大孢子发育形成,其余3个退化。功能大孢子成熟后,雌配子体的发育开始,花药7 mm左右,功能大孢子成熟后进行第一次分裂,形成两个细胞,一个位于珠孔端,一个位于合点端,为二核胚囊(图4-4);随后进行第二次分裂,形成四核胚囊(图4-5);最后第3次分裂形成成熟胚囊(图4-9)。胚囊的合点端有3个反足细胞(图4-6),其反复分裂后形成反足细胞群(图4-7);胚囊的珠孔端具有3个细胞组成的卵器,其中1个卵细胞和2个助细胞(图4-8);位于合点端与珠孔端中间,有两个并排的极核组成的中央细胞(图4-8),其细胞体积较其他细胞大。
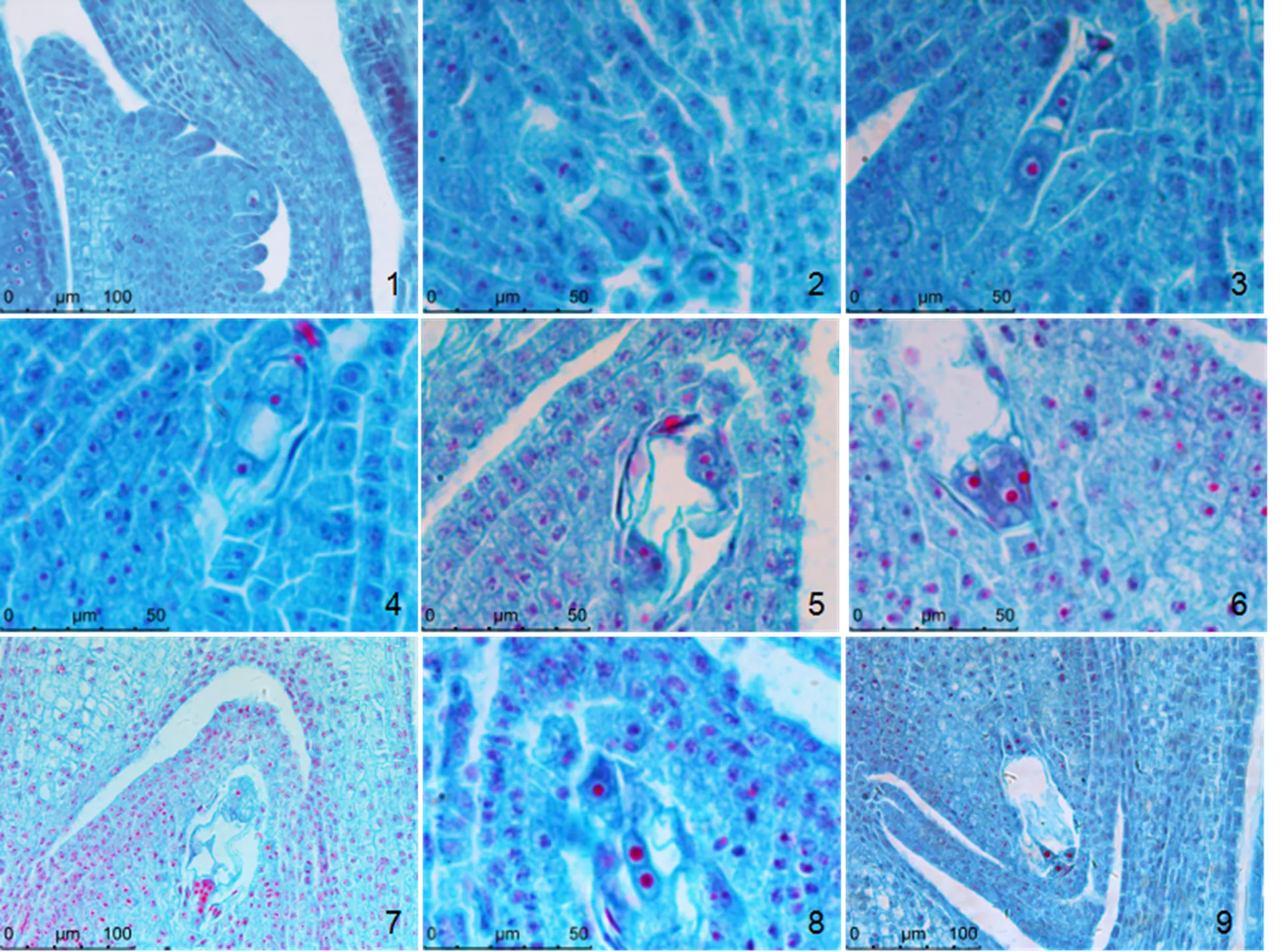
1. 大孢子母细胞;2. 大孢子二分体;3. 大孢子四分体;4. 二核胚囊;5. 四核胚囊;6. 三反足细胞;7. 反足细胞群;8. 两个极核及卵细胞;9. 八核胚囊(只切到六核)。
Figure 4 The megasporagenesis and development of the female gynoecium of‘Aureostriatus’
3 讨论与结论
黄条金刚竹花芽分化初期的茎尖顶端分生组织为半圆球状体,即顶端生长锥[27]在此过程中一直保持半球形的形态。顶端生长锥先分化出小穗原基,后逐渐分化出小花原基,然后由小花原基慢慢分化出外稃、内稃和浆片原基,之后出现雄蕊和雌蕊原基。与其他竹类植物相同[8, 20],黄条金刚竹花序上小穗的生长是向基性,即从上往下陆续发育。一个小穗上有7~9朵花,小花分化顺序是向顶的。在巨龙竹[28]中小穗上顶端的小花先发育,基部的小花后发育。
黄条金刚竹每朵小花有6个花药,小孢子母细胞减数分裂的过程中,它的胞质分裂类型为连续型,产生左右对称型小孢子。成熟花粉粒大多为二细胞型花粉粒,少为三细胞型。这些特征与异叶苦竹[13]、鹅毛竹[11]、孝顺竹[14]得出的结论基本一致。但四分体类型与巨龙竹[28]和爬竹[29]为四面体型不同。
许多竹类植物小孢子发生和雄配子体形成的研究报道中发现,花药壁的结构观察描述与小孢子发生和雄配子体形成有着密切的关系。根据Davis对被子植物花药壁发育类型的划分[30],黄条金刚竹花药壁的发育类型为单子叶型,绒毡层为腺质型;与孝顺竹、月月竹等相似。与黄坚钦等[31]对雷竹花药壁描述不同的是,雷竹的花药壁形成也是4层,但不形成药室内壁,表皮充当药室内壁角色,无径向生长。第一次平周分裂直接形成内外两层细胞,内层直接发育为绒毡层,外层再分裂形成两个中层。根据竹子种类的不同,发育需求的不同,花药壁发育也会有所变化。黄条金刚竹花药壁发育过程中无异常情况出现,其中绒毡层主要起提供小孢子发育营养物质的作用。
在本试验研究中发现,黄条金刚竹同一朵小花的不同花药间的同步性相对较好;而且同一个花药中不同药室内的小孢子发育基本同步,但进入减数分裂后同步性下降,一般相差 1 个分裂期。这与雷竹、孝顺竹小孢子发育同步性基本一致,与月月竹、巨龙竹有些微区别,巨龙竹的小孢子发育中,同一花药中不同药室内小孢子发育不同步,相同药室内也不同步[28],而月月竹则表现为同一花药中不同药室之间小孢子母细胞减数分裂可相差1~2个时期[8]。
黄条金刚竹的子房一室,倒生胚珠,双珠被。孢原细胞发育成大孢子母细胞,大孢子四分体呈线性排列,合点端的反足细胞形成后不断分裂形成反足细胞群。这些发育特点与前人对竹类植物子房发育的研究结果一致[13-14, 19, 22],且具有与禾本科植物子房特点相一致的共性[32]。黄条金刚竹的功能大孢子由合点端的大孢子发育而成,如异叶苦竹[13]、雷竹[22]等竹类植物亦是。庞延军等[29]观察到爬竹合点端的第二个大孢子为功能大孢子,但也有部分竹种的功能大孢子由珠孔端的大孢子发育而来[11, 14]。
在成熟胚囊中,我们观察到一对助细胞位于珠孔端,然而在石蜡切片中并没有观察到明显的助细胞壁在珠孔端增厚形成丝状器。在黄条金刚竹成熟胚囊中,由两个极核组成的中央细胞拥有极其丰富的丝状器。因此胚囊的超微结构还有待进一步研究。
[1] 李玉敏, 冯鹏飞. 基于第九次全国森林资源清查的中国竹资源分析[J]. 世界竹藤通讯, 2019, 17(6): 45-48.
[2] VORONTSOVA M S, CLARK L G, DRANSFIELD J, et al. World checklist of bamboos and rattans[M]. Beijing: Science Press, 2016.
[3] 辉朝茂, 杨宇明. 关于云南竹类植物多样性及其保护研究[J]. 林业科学, 2003, 39(1): 145-152.
[4] 朱振贤, 张芬耀, 宋盛, 等. 竹亚科植物分类研究进展[J].世界林业研究, 2017, 30(3): 35-40.
[5] 王戈, 陈复明, 费本华, 等. 竹缠绕复合管创新技术在“一带一路”沿线推广与应用的可行性分析[J].世界林业研究, 2020, 33(1):105-109.
[6] 初彩华, 黄玲, 王曙光. 新小竹花形态结构及雌、雄配子体的发育研究[J]. 西北植物学报, 2019, 39(5): 763-769.
[7] 郭起荣, 周建梅, 孙立方, 等. 毛竹大孢子发生与雌配子体发育研究[J]. 江西农业大学学报, 2014, 36(5): 925-928.
[8] 林树燕, 郝娟娟, 辛华, 等. 月月竹大、小孢子发生和雌、雄配子体发育研究[J]. 南京林业大学学报(自然科学版), 2009, 33(3): 9-12.
[9] 林树燕, 寿玉婷, 丁雨龙. 四种竹子的花器官形态描述[J]. 热带亚热带植物学报, 2010, 18(3): 251-256.
[10] 林树燕, 刘国华, 丁雨龙. 异叶苦竹胚和胚乳的发育及淀粉粒动态[J]. 林业科学, 2011, 47(9): 33-35, 191-193.
[11] 林树燕, 丁雨龙. 鹅毛竹大小孢子及雌雄配子体发育[J]. 西北植物学报, 2012, 32(5): 907-914.
[12] 林树燕, 丁雨龙. 鹅毛竹与异叶苦竹的繁育系统研究[J]. 南京林业大学学报(自然科学版), 2013, 37(3): 1-5.
[13] 林树燕, 丁雨龙. 异叶苦竹大小孢子及雌雄配子体的发育[J]. 林业科学, 2013, 49(8): 168-175.
[14] 林树燕, 李洁, 赵荣, 等. 孝顺竹花芽分化及小孢子发生与雄配子体发育[J]. 南京林业大学学报(自然科学版), 2015, 39(4): 51-56.
[15] 林树燕, 李洁, 赵荣, 等. 南京地区孝顺竹的开花生物学特性研究[J]. 南京林业大学学报(自然科学版), 2015, 39(2): 52-56.
[16] 林树燕, 赵荣, 徐强, 等. 异叶苦竹花粉管生长及双受精过程[J]. 西北植物学报, 2015, 35(11): 2197-2203.
[17] 林树燕, 郑笑, 张莉, 等. 鹅毛竹花药发育的超微结构观察[J]. 南京林业大学学报(自然科学版), 2016, 40(2): 65-70.
[18] 林树燕, 范婷婷, 姜明云, 等. 3种(品种)地被竹花器官形态特征及学名订正[J]. 南京林业大学学报(自然科学版), 2017, 41(1):189-193.
[19] 林树燕, 邵丽娟, 李洁, 等. 孝顺竹()大孢子发生与雌配子体发育研究[J]. 热带亚热带植物学报, 2018, 26(3): 278-284.
[20] 林树燕, 万雅雯, 傅华君, 等. 竹类植物花序建成及花序类型修正[J]. 南京林业大学学报(自然科学版), 2018, 42(6): 1-6.
[21] 林树燕, 傅华君, 万雅雯, 等.‘霞早’绿竹花形态特征及花药发育的组织学观察[J]. 南京林业大学学报(自然科学版), 2019, 43(2): 7-13.
[22] 林新春, 袁晓亮, 林绕, 等. 雷竹大孢子发生与雌配子体发育[J]. 林业科学, 2010, 46(5): 55-57, 187.
[23] 唐国建, 杨金梅, 丁雨龙, 等. 青丝黄竹花形态与结构研究[J]. 南京林业大学学报(自然科学版), 2016, 40(2): 71-75.
[24] 王雨珺, 罗剑, 陈楠楠, 等. 绵竹花形态结构及雌、雄配子体的发育研究[J]. 植物研究, 2017, 37(4): 492-498.
[25] WU Z Y, RAVEN P H, HONG D Y. Poaceae flora of China illustrations[M]. Beijing:Science Press & St. Louis:Missouri Botanical Garden Press, 2007.
[26] 李正理. 植物组织制片学[M]. 北京:北京大学出版社, 1996: 91-92.
[27] 胡适宜, 杨弘远. 被子植物受精生物学[M]. 北京: 科学出版社, 2002: 78-102.
[28] 王曙光, 普晓兰, 丁雨龙. 巨龙竹生殖器官形态结构及雌、雄配子体的发育[J]. 植物研究, 2006, 26(3): 270-274.
[29] 庞延军, 喻富根, 胡成华, 等. 爬竹雄蕊发育异常的初步观察[J]. 竹子研究汇刊, 1994, 13(4): 42-46.
[30] DAVIS G L. Systematic embryology of the Angiosperms[M]. New York: John Wiley&Sons, Inc, 1966.
[31] 黄坚钦, 黄华宏, 何福基, 等. 雷竹的小孢子发生和雄配子体形成[J]. 竹子研究汇刊, 1999, 18(3): 55-58.
[32] 杨弘远. 水稻生殖生物学[M]. 杭州: 浙江大学出版社, 2005: 19-69.
Inflorescence architecture of male and female gametophytes of‘Aureostriatus’
WANG Xing1, 2, 3, JIANG Mingyun1, 2, LIN Shuyan1, 2, YAO Wenjing1, 2, DING Yulong1, 2
(1. Co-Innovation Center for Sustainable Forestry in Southern China, Nanjing Forestry University, Nanjing 210037;2. Bamboo Research Institute, Nanjing Forestry University, Nanjing 210037;3. College of Biology and the Environment, Nanjing Forestry University, Nanjing 210037)
‘Aureostriatus’ is a variation type ofMakino Gen, which has a high ornamental value because of its yellow-stripe leaves. In March 2015,‘Aureostriatus’ blossomed for the first time since its introduction to China in 1984. In order to provide some new information for the study of the development of bamboo floral organs, we observed and described the inflorescence morphology and embryonic development of‘Aureostriatus’ by morphological observation and paraffin section, and the results were as follows. (1) The initial growth point of flower bud differentiation was hemispherical; the primordium of spikelet at the top of inflorescence developed first, while the primordium of lateral spikelet developed later; floret differentiation was from the outside to inside, lemma, palea and lodicule primordium differentiated first, while stamen and pistil primordium differentiated later. (2) The development of anther wall belonged to the monocotyledonous type; the tapetum was of typical glandular type. The cytoplasmic division of microspore mother cells belonged to continuous type, and the mature pollen grains were mostly tricellular type. (3) The ovule of‘Aureostriatus’ was an inverted ovule, with double-layer integument, thin nucellus, linear megaspore tetrad, one megaspore at the chalazal end differentiated into functional megaspore, and the functional megaspore formed an octanuclear embryo sac after three mitosis; the embryo sac was oftype. The results showed that‘Aureostriatus’ is a mixed inflorescence and the development of male and female gametophyte is normal.
‘Aureostriatus’; flower bud differentiation; male gametophytes; female gametophytes
S795
A
1672-352X (2021)01-0009-06
10.13610/j.cnki.1672-352x.20210319.017
2021-3-23 11:17:09
[URL] https://kns.cnki.net/kcms/detail/34.1162.S.20210319.1544.034.html
2020-04-08
国家自然科学基金项目(31870595)和江苏高校优势学科建设工程资助项目(PAPD)共同资助。
王 星,硕士研究生。E-mail:wx1250@foxmail.com
林树燕,博士,教授。E-mail:lrx@njfu.com.cn

