添加乳酸菌剂和糖蜜对不同含水量食叶草青贮发酵品质及体外干物质消失率的影响
周 昕 黄秋连 王 健 张嘉宾 曹 阳
(黑龙江八一农垦大学动物科技学院,粮食副产物加工与利用教育部工程研究中心,黑龙江省寒区饲料资源高效利用与营养调控重点实验室,大庆163319)
食叶草(Rumexhanusby.)是一种多年生宿根草本植物,又因蛋白质含量高被称为蛋白草[1-2],其具有生长速度快、再生能力强、产草量高、草质优良等特点,可有效缓解饲料供应不足等问题。食叶草含有动物所需的维生素E、矿物质和氨基酸等[3],其根、茎、叶中含有的活性物质可以促进新陈代谢,提高免疫力。饲喂食叶草有增加畜禽食欲、增强体质、促进生长、降低养殖成本等优势[4],所以食叶草可作为优质蛋白质饲料新资源。
食叶草含水量较高,碳水化合物含量较低,调制干草比较困难,干燥时间长,很容易腐烂变质。为延长食叶草贮藏时间,减少营养成分损失,调制青贮是比较可行的方法。青贮饲料的发酵品质受青贮原料、水分含量、温度及有益发酵菌等的影响[5]。乳酸菌作为青贮发酵中的有益菌,可降低pH,抑制有害菌繁殖。但是牧草表面的乳酸菌一般较少,因此在制作青贮时常通过添加乳酸菌来增加其表面的乳酸菌数量,促进乳酸发酵,提高青贮饲料的发酵品质[6]。糖蜜富含碳水化合物,青贮过程中添加糖蜜可增加乳酸菌的发酵底物,加速青贮饲料的发酵进程[7]。目前人们对食叶草的整体认识和饲料开发利用研究较少,提供食叶草优质青贮调制技术的报道也有限。因此,本研究以食叶草青贮为研究对象,探究添加乳酸菌和糖蜜对不同含水量食叶草青贮发酵品质及体外干物质消失率(IVDMD)的影响,以期确定青贮时食叶草适宜的含水量,为开发优质牧草资源、合理青贮食叶草提供数据支持和技术参考。
1 材料与方法
1.1 试验材料
青贮原料食叶草由黑龙江某农业科技有限公司提供,其营养成分含量见表1。3种乳酸菌剂由日本国立草地研究所提供,分别为Master-LP[含有植物乳杆菌(Laobacillusplantarum)SBS0001-S菌株和SBS0003菌株]、Master-AC(含有LaobacillusplantarumSBT2300菌株)、Chikuso-1[含有干酪乳杆菌(Lactobacilluscasei)FG1菌株],均由日本某种苗株式会社生产,活菌数为109CFU/g。糖蜜购自成都某商贸有限公司,总糖(蔗糖+还原糖)含量≥40%。

表1 食叶草营养成分含量
1.2 试验设计
试验采用双因素(含水量×添加剂)完全随机试验设计,食叶草原料切碎至2~3 cm,分别给予8、12、16 h的晾晒处理,使其含水量分别为65%、60%和55%,对以上3种含水量的青贮原料分别进行添加乳酸菌剂Master-LP(LP)、乳酸菌剂Chikuso-1(LAB-1)、乳酸菌剂Master-AC(AC)、糖蜜(M)和无添加(C,对照)处理。参照Cao等[8]的试验结果,糖蜜的添加量为4%。乳酸菌剂的添加:将菌粉与无菌水以1∶400的比例混合配制成菌液,并以菌液形式按1∶100的比例添加于青贮原料中,即菌剂最终添加量为0.002 5%。各添加剂的添加量均为鲜重基础。以上各处理分别称重200 g,装入聚乙烯包装袋(160 mm×250 mm)中进行真空密封包装,每个处理设定3个重复,室温[(24±2) ℃]条件下贮藏30 d后取样,测定相关指标。
1.3 指标测定
1.3.1 感官品质评定
参照青贮饲料质量评定标准[9],对开袋后的食叶草青贮样品从颜色、气味、质地及有无霉变等方面进行感官品质评定。
1.3.2 常规营养成分测定
将食叶草和开袋后的食叶草青贮样品置于电热恒温鼓风干燥箱(DGG-9240B型,上海森信实验仪器有限公司)中65 ℃烘至恒重后,采用微型植物破碎机(FZ-102型,临沂正衡华玻仪器有限公司)粉碎至0.5 mm备用。参照AOAC(1990)[10]方法,采用电热恒温鼓风干燥箱测定干物质(DM)含量,采用自动凯氏定氮仪(K1100F,济南海能仪器股份有限公司)测定粗蛋白质(CP)含量,采用马弗炉(SX2-4-10,天津中环实验电炉有限公司)测定有机物(OM)含量,采用索氏提取器测定粗脂肪(EE)含量,采用蒽酮-硫酸比色法[11]测定可溶性碳水化合物(WSC)含量,参照Van Soest等[12]的方法,采用纤维分析仪(ANKOM A200i,北京安科博瑞科技有限公司)测定中性洗涤纤维(NDF)和酸性洗涤纤维(ADF)含量。
1.3.3 微生物数量分析
采用平板计数法对食叶草青贮中乳酸菌、芽孢杆菌、好氧性细菌、酵母菌、大肠杆菌、丁酸梭菌、霉菌进行计数[13]。适当稀释倍数后产生30~300个菌落的情况下,计数菌落,并用每克鲜重中菌落形成单位的对数表示菌落数[lg(CFU/g FM)]。取10 g食叶草青贮置于装有90 mL无菌蒸馏水的样品袋中,利用均质器(BAGMIXER-400W,Interscience,法国)均质90 s,并进行连续梯度稀释。每份浸提液取20 μL,滴加到提前预备的培养基上。乳酸菌和丁酸梭菌分别使用MRS Ager培养基和Differential Reinforced Clostridial Agar培养基(青岛海博生物科技有限公司),置于厌氧培养箱(30 ℃,48 h)培养并计数。酵母菌和霉菌使用Potato Dextrose Ager培养基(通过菌落外观和细胞形态将酵母菌与霉菌或细菌区分开来)、大肠杆菌使用Blue Light Broth Agar培养基(Nissui Ltd.,日本)、芽孢杆菌和好氧性细菌使用Standard Method Ager培养基(Nissui Ltd.,日本),置于恒温培养箱(30 ℃,48 h)培养并计数。培养芽孢杆菌和丁酸梭菌前,需将浸提液75 ℃水浴15 min。
1.3.4 发酵品质测定
取20 g食叶草青贮样品置于聚乙烯袋中,加入180 mL灭菌蒸馏水,用均质器拍打90 s直至充分混匀[14]。用便携式pH计(FG2-FK型,上海巴玖实业有限公司)测定浸提液的pH。取部分浸提液进行过滤,滤液经高速冷冻离心机(6 500×g,4 ℃)离心5 min,再经0.22 μm滤膜过滤。参照Cao等[15]的方法,采用LC-100高效液相色谱仪测定乳酸(LA)、乙酸(AA)、丙酸(PA)及丁酸(BA)含量。
1.4 体外培养
1.4.1 试验动物饲养管理
选择2头体况良好、体重(30.0±1.3) kg、安装永久性瘤胃瘘管的绵羊作为体外瘤胃液供体动物,其所饲喂的饲粮组成(风干基础)为:羊草70.00%,豆粕9.02%,玉米8.21%,玉米蛋白粉7.43%,麦麸3.00%,磷酸氢钙0.94%,食盐0.40%,预混料1.00%(每千克预混料含有FeSO416 000 mg、CuSO45 200 mg、ZnSO412 000 mg、MnSO4·5H2O 10 000 mg、沸石粉256 g、CoCl2120 mg、维生素A 200 mg、维生素D3100 mg、维生素E 600 mg、KI 6 g、MgO 74 g、CaHPO4300 g)。每天06:00和18:00各饲喂1次,自由采食和饮水。
1.4.2 培养液的配制
晨饲后2 h,分别从2头供体羊瘤胃内采集200 mL瘤胃液,经4层纱布过滤后混合,并通入CO2保证厌氧条件。参照McDougll’s buffer方法[16]配制缓冲液与培养液,并添加还原剂L-半胱氨酸盐酸盐和指示剂刃天青钠盐。缓冲液配制方法:将0.57 g KCl、9.80 g NaHCO3、9.30 g Na2HPO4·12H2O、0.47 g NaCl、0.04 g CaCl2、0.06 g MgCl2、0.25 gL-半胱氨酸盐酸盐(还原剂)、0.01 g刃天青钠盐(指示剂)溶于少量蒸馏水,再定容至1 000 mL。培养液配制:按照1∶4的比例将瘤胃液与缓冲液混合,并通入CO2保证厌氧条件,置于39 ℃水浴锅中备用。
1.4.3 体外发酵参数测定
称取0.5 g食叶草青贮样品置于容量125 mL的血清瓶中(每个处理做2个平行,并预留3个血清瓶不加入青贮样品作为空白,其他操作如常),注入上述培养液50 mL,通入CO2排出空气后密封,在恒温培养振荡摇床(39 ℃,100 r/min)中发酵48 h,将发酵瓶放置在碎冰中终止发酵,对产气量(GP)、pH、IVDMD和挥发性脂肪酸(VFA)含量进行测定。
参照汤少勋等[17]的方法测定GP;采用便携式pH计测定pH;通过已恒重的快速定性滤纸过滤培养物,并将之移至铝盒于电热恒温鼓风干燥箱内105 ℃下烘至恒重,通过培养前后样品失重计算IVDMD ;参照贾鹏禹等[18]的方法对瘤胃液进行处理并通过高效液相色谱仪测定VFA含量。
1.5 统计分析
数据经Excel 2010进行汇总和整理后,根据双因素完全随机设计模型,使用SAS 9.0统计软件中的一般线性模型(GLM)程序进行方差分析,建立模型:
Yijl=μ+αi+βj+(α×β)ij+eijl。
式中:Yijl为食叶草青贮发酵品质指标或IVDMD;μ为总体平均值;αi为含水量i(i=1,2,3)的效应;βj为添加剂j(j=1,2,3,4,5)的效应;(α×β)ij为含水量与添加剂的互作效应;eijl为试验误差。
采用Tukey法比较均值的差异显著性,以P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析
2.1 不同含水量食叶草青贮前营养成分含量
不同含水量食叶草青贮前营养成分含量见表2。
2.2 发酵30 d后食叶草青贮的感官品质
由表3可知,不同含水量的食叶草青贮颜色均呈黄绿色,其中55%组颜色偏黄。5个添加剂组间感官品质基本相似,所有样品均质地柔软,不粘手,无霉变。

表2 不同含水量食叶草青贮前营养成分含量

表3 含水量与添加剂对食叶草青贮感官品质的影响
2.3 发酵30 d后食叶草青贮的微生物数量
由表4可知,在含水量方面,60%组和65%组乳酸菌和酵母菌数量分别显著高于和低于55%组(P<0.05)。在添加剂方面,乳酸菌数量由高到低的顺序为LP组>LAB-1组>AC组>M组>C组,各组间差异显著(P<0.05);LP组酵母菌数量和LAB-1组好氧性细菌数量在所有添加剂组中最低,显著低于其他添加剂组(P<0.05)。所有样品均未检出大肠杆菌、霉菌和丁酸梭菌。添加剂与含水量在乳酸菌、酵母菌、好氧性细菌数量方面表现出极显著的交互作用(P<0.01)。
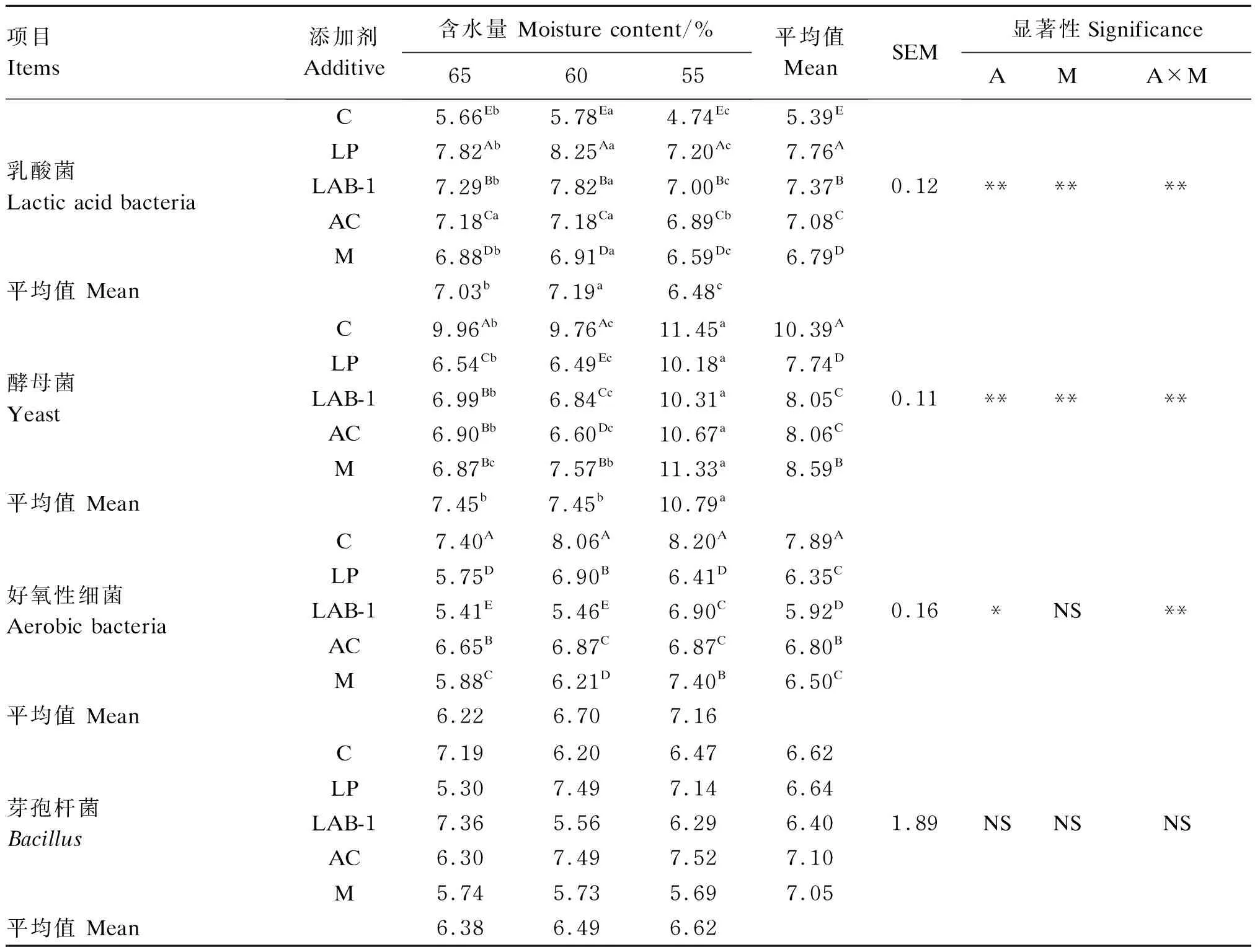
表4 含水量与添加剂对食叶草青贮微生物数量的影响
2.4 发酵30 d后食叶草青贮的营养成分含量
由表5可知,在含水量方面,60%组CP、EE含量显著高于65%组和55%组(P<0.05),而其NDF含量显著低于65%组和55%组(P<0.05);55%组DM含量在3个含水量组中最高,与其他组差异显著(P<0.05)。在添加剂方面,CP含量由高到低的顺序为LP组>LAB-1组>AC组>M组>C组,各组间差异显著(P<0.05);EE含量由高到低的顺序为LP组>LAB-1组>M组>AC组>C组,各组间差异显著(P<0.05);M组WSC含量和LP组NDF含量在所有添加剂组中分别最高和最低,与其他添加剂组(AC组NDF含量除外)差异显著(P<0.05)。添加剂与含水量在CP、EE和NDF含量方面存在极显著的交互作用(P<0.01)。
2.5 发酵30 d后食叶草青贮的发酵品质
由表5可知,在含水量方面,60%组pH和LA含量分别显著低于和高于65%组和55%组(P<0.05)。在添加剂方面,LA含量由高到低的顺序为LP组>LAB-1组>AC组>M组>C组,各组间差异显著(P<0.05);与C组相比,LP组、LAB-1组、AC组、M组AA和PA含量略有下降(P>0.05)。所有样品均未检测出BA。添加剂与含水量在pH和LA含量方面存在极显著的交互作用(P<0.01)。

表6 含水量与添加剂对食叶草青贮发酵品质的影响
2.6 发酵30 d后食叶草青贮的体外发酵参数
由表6可知,在含水量方面,60%组的GP和IVDMD显著高于65%和55%组(P<0.05)。在添加剂方面,GP由高到低的顺序为LAB-1组>LP组>AC组>M组>C组,C组显著低于其他各组(P<0.05);IVDMD由高到低的顺序为LP组>LAB-1组>AC组>M组>C组,各组间差异显著(P<0.05)。添加剂与含水量在GP和IVDMD方面表现出极显著的交互作用(P<0.01)。
3 讨 论
3.1 添加乳酸菌和糖蜜对不同含水量食叶草青贮发酵品质的影响
根据青贮饲料感官鉴定标准,优质青贮饲料呈绿色或黄绿色,酸香且茎叶柔软,无霉变[19-20]。本试验中添加乳酸菌和糖蜜的食叶草青贮均为优质青贮饲料。含水量是影响苜蓿青贮效果的关键因素之一,研究者普遍认可,适宜青贮的含水量应为60%~70%,且优质青贮饲料pH达到4.2以下[21-22]。本研究中,以含水量为60%的食叶草为青贮原料,LP组和LAB-1组食叶草青贮的pH均达到4.2以下,分别为3.97和4.19,这与Liu等[23]的研究结果一致。青贮原料含水量低时,在青贮过程中乳酸菌繁殖受到抑制,使得LA含量降低,pH下降速度变慢[24]。本研究中,食叶草青贮时添加乳酸菌显著增加了乳酸菌数量,抑制了丁酸梭菌、霉菌等有害菌的繁殖,这与Cao等[25]的研究结果一致。王亚芳等[26]在全株玉米青贮时添加不同青贮添加剂,其中乳酸菌提升LA的能力明显高于其他青贮添加剂。李苗苗等[27]在油莎草青贮时添加乳酸菌,显著提高了乳酸菌数量,降低了酵母菌和好氧性细菌数量。Sheperd等[28]在苜蓿青贮时接种乳酸菌,发酵品质得以改善。高水分青贮原料含水量较高时,发酵底物被过分稀释,不利于乳酸菌利用,但利于丁酸梭菌进行BA发酵,使青贮饲料变臭、品质变差[24]。本研究中,食叶草青贮时添加糖蜜可增加发酵底物,促进LA发酵,这与魏化敬[29]的研究结果一致。刘婷婷等[30]在“张杂谷”全株青贮时添加不同水平糖蜜和青贮添加剂,发现4%糖蜜+1.5%青贮添加剂效果最好。一般认为优质青贮饲料的BA含量应低于1%[31],本试验中含水量为65%、60%、55%的食叶草进行青贮后,所有样品中均无BA,这与蔡义民等[32]的研究结果一致。本研究结果显示,从发酵品质看,在食叶草青贮时添加乳酸菌剂比添加糖蜜效果好。生产实践中,添加糖蜜会增加成本,所以食叶草在青贮时可使用乳酸菌剂Chikuso-1或乳酸菌剂Master-LP,以增加乳酸菌数量,改善食叶草青贮的发酵品质。

表7 含水量与添加剂对食叶草青贮体外发酵参数的影响

续表7项目Items添加剂Additive含水量 Moisture content/%656055平均值MeanSEM显著性 SignificanceAMA×M丙酸PA/%FMC9.789.239.099.37LP10.9310.6010.2610.60LAB-110.169.869.869.96AC10.099.799.769.88M9.879.579.379.600.31NSNSNS平均值 Mean10.179.809.67丁酸BA/%FMC5.915.675.345.64LP5.965.745.745.81LAB-15.915.815.345.69AC5.985.954.955.63M5.965.914.995.620.32NSNSNS平均值 Mean5.945.825.27
3.2 添加乳酸菌和糖蜜对不同含水量食叶草青贮营养成分含量的影响
适当地降低青贮原料的含水量可以提高青贮饲料的青贮品质[33]。本研究中,60%组食叶草青贮的CP、EE含量在3个含水量组中最高,这与郭玉琴等[34]的研究结果一致。这可能是因为适当降低含水量,青贮饲料中的DM和WSC含量增加,从而促进乳酸菌的繁殖,进而改善青贮品质。以含水量为60%的食叶草作为青贮原料时,添加乳酸菌剂和糖蜜后青贮饲料中CP含量显著升高,其中以LAB-1组的CP含量最高。陶莲等[35]和Silva等[36]研究表明,添加乳酸菌可增加青贮饲料的CP含量。而添加糖蜜可增加青贮饲料表面可溶性糖,加速乳酸菌繁殖,这与靳思玉等[37]研究结果一致。添加糖蜜可在青贮早期增加发酵底物,使乳酸菌迅速生长,产生更多乳酸,使pH下降,蛋白酶活性得到抑制,减少蛋白质降解,从而达到改善营养价值的效果。
3.3 添加乳酸菌和糖蜜对不同含水量食叶草青贮体外发酵参数的影响
GP可反映瘤胃微生物发酵饲料的效果,是评价饲料品质的重要指标[38]。本试验中,60%组食叶草青贮的GP显著高于65%组和55%组,说明含水量为60%的食叶草制成的青贮饲料在瘤胃内更容易被微生物发酵,消化率更高。刘凯丽[39]在不同含水量的杂交构树青贮时使用添加剂,发现60%含水量的杂交构树使用添加剂的效果最好,这与本试验研究结果一致。有研究指出,GP与瘤胃微生物对蛋白质分解能力呈正相关[40],即GP越大,蛋白质被分解的越多。本试验中,与无添加和添加糖蜜相比,在含水量为60%的食叶草青贮时添加乳酸菌剂使得GP显著增加,饲料利用率更高。
3.4 含水量和添加剂对食叶草青贮品质及饲料特性的交互作用
本试验中含水量和添加剂对pH和LA含量表现出极显著的交互作用,可能由于高水分青贮不利于乳酸菌发酵,LA产生速率较低;低水分青贮不利于压实,不易形成厌氧环境,抑制乳酸菌繁殖,LA产生速率下降。添加乳酸菌剂可增加青贮发酵初期乳酸菌数量,产生大量LA,迅速降低pH。
水分和添加处理对CP、EE和NDF含量表现出交互作用,可能由于高水分青贮时,压实过程会造成汁液渗出,其营养价值大量损失;低水分青贮虽然降低了原料水分,同时也减少了WSC含量,使乳酸菌可利用的WSC减少,LA含量降低,pH下降速率减慢,不能很好地保持其营养成分。青贮时添加乳酸菌剂可降低食叶草在青贮过程中蛋白质的降解,同时产生的大量LA会酸解细胞壁,导致NDF含量降低。
含水量和添加剂对GP和IVDMD表现出极显著的交互作用,可能是由于半干青贮和乳酸菌添加降低了青贮饲料中DM的损失,更好地保存了青贮饲料中CP和剩余的WSC,从而使其在瘤胃内得到发酵并表现出较高的GP和IVDMD。
4 结 论
本试验条件下,不同含水量的食叶草青贮时添加乳酸菌和糖蜜均可以起到改善青贮品质,提高营养价值及IVDMD等的效果。综合本试验结果,在含水量为60%的食叶草青贮时添加乳酸菌剂Chikuso-1或乳酸菌剂Master-LP可使青贮品质更优。

