神经内科危重症病人肠内营养喂养不耐受现状及其影响因素
陈 琳,谌艳芳,余爱华,尹 峰
桂林医学院附属医院,广西541001
喂养不耐受(feeding intolerance,FI)是指肠道喂养过程中,因胃肠功能紊乱所致喂养障碍的一组临床症候群,包括但不限于呕吐、腹泻、胃潴留、误吸,是肠内营养(enteral nutrition,EN)过程中最常见的问题之一[1]。神经科危重症病人因伴有自主神经功能障碍,或受并发症、治疗药物副作用等的影响,常出现胃肠功能紊乱,在肠内营养过程中极易发生喂养不耐受[2]。据报道,我国神经内科危重症病人肠内营养期间喂养不耐受的发生率达25.7%[3]。喂养不耐受的发生往往与病人机体负氮平衡、肺部感染、病死等不良预后相关,亦会造成护理满意度下降、护患矛盾加深[4-5]。充分认识、尽早发现、及时干预,同时规范肠内营养操作,是确保神经内科危重症病人肠内营养安全有效进行、减少喂养不耐受的关键。目前,国内的研究大多聚焦在神经危重症病人喂养不耐受发生后的管理,对引起肠内营养喂养不耐受的各种影响因素关注度不够,也缺乏对其发生率和高发时间点的了解。为改善神经内科危重症病人的营养状况、优化临床护理质量,本研究对神经内科危重症病人进行前瞻性调查,探讨神经内科危重症病人肠内营养过程中喂养不耐受的发生率及相关影响因素。现报道如下。
1 对象与方法
1.1 对象 采用便利抽样法,选取2019 年3 月—2020年4 月桂林市某三级甲等医院神经内科收治的危重症病 人143 例,其 中 男87 例,女56 例;年 龄(67.79±19.82)岁。入院诊断:脑梗死72 例,脑出血53 例,颅内肿瘤6 例,颅内感染4 例,脑积水3 例,吉兰巴雷综合征等其他疾病5 例。纳入标准:确诊为神经系统疾病;年龄≥18 岁;无法自主进食,入院24~48 h 经鼻胃管行肠内营养喂养;预计肠内营养实施时间≥7 d(包括7 d 内由于发生喂养不耐受而导致肠内营养终止或暂停者);病人家属签署知情同意书并自愿加入研究。排除标准:入院前已接受肠内营养;既往合并胃肠道疾病或有手术史者;7 d 内即死亡或转出且尚未出现喂养不耐受的病人;7 d 内由于喂养不耐受以外的特殊原因终止或暂停肠内营养者。本研究符合赫尔辛基宣言。
1.2 干预方法
1.2.1 肠内营养方法 采用整蛋白肠内营养制剂瑞素通过营养泵泵入,初始泵入速度为20~30 mL/h,逐渐增至100~125 mL/h。病人每日摄入量标准参照2011 版《神经系统疾病肠内营养支持操作规范共识》[6]推荐25~30 kcal/(kg·d)(1 kcal=4.18 kJ)。一旦发生喂养不耐受症状(胃潴留、呕吐、腹泻、误吸等)则暂停泵入,6 h 后再次评估病人的喂养耐受性,根据病人耐受情况决定泵注的总量与速度。肠内营养期间用恒温器将肠内营养液温度控制在37 ℃,并保持病人半卧位。
1.2.2 喂养耐受性评定标准 因目前国内外关于喂养不耐受的定义尚无统一界定,本研究参照2016 年美国肠外与肠内营养协会(ASPEN)重症病人营养支持指南[1]关于重症病人喂养不耐受的定义,并借鉴葛世伟等[7]研究结果,确定本研究营养耐受性的评价指标,包括呕吐、腹泻、胃潴留、误吸4 项,具体评定标准见表1。根据肠内营养期间病人的情况将喂养耐受性分为3 个等级:①耐受性良好,没有出现任何1 项喂养不耐受的症状;②耐受性差,出现1 项及以上喂养不耐受的症状,但经过调整肠内营养的速度、量、配方等仍能坚持肠内营养;③完全不耐受,出现1 项及以上喂养不耐受的症状,经过积极处理后症状仍严重,最终改变营养方式。自开始肠内营养之日起持续观察危重症病人的喂养耐受性情况。耐受性评定6 h 进行1 次,连续观察7 d。

表1 肠内营养喂养不耐受评定表
1.3 观察指标
1.3.1 一般资料 肠内营养开始前1 d 记录,内容包括3 个方面:①基本资料,主要入院诊断、年龄、性别等;②病情监测,包括格拉斯哥昏迷评分(GCS)、血糖水平、白蛋白水平等;③治疗因素,包括抗菌药物使用情况、促胃动力药物使用情况、益生菌使用情况、谷氨酰胺使用情况、机械通气情况、亚低温治疗情况等。
1.3.2 肠内营养支持情况 肠内营养开始后连续7 d观察并记录,内容包括首次营养液泵入量、过渡到目标用量时间。
1.3.3 肠内营养耐受性情况 肠内营养开始后连续7 d 观察并记录,内容包括病人有无发生喂养不耐受(包括呕吐、腹泻、胃潴留、误吸)、肠内营养第几日发生喂养不耐受。
1.4 统计学方法 采用SPSS 19.0 软件进行数据分析。定量资料采用均数±标准差(±s)表示;定性资料采用频数、百分比表示,组间比较采用χ2检验。神经内科危重症病人喂养不耐受影响因素的多因素分析采用非条件Logistic 回归分析,以P<0.05 为差异有统计学意义。
2 结果
2.1 神经内科危重症病人发生喂养不耐受情况 143例危重症病人中69 例在肠内营养期间出现了喂养不耐受,发生率为48.25%,喂养不耐受发生时间主要集中在肠内营养后1~3 d,以单纯腹泻、单纯胃潴留多见,详见表2。69 例喂养不耐受病人中63 例经减少每日营养剂量、减慢泵入速度、更换营养制剂等处理后得到有效控制;6 例经积极处理后耐受性无好转,最终改用肠外营养或肠内与肠外营养相结合的方式。
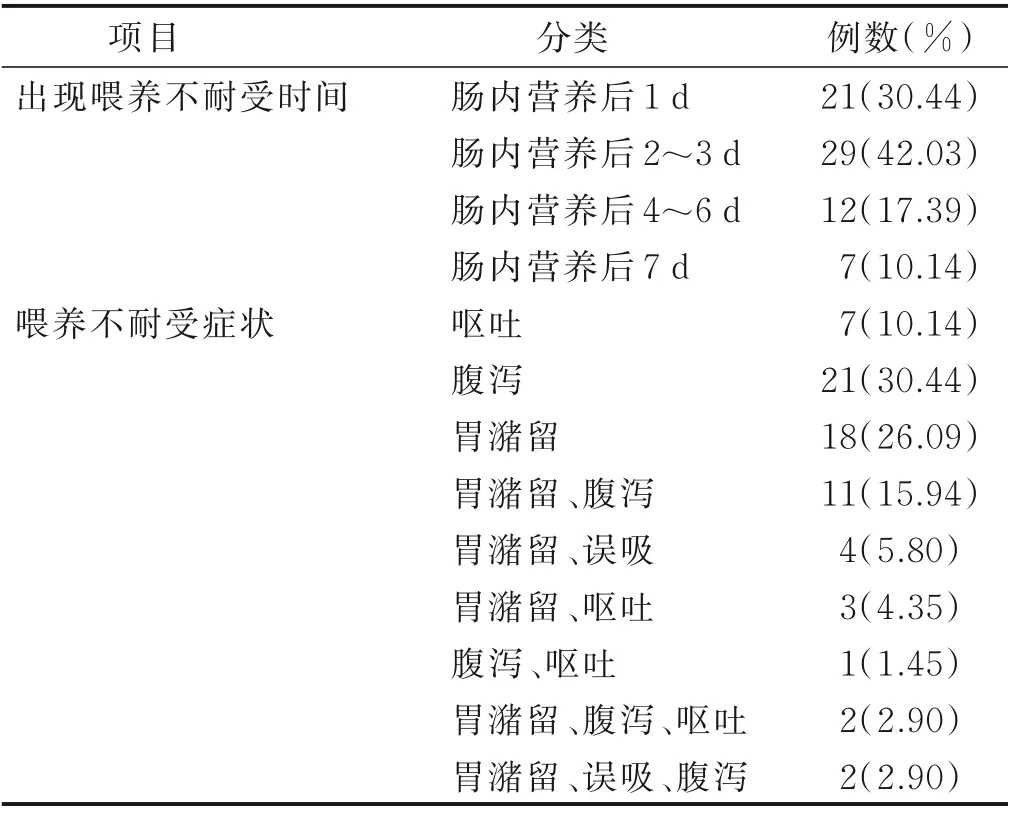
表2 神经内科危重症病人肠内营养期间喂养不耐受情况(n=69)
2.2 神经内科危重症病人发生喂养不耐受的单因素分析(见表3)

表3 神经内科危重症病人肠内营养期间发生喂养不耐受的单因素分析(n=143) 单位:例
2.3 神经内科危重症病人发生喂养不耐受的多因素分析 以是否发生喂养不耐受为因变量,将单因素分析中有统计学意义的变量作为自变量,进行多因素Logistic 回归分析。自变量赋值方式见表4,结果见表5。

表4 自变量赋值情况

表5 神经内科危重症病人肠内营养期间发生喂养不耐受的Logistic 回归分析结果
3 讨论
3.1 神经内科危重症病人肠内营养期间喂养不耐受发生的特点 喂养不耐受被普遍认为是危重症病人肠内营养的重要并发症,对危重症病人的临床结局和预后产生不良影响。研究报道临床危重症病人喂养不耐受的发生率为2%~75%[8]。本研究中神经内科危重症病人肠内营养期间喂养不耐受的发生率为48.25%,高于危重症病人喂养不耐受的平均发病率,可能与各项研究对于喂养不耐受的界定不相同有关。本组神经内科危重症病人出现喂养不耐受的时间多为肠内营养后1~3 d,与许磊[9]对重症病人喂养不耐受的调查结果较为一致,这可能与机体急性期的剧烈应激反应有关。病人神经系统遭到重创初期,机体会产生剧烈应激,刺激交感神经兴奋,循环中儿茶酚胺释放增多,导致胃肠动力紊乱、消化吸收功能受损[10]。提示肠内营养后的1~3 d 是防控神经内科危重症病人喂养不耐受发生的关键时间点,在这一时期应做好喂养不耐受的监测和预防工作,以确保肠内营养安全有效进行。
3.2 神经内科危重症病人肠内营养期间喂养不耐受发生的危险因素
3.2.1 使用亚低温治疗的病人易发生喂养不耐受本研究结果显示,行亚低温治疗的神经内科危重症病人在肠内营养过程中更容易发生喂养不耐受。王军等[11-12]研究也发现,使用亚低温治疗的神经危重症病人胃潴留的发生率较高。分析其原因,亚低温治疗作为神经内科危重症病人的重要治疗方法,尽管可保证心、脑等机体重要器官的血供,使神经内科危重症病人获益,但也减少了胃肠道的血供,使胃肠道长期处于低灌注状态,造成胃肠黏膜细胞结构和功能的完整性受损,胃肠道黏膜通透性增高、屏障功能受损、蠕动减慢,严重影响了病人胃肠道对食物的耐受性[13]。此外,亚低温治疗时应用的镇静药物也可能通过作用于肠系膜神经丛或胃肠平滑肌上的受体而损害胃肠蠕动功能,导致胃排空延迟,最终诱发喂养不耐受[14]。据报道,人的肠道具有耐受短暂缺血的能力,在120 min 内再灌注可完全逆转短暂缺血对胃肠道黏膜上皮的不利影响[15]。而长期缺血后再灌注则无法恢复大多数胃肠道黏膜上皮细胞的正常结构和功能,将会导致胃肠道功能进一步恶化[16]。因此,如何在行亚低温治疗时采取有效干预措施以改善机体低温状态下胃肠道的血液供应、减轻镇静药物对胃肠蠕动功能的损害,是一个值得研究的课题。
3.2.2 使用机械通气治疗会增加喂养不耐受发生的风险 本研究结果显示,机械通气的使用会增加神经内科危重症病人发生喂养不耐受的风险。2003 年加拿大危重症机械通气病人营养支持临床实践指南[17]指出,50%以上的危重症机械通气病人在肠内营养过程中至少发生1 种胃肠道并发症,对肠内营养的有效实施造成严重阻碍。陈莹等[18]研究指出,42.7%的机械通气病人伴有急性胃肠损伤。究其原因,可能与机械通气时气囊压力不足、未完全封闭气道,导致部分气体漏入胃部,产生胃胀气、胃张力下降、胃排空延迟有关[19],而气囊压力过高,也可能影响气道黏膜的血液循环。因此,维持合理的气囊压力对于减少喂养不耐受的发生、改善气道黏膜血液循环具有重要的作用。中国神经外科重症患者气道管理专家共识[20]一致强调,机械通气病人气囊压力应维持在20~30 cmH2O(1 cmH2O=0.098 kPa),且在鼻饲后1~2 h 内尽量不要放松气囊。此外,喂养不耐受的发生也可能与通气模式的选择相关。有研究指出,呼吸末正压通气(PEEP)对喂养不耐受的发生有影响[21],推测呼吸末正压通气可增加胸腔压力,导致静脉回流阻力增加、回心血量及心排出量减少,出现胃肠灌注不足,进而影响胃肠动力。Dagar 等[22]指出,以较低的气道峰压保证通气量,正向诱导内脏血流灌注,或许能降低与机械通气相关的喂养不耐受发生率。但目前尚缺乏相关临床实证研究佐证。因此,对于行机械通气的神经内科危重症病人,应高度警惕喂养不耐受的发生,维持正确的气囊压力,同时可考虑机械通气模式的选择对病人营养耐受性的影响。
3.2.3 使用2 种以上抗菌药物会增加喂养不耐受发生的风险 本研究结果显示,使用2 种以上抗菌药物的神经内科危重症病人喂养不耐受的发生风险增加了3.491 倍,与周田田等[23]的研究结果一致。研究认为,广谱抗菌药物的不合理使用是引发人体肠道菌群失调的最主要诱因,其原因是广谱抗菌药物的大量使用杀灭了肠道有益菌,破坏了宿主微生态的平衡[24];与此同时,也引起肠道耐药菌株增殖,进一步打破了肠道的生物屏障,损害胃肠功能,从而增加了腹泻等喂养不耐受的发生风险[25]。而神经内科危重症病人病情危重,应用抗菌药物概率较高。在临床工作中应规范抗菌药物的使用,严格掌握抗菌药物使用的适应证,有针对性地合理应用抗菌药物,避免盲目地联合使用抗菌药物。研究报道,使用益生菌可改善人体消化道菌群状态、增加宿主健康效益、促进肠道屏障功能,对提高肠内营养喂养耐受性有一定帮助,或许也可纠正抗菌药物带来的肠道菌群失调[26-28]。本研究也发现使用益生菌的病人喂养不耐受的发生率与没有使用者发生率比较差异无统计学意义,可能与病例数较少有关,需增加样本量继续观察。因此,对于确需联合使用广谱抗菌药物的病人,临床护理人员需警惕其发生喂养不耐受,或可考虑尝试使用益生菌来维护肠道菌群平衡。
4 小结
神经内科危重症病人肠内营养期间喂养不耐受的发生率较高,已成为临床神经重症护理管理的一大挑战。本研究在已有研究的基础上,进一步明确了病人的机械通气治疗、亚低温治疗、抗菌药物治疗等对神经内科危重症病人肠内营养期间喂养不耐受的影响,为预防和控制喂养不耐受的发生发展提供了有价值的依据。但也存在一定的局限性:考虑到目前平均住院日以及既往研究报道的喂养不耐受高发时间,故将观察期定为7 d,可能会遗漏部分7 d 后发生喂养不耐受的病例,导致低估喂养不耐受发生率;由于时间限制,样本量较小,且病例限制在1 所三级甲等综合医院,样本代表性有限,不足以代表神经内科危重症病人喂养不耐受的整体状况。期待更多的研究继续深入探讨,为临床减少神经内科危重症病人肠内营养期间喂养不耐受的发生提供有力证据。

