RNAi抑制小菜蛾Br-Z2/3基因对下游细胞凋亡基因表达及化蛹的影响
胡晓汉, 田素芬, 李亚勍, 林 硕, 陈艺欣, 魏 辉,顾晓军,2,*, 黄劲飞,2,*, 王曦莹, 李志华
(1. 福建农林大学植物保护学院, 福州350002; 2. 福建省农业科学研究院, 福建省作物有害生物监测与治理重点实验室,福州350003; 3. 福建省农业科学研究院, 农业农村部福州作物有害生物科学观测试验站, 福州 350013)
小菜蛾Plutellaxylostella属鳞翅目(Lepidoptera)菜蛾科(Plutellidae),在全世界140多个国家以及中国各地区普遍发生,幼虫取食十字花科作物,寄主包括甘蓝、芥蓝、花菜、白菜、萝卜、油菜等重要经济作物(https:∥www.cabi.org/isc/datasheet/42318; Zhuetal., 2011; 柯富士等, 2019)。据统计,由该虫所造成的损害及其控制成本每年全球累计达40~50亿美元(Furlongetal., 2013),中国达7.7亿美元(Lietal., 2016)。长期以来小菜蛾的防治主要依靠各类农药(包括化学农药和生物农药)的使用,但小菜蛾几乎对各种农药都能在短时间内迅速产生高水平抗性,而农药使用后产生的农药残留也可能污染环境和损害人体健康。可见,小菜蛾防治急需新的防治思路。
参与昆虫蜕皮、变态、生殖等重要生理过程及响应病原侵染、农药等不良因子胁迫的相关基因的表达均受转录因子的调控(Guoetal., 2018; Heetal., 2020; Palli, 2020; 赵国栋等, 2020),因而转录因子在害虫控制及新农药开发中具有良好的应用前景(Guoetal., 2018; Zhaoetal., 2018)。在众多转录因子中,全变态昆虫蛹期蜕皮激素的初级响应基因Br在害虫控制中的应用价值则尤为值得关注。其对化蛹的调控机制是全变态昆虫末龄幼虫体内保幼激素消失、蜕皮激素引发Br大量表达,进而结合下游靶基因如caspase家族基因Dronc及reaper,hid和Drice等细胞凋亡关键基因的启动子区域,启动化蛹进程(Jiangetal., 2000; Lee and Baehrecke, 2001; Cakourosetal., 2002; Leeetal., 2002; Kilpatricketal., 2005)。
在小菜蛾中,目前发现了Br-Z2/3及Br-Z7两种Br异构体,其中Br-Z2/3在预蛹期表达水平最高(超过表达最低成虫阶段的300倍以上),其次是在4龄幼虫末期(水平超过成虫的100倍),与小菜蛾化蛹关系更为密切(Huangetal., 2019)。通过dsRNA饲喂法处理小菜蛾4龄幼虫后,虽然靶标基因Br-Z2/3表达降低了40%,但是也有近40%的试虫成功化蛹(Huangetal., 2019),说明RNAi效率不高。本研究一方面拟采用dsRNA显微注射法实施RNAi,以期提高RNAi效果;另一方面拟采用原核表达法合成dsRNA,代替先前的试剂盒体外合成,以期提高dsRNA合成效率。应用大肠杆菌EscherichiacoliHT115表达获得dsRNA具有合成时间短、合成量大、成本低的优点,已在多种鞘翅目、直翅目昆虫中成功应用过(Ratzkaetal., 2013)。其原理是将L4440 载体(含有双向 T7 启动子和 lac乳糖操纵子)转化入大肠杆菌HT115。由于大肠杆菌HT115是RNase Ⅲ缺陷型菌株,故诱导该菌表达的目的基因 dsRNA不会被RNase Ⅲ酶切降解(Newmarketal., 2003)。基于此,本研究采用原核表达系统大量合成Br-Z2/3 dsRNA,注射法处理小菜蛾4龄幼虫后考察试虫Br-Z2/3与细胞凋亡基因reaper,caspase-9和Gadd45g表达及其化蛹变化,以期进一步阐明Br-Z2/3对小菜蛾化蛹的调控机理及其在小菜蛾防治中的应用价值。
1 材料与方法
1.1 供试虫源
供试虫源为本实验室长期室内饲养的小菜蛾敏感种群,幼虫寄主植物为萝卜苗。具体饲养方法条件:将萝卜种子浸泡过夜后,再用75%百菌清可湿性粉剂(或50%多菌灵可湿性粉剂)的500倍稀释液浸泡40 min消毒,冲洗滤干,然后将经高温湿热灭菌处理的营养土平铺在长方形不锈钢托盘(40 cm×20 cm)内(厚3~3.5 cm),充分浇水后均匀撒播萝卜种子,待萝卜苗长至约6 cm高时,饲喂小菜蛾幼虫(韩艺欣等, 2019)。集中收集蛹置于养虫笼(长×宽×高=25 cm×25 cm×30 cm)中,成虫羽化后以10%(w/v)蜜糖水补充营养,剪取鲜嫩萝卜苗(6 cm),将萝卜苗榨汁后,均匀涂于铝箔锡纸(10 cm×10 cm)(购自郑州鸿富源工贸有限公司)供成虫产卵,饲养温度25±1℃,相对湿度70%±5%,光周期16 L∶8D。
1.2 小菜蛾总RNA提取和cDNA第1链的合成
由于Br-Z2/3基因在预蛹期高表达(Huangetal., 2019),故于小菜蛾的预蛹期取样(陈艺欣等, 2011),-80℃保存备用。参考天根生化科技(北京)有限公司总RNA提取试剂盒说明书提取总RNA,参考全式金生物技术有限公司的反转录试剂盒说明书合成cDNA第1链,-20℃保存备用。
1.3 dsRNA表达载体的构建
根据本课题组前期研究已经上传NCBI的小菜蛾Br-Z2/3基因序列(GenBank登录号: MG753773.1),并以pIZT/v5-his载体中GFP序列为阴性对照,利用Primer 5.0软件设计一对扩增Br-Z2/3基因干扰片段和GFP的引物。分别在Br-Z2/3正反向引物的5′端加上SacⅠ和KpnⅠ酶切位点,以及在GFP正反向引物的5′端加上SacⅠ和SalⅠ酶切位点。引物由福州尚亚生物技术有限公司合成,序列详见表1。

表1 本研究所用引物
分别以1.2节合成的预蛹期小菜蛾cDNA和pIZT/v5-his质粒为模板,使用采购自南京诺唯赞公司的Phanta Max Super-Fidelity DNA Polymerase扩增Br-Z2/3基因RNA干扰片段及GFPRNA干扰对照片段。PCR反应程序: 95℃预变性3 min; 95℃ 15 s, 59℃ 15 s, 72℃ 30 s, 35个循环; 72℃ 5 min。1%琼脂糖凝胶电泳检测PCR产物并利用凝胶回收试剂盒(天根生化科技北京有限公司)回收并纯化上述PCR产物后,连接pEASY-Blunt Cloning载体,将阳性克隆菌液送至福州尚亚生物技术有限公司测序。
使用内切酶SacⅠ和KpnⅠ双酶切pEASY-Blunt-Br-Z2/3质粒和L4440空载体,并使用内切酶SacⅠ和SalⅠ双酶切 pEASY-Blunt-GFP质粒及L4440空载体(酶切时间均为3 h),凝胶回收后,将目的片段和L4440载体线性化片段在16℃环境中用T4连接酶过夜连接。连接产物再转化至大肠杆菌 DH5α感受态细胞中,涂板对应抗性LB固体培养基培养过夜,挑取阳性单克隆菌落扩大培养,进行酶切验证。
1.4 dsRNA表达载体的诱导表达
将1.3节构建成功的含小菜蛾Br-Z2/3基因以及GFP基因片段的dsRNA表达载体 L4440-Br-Z2/3和L4440-GFP转化至大肠杆菌HT115感受态中,涂板对应抗性平板培养过夜,挑取阳性单克隆后用T7引物扩增检测转化是否成功。挑取含有dsRNA表达载体的单菌落接种于20 mL LB液体培养基(含50 μg/mL氨苄青霉素和50 μg/mL四环素20 μL),37℃ 200 r/min振荡培养至菌液OD600=0.4~0.6,加入IPTG(终浓度1 mmol/L)诱导,再继续培养4 h,诱导dsRNA表达载体表达,收集菌液,采用细胞总RNA提取试剂盒(天根生化科技北京有限公司)提取RNA,-80℃保存备用。
1.5 显微注射法介导RNA干扰
根据小菜蛾4龄幼虫体型特征(陈艺欣等, 2011),挑取生长日龄相同、体型一致的4龄第2天小菜蛾幼虫80头随机放入8个直径5 cm底部垫有湿润滤纸的塑料培养皿中,每皿10头。 在温度25±1℃、相对湿度70%±5%、光周期16L∶8D条件下,用新鲜萝卜苗饲喂12 h。处理组、对照组各4个培养皿小菜蛾4龄幼虫分别注射100 nLBr-Z2/3 dsRNA(处理组)和100 nLGFPdsRNA(阴性对照),dsRNA浓度约为1 000 ng/μL,采用Nanoject Ⅲ显微注射器(购自武汉盖尔德纳科技有限公司,型号3-000-207),注射部位为小菜蛾4龄第2天幼虫第3腹节背板,每头试虫注射1次。以上实验进行3次生物学重复。
1.6 RNAi后Br-Z2/3, caspase-9, reaper和Gadd45g的表达水平测定
1.5节RNAi处理组和阴性对照组于12和24 h后随机选取5头幼虫,利用总RNA提取试剂盒(天根生化科技北京有限公司)提取供试小菜蛾总RNA,利用全式金生物技术有限公司反转录试剂盒合成cDNA第1链。 根据NCBI中已登录的Br-Z2/3及其下游细胞凋亡基因caspase-9(GenBank登录号: KF030680.1),reaper(GenBank登录号: KF991219.1)和Gadd45g(GenBank登录号: MW160738)的核酸序列,用软件Primer5.0设计其qPCR引物,内参基因EF-1α(GenBank登录号: EF417849)定量引物参考符伟等(2012)(表1)。qPCR反应体系参照NovoStart® SYBR qPCR SuperMix Plus (近岸蛋白质科技有限公司)的说明书。反应程序: 94℃ 2 min; 94℃ 5 s, 60℃ 30 s, 40个循环。每个处理或对照测定3个样品,每个样品3次技术重复。
1.7 RNAi后小菜蛾生物学指标观测
RNAi处理后,每6 h观察记录试虫死亡数、化蛹数、畸形蛹数,计算幼虫死亡率、化蛹率、平均化蛹时间、蛹畸形率等。死亡率=(死亡虫数/总试虫数)×100%;化蛹率=(化蛹数/试虫总数)×100%;畸形蛹率=(畸形蛹数/总化蛹数)×100%。
1.8 数据分析
基因相对表达量的计算采用2-ΔΔCT法(Livak and Schmittgen, 2001),独立样本T检验法检验处理与对照差异显著性,显著水平设定为P<0.05,运用SPSS 22.0完成。
2 结果
2.1 dsRNA表达载体的诱导表达
PCR扩增获得小菜蛾Br-Z2/3(图1: A)和GFP片段(图1: B)。将克隆的片段与克隆载体pEASY-Blunt连接转化,对pEASY-Blunt-Br-Z2/3及 pEASY-Blunt-GFP菌液PCR检测的结果也表明分别与预期片段基本相符(图1: C, D),其测序结果与预期一致。
L4440-Br-Z2/3菌液PCR检测得到一条大小接近500 bp的条带(图1: E),L4440-GFP菌液PCR检测得到一条大小接近350 bp的条带(图1: F),与预期相符;L4440-Br-Z2/3重组质粒经双酶切后得到一条约2 700 bp和一条约500 bp的条带(图1: G)。L4440-GFP重组质粒经双酶切后得到一条约2 700 bp和一条约350 bp的条带(图1: H),其结果与目的片段及线性L4440质粒片段大小一致,表明Br-Z2/3与GFP的dsRNA片段已构建至L4440载体上。测序结果也证实构建正确。
加入IPTG(1 mmol/L)后,于37℃诱导6 h,提取对照菌体总 RNA结果显示如图2。 L4440-Br-Z2/3菌株和L4440-GFP菌液均表达出与预期大小一致的dsRNA(箭头所示),而未经 IPTG 诱导的 L4440-Br-Z2/3 菌液与L4440-GFP菌液均未表达出相应dsRNA,纯化后dsRNA浓度能够高达1 040 ng/μL。

图1 RNAi载体的构建
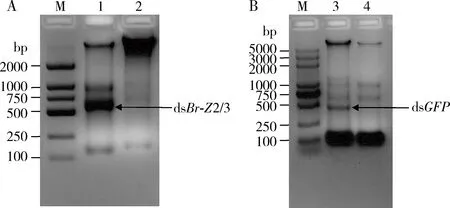
图2 dsBr-Z2/3 (A)和dsGFP (B)在细菌中表达的鉴定

图3 显微注射Br-Z2/3 dsRNA后小菜蛾4龄幼虫中Br-Z2/3, reaper, caspase-9和Gadd45g的表达量
2.2 Br-Z2/3基因RNAi后相关基因表达变化
qPCR检测结果显示,与阴性对照组比较,注射Br-Z2/3 dsRNA后12和24 h,Br-Z2/3相对表达量分别显著下降了66.75%和83.47%(图3: A)(P<0.05);reaper相对表达量在12和24 h分别显著下降了17.52%和82.71%(图3: B)(P<0.05);caspase-9相对表达量在12和24 h分别显著上升了40.35%和34.76%(图3: C)(P<0.05);Gadd45g相对表达量在12和24 h分别显著上升了321.77%和362.99%(图3: D)(P<0.01)。
2.3 Br-Z2/3基因RNAi对小菜蛾化蛹的影响
注射Br-Z2/3 dsRNA后,处理组中试虫便开始发生死亡,直至48 h幼虫死亡率才稳定在40%,而对照中死亡率较低,30 h便稳定在6.67%(图4: C);处理组中即便是存活个体也没有全部化蛹,实验结束时,处理组中化蛹率为46.67%(图4: B),试虫存活率低于60%(图4: C),而对照组中试虫化蛹率为93.33%(图4: B),存活试虫全部化蛹(图4: C);实验组中试虫化蛹也推迟,平均化蛹时间为50.13 h,显著长于对照组的34.64 h(P<0.05)(图4: A);处理组成功化蛹的个体中还有相当数量的畸形蛹,畸形率达到56.67%(图4: D),而对照组中蛹畸形率仅有6.67%(P<0.05)(图4: D);畸形主要表现为预蛹不能成功蜕皮及个体偏小(图5)。
3 讨论
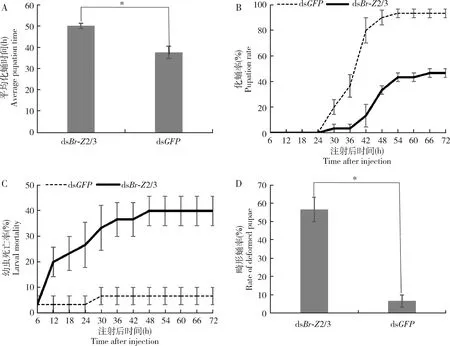
图4 显微注射Br-Z2/3 dsRNA到小菜蛾4龄幼虫后对小菜蛾平均化蛹时间(A)、化蛹率(B)、幼虫死亡率(C)和畸形蛹率(D)的影响
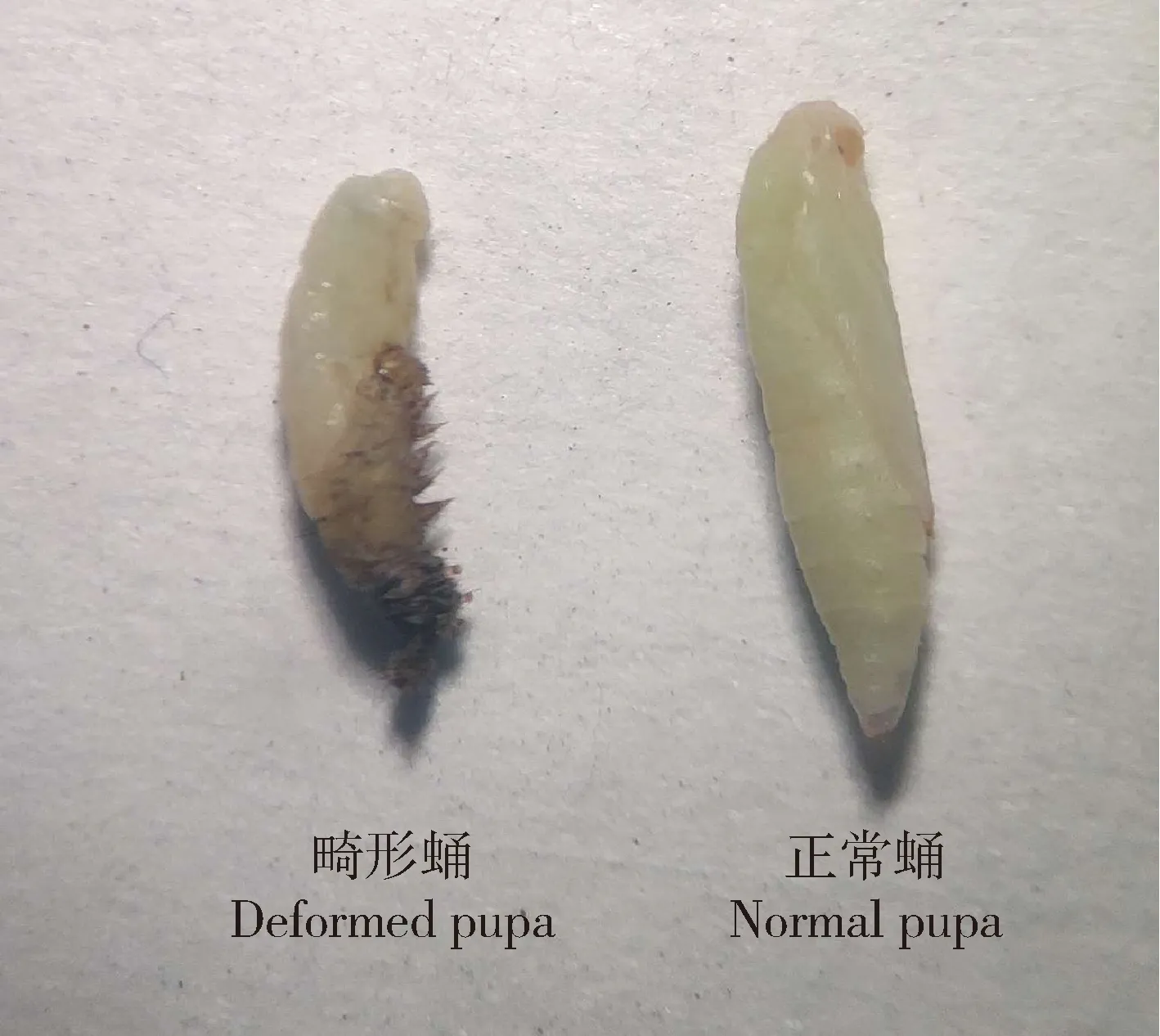
图5 小菜蛾4龄幼虫Br-Z2/3基因RNAi后畸形蛹
通过dsRNA沉默靶基因的表达是基因功能研究的重要方法。当前用于昆虫学研究中dsRNA合成主要有试剂盒体外转录以及原核表达两种。其中,dsRNA合成试剂盒价格较高,且合成 dsRNA 产出少、浓度低,而利用原核菌体表达的方法可低成本大量合成dsRNA(王雪庆等, 2018)。本研究中成功实现了Br-Z2/3 dsRNA的体外原核表达(图2),dsRNA浓度能够高达1 040 ng/μL,较好满足了实验要求。而在dsRNA的递送方面,通常有饲喂法和注射法两种,对于体型较大个体一般都采用注射法。Huang等(2019)应用饲喂法研究Br-Z2/3 RNAi后试虫化蛹变化,发现连续饲喂dsRNA 72 h后,试虫Br-Z2/3基因的表达量也仅降低了40%,最终试虫化蛹率仍可达36%。而本研究采用显微注释法注射Br-Z2/3 dsRNA 12 h后,试虫Br-Z2/3的表达量便下降了66.75%,24 h更进一步降低了83.74%(图3: A, B),可见相较于饲喂法,显微注射法见效更快、效果更好。
通常昆虫Br基因沉默与保幼激素类似物处理能表现相同的症状(Spokony and Restifo, 2007)。对小菜蛾而言,保幼激素类似物蚊蝇醚处理小菜蛾3龄末幼虫后,试虫死亡率升高、化蛹推迟、化蛹率下降(Duanetal., 2016)。本研究中Br-Z2/3 dsRNA显微注射法处理小菜蛾4龄幼虫,结果也都类似(图4)。此外,在赤拟谷盗Triboliumcastaneum研究中也发现,敲除其Br-Z1-Z4中任何一个异构体,导致试虫死亡增加的同时,也有畸形蛹的出现(Konopova and Jindra, 2008)。本研究中也发现显微注射Br-Z2/3 dsRNA后,部分试虫虽未死亡但是所化蛹却为畸形蛹(图5)。
虽然改用显微注射法后,RNAi效率显著提高,靶基因表达降低了83.74%,但是试虫最终化蛹率仍有近40%。其中可能有沉默效果仍不够彻底的原因,也可能与小菜蛾中另一个Br基因Br-Z7的存在有关。Br蛋白对全变态昆虫化蛹的启动机制是Br促进细胞凋亡因子基因reaper,hid,dronc和drice等的表达从而诱导幼虫相关组织的程序化死亡以及成虫盘的分化(Jiangetal., 2000; Cakourosetal., 2002; Riddifordetal., 2003)。因而当Br基因表达受到抑制,其下游细胞凋亡基因表达也会相应下降,这便是试虫reaper表达水平降低的原因(图3: B)。然而作为dronc同源基因的caspase-9及Gadd45g表达却显著增加(图3: C, D),其中原因尚待进一步研究。
综上所述,本研究成功构建Br-Z2/3 dsRNA原核表达系统,并利用该系统合成的dsRNA通过显微注射递送小菜蛾4龄幼虫而成功抑制Br-Z2/3基因的表达。此外,本研究发现成功干扰Br-Z2/3后,小菜蛾幼虫死亡率显著上升,化蛹高峰期推迟并出现畸形蛹;而与Br-Z2/3基因相关联的reaper,caspase-9和Gadd45g的表达量也发生了显著变化(P<0.05),说明Br-Z2/3基因作为蛹期特异表达因子能够显著影响小菜蛾的蛹期进程。

