冬凌草甲素对子宫内膜癌HEC-1B 细胞增殖、迁移和侵袭及lncRNA CCAT1 表达的影响
王 景, 刘 晶, 魏旭静, 杜亚飞, 房桂英, 李 林
(河北医科大学第一医院妇产科,河北 石家庄 050000)
子宫内膜癌是女性常见恶性肿瘤之一,近年来在世界范围内发病率呈上升趋势,具有病程发展迅速及平均生存时间短等特点,严重威胁女性健康。目前,对于子宫内膜癌的治疗,主要通过放疗和化疗等手段诱导子宫内膜癌细胞凋亡,以达到延长患者生存期的目的[1-3]。发掘有效抗癌的新活性成分,一直以来都是子宫内膜癌研究的热点,冬凌草甲素是中药冬凌草的有效成分之一,具有抗炎、抗氧化和抗肿瘤等药理作用[4-5]。研究[6]表明:冬凌草甲素具有抑制癌细胞迁移和侵袭的作用。子宫内膜癌的发生和发展是一个由多基因、多因素介导的复杂过程[7]。长链非编码RNA(long non-coding RNA,lncRNA) 是一类调控型大分子RNA,在细胞发育、X 染色体沉默和调控转录等机体生命活动过程中发挥着重要作用。研究[8-9]发现:lncRNA 在多种肿瘤中发生表达紊乱,如乳腺癌和食管癌等。其中, 结肠癌相关转录因子1 (colon cancer associated transcriptor 1, CCAT1) 是近年来发现的在结肠癌组织中异常表达的lncRNA,其相对表达水平与结肠癌细胞增殖和转移关系密切。目前国内外关于lncRNA CCAT1 在子宫内膜癌细胞中表达的研究甚少。本研究通过观察冬凌草甲素对子宫内膜癌细胞中lncRNA CCAT1 表达和癌细胞迁移及侵袭能力的影响,探讨冬凌草甲素对子宫内膜癌的作用及其机制,为临床研究提供实验依据。
1 材料与方法
1.1 细胞株、主要试剂和仪器子宫内膜癌HEC-1B细胞株购自中国科学院上海细胞库。冬凌草甲素购于上海麦克林生化科技有限公司,二甲基亚砜(DMSO) 和DMEM 培养基购于美国Sigma 公司,胰蛋白酶和胎牛血清购于中国碧云天生物试剂公司,lncRNA CCAT1 由广州锐博生物科技有限公司合成,RNA 提取试剂盒购于美国Mobio 公司,逆转录cDNA 试剂盒购于美国Invitrogen 公司。全自动凝胶成像系统购于英国Syngene 公司,Thermo ABI 2720 PCR 仪购于美国赛默飞世尔科技公司,Bio-Rad 550 酶标仪购于美国Bio-Rad 公司。
1.2 细胞培养采用含10% 灭活胎牛血清的DMEM 培养基培养子宫内膜癌HEC-1B 细胞,并置于37 ℃、5% CO2培养箱中培养,每3 d 以0.25%胰蛋白酶消化传代1 次。
1.3 MTT 法检测细胞增殖抑制率取对数生长期的HEC-1B 细胞,配成3×105mL-1细胞悬液,100 μL 接种于96 孔细胞培养板,放入培养箱中培养24 h,细胞贴壁后,弃去培养液。设对照组、阳性对照组,低、中和高剂量冬凌草甲素组,每组设置6 个复孔,阳性对照组加入2.5 mg·L-1的顺铂,低、中和高剂量冬凌草甲素组分别加入10、20 和40 μmol·L-1冬凌草甲素50 μL 孵育48 h,对照组只加入DMEM 培养液培养48 h。48 h 后向每孔加入10 μL 新配制的5 g·L-1MTT,轻轻摇匀,孵育4 h,弃去上清,每孔再加入200 μL DMSO,低速振荡30 min,使其完全溶解,酶标仪检测波长490 nm 处各孔的吸光度(A)值,计算细胞增殖抑制率。细胞增殖抑制率=(1-实验组A 值/对照组A 值)× 100%,其中实验组包括低、中和高剂量冬凌草甲素组和阳性对照组。
1.4 流式细胞术检测细胞凋亡率取对数生长期的HEC-1B 细胞,配成单细胞悬液,100 μL 接种于6 孔细胞培养板培养,设对照组和低、中及高剂量冬凌草甲素组,阳性对照组加入2.5 mg·L-1顺铂,低、中和高剂量冬凌草甲素组分别加入20、40 和50 μmol·L-1冬凌草甲素50 μL 培养48 h,弃去培养液,PBS 缓冲液清洗,离心收集细胞,PBS 缓冲液清洗,调整细胞密度为5×105mL-1,加入200 μL Binding Buffer 液,加入200 μL Annexin Ⅴ-FITC 和5 μL PI,摇匀,室温下避光放置20 min,采用流式细胞仪检测细胞凋亡率。
1.5 细胞划痕实验检测细胞划痕愈合率取对数生长期的HEC-1B 细胞,配成3 × 105mL-1细胞悬液,接种于培养板,每孔100 μL,培养12 h。倒置显微镜下观察细胞,待80%细胞融合时,弃去培养液,加入含2%血清的DMEM 培养液,继续培养24 h。待细胞单层贴壁长满时,采用移液枪枪头垂直划痕,PBS 缓冲液冲洗。设对照组,阳性对照组,低、中和高剂量冬凌草甲素组,每组设置3 个复孔。阳性对照组加入2.5 mg·L-1的顺铂,低、中和高剂量冬凌草甲素组分别加入20、40 和50 μmol·L-1冬凌草甲素50 μL 培养24 h,对照组只加入DMEM 培养液。于倒置显微镜下观察0 和24 h 时间点划痕愈合程度,计算细胞划痕愈合率,以上实验至少重复3次。细胞划痕愈合率=(0 h划痕宽度-24 h 划痕宽度)/0 h 划痕宽度× 100%。
1.6 Transwell 小室实验检测细胞侵袭能力取对数生长期的HEC-1B 细胞,配成3×105mL-1细胞悬液,取100 μL 加入Transwell 上室,设对照组,阳性对照组,低,中和高剂量冬凌草甲素组,每组设置3 个复孔。阳性对照组加入2.5 mg·L-1的顺铂,低、中和高剂量冬凌草甲素组分别加入20、40 和50 μmol·L-1冬凌草甲素50 μL,对照组只加入DMEM 培养液。下室加入含FBS 的完全培养基。培养24 h,上室内肿瘤细胞向下室聚集。24 h后,取出培养板,去上室内的细胞,下室细胞用甲醇固定,采用0.1%结晶紫染色,冲洗封片,显微镜下对下室细胞进行计数,记为穿膜细胞数,每组取5 个视野,以穿膜细胞数表示细胞侵袭能力。
1.7 实时荧光定量聚合酶链式反应(Real-time fluorescence quantitative polymerase chain reaction,RT-qPCR)法检测细胞中lncRNA CCAT1表达水平设对照组,阳性对照组,低、中和高剂量冬凌草甲素组。阳性对照组加入2.5 mg·L-1顺铂,低、中和高剂量冬凌草甲素组分别加入20、40 和50 μ mol·L-1冬凌草甲素50μL培养细胞,取贴壁细胞,分别采用0.25%胰蛋白酶消化收集细 胞,于1 000 r·min-1离 心5 min,去上清液,PBS 缓冲液洗涤,离心,弃去上清液,加入细胞裂解液50 μL,混匀,按照试剂盒说明书提取总RNA;采用逆转录酶试剂盒逆转录cDNA;以cDNA 为模板进行扩增。lncRNA CCAT1 引物序列:上游引物5'-GCCGTGTTAAGCATTGCGAA-3',下游引物5'-AGAGTAGTGCCTGGCCTAGA-3'。反应条件:94 ℃、5 min 变性,35 个 循 环;94 ℃、1 min 变 性; 55 ℃、 1 min 退 火; 72℃、1 min 延 伸;72 ℃、7 min充分延伸;120 V、30 min。采用2-ΔΔCt法计算lncRNA CCAT1 相对表达水平。
1.8 统计学分析采用SPSS 19.0 统计软件进行统计学分析。各组细胞增殖抑制率、凋亡率、划痕愈合率、穿膜细胞数和lncRNA CCAT1 表达水平均符合正态分布,以±s 表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用SNK-q检验。以P<0.05 为差异有统计学意义。
2 结 果
2.1 各组HEC-1B 细胞增殖抑制率与低剂量冬凌草甲素组比较,中和高剂量冬凌草甲素组HEC-1B 细胞增殖抑制率明显升高(P<0.05);与中剂量冬凌草甲素组比较,高剂量冬凌草甲素组HEC-1B 细胞增殖抑制率明显升高(P<0.05),且呈剂量依赖性。见表1。
2.2 各组HEC-1B 细胞凋亡率与对照组比较,阳性对照组和低、中及高剂量冬凌草甲素组HEC-1B 细胞凋亡率明显升高(P<0.05);与低剂量冬凌草甲素组比较,中和高剂量冬凌草甲素组HEC-1B 细胞凋亡率明显升高(P<0.05);与中剂量冬凌草甲素组比较,高剂量冬凌草甲素组HEC-1B 细胞凋亡率明显升高(P<0.05),且呈剂量依赖性。见表1。
2.3 各组HEC-1B 细胞划痕愈合率与对照组比较,阳性对照组和低、中及高剂量冬凌草甲素组HEC-1B 细胞划痕愈合率均明显降低(P<0.05);与低剂量冬凌草甲素组比较,中和高剂量冬凌草甲素组HEC-1B 细胞划痕愈合率明显降低(P<0.05);与中剂量冬凌草甲素组比较,高剂量冬凌草甲素组HEC-1B 细胞划痕愈合率明显降低(P<0.05),且呈剂量依赖性。见图1 和表2。
2.4 各组HEC-1B 细胞穿膜细胞数与对照组比较,阳性对照组和低、中及高剂量冬凌草甲素组HEC-1B 细胞穿膜细胞数均明显降低(P<0.05);与低剂量冬凌草甲素组比较,中和高剂量冬凌草甲素组HEC-1B 细胞穿膜细胞数明显降低(P<0.05);与中剂量冬凌草甲素组比较,高剂量冬凌草甲素组HEC-1B 细胞穿膜细胞数明显降低(P<0.05),且呈剂量依赖性。见图2 和表2。
表1 各组细胞增殖抑制率和凋亡率Tab. 1 Inhibitory rates of proliferation and apoptotic rates of cells in various groups (n=6,±s,η/%)
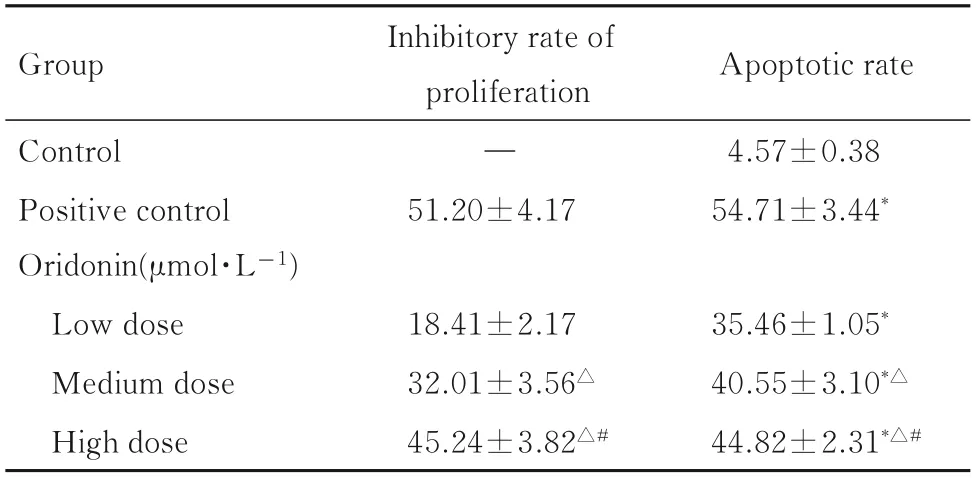
表1 各组细胞增殖抑制率和凋亡率Tab. 1 Inhibitory rates of proliferation and apoptotic rates of cells in various groups (n=6,±s,η/%)
*P<0.05 compared with control group;△P<0.05 compared with low dose of oridonin group;#P<0.05 compared with medium dose of oridonin group.“—”:No data.
Group Apoptotic rate Control Positive control Oridonin(μmol·L-1)Low dose Medium dose High dose Inhibitory rate of proliferation—51.20±4.17 4.57±0.38 54.71±3.44*35.46±1.05*40.55±3.10*△44.82±2.31*△#18.41±2.17 32.01±3.56△45.24±3.82△#

图1 各组HEC-1B 细胞迁移能力Fig.1 Migration abilities of HEC-1B cells in various groups
2.5 各组HEC-1B 细胞中lncRNA CCAT1 表达水平与对照组比较,低、中和高剂量冬凌草甲素组HEC-1B 细胞中lncRNA CCAT1 表达水平明显降低(P<0.05);与低剂量冬凌草甲素组比较,中和高剂量冬凌草甲素组HEC-1B 细胞中lncRNA CCAT1 表达水平明显降低(P<0.05);与中剂量冬凌草甲素组比较,高剂量冬凌草甲素组HEC-1B细胞中lncRNA CCAT1 表达水平明显降低(P<0.05)。见表3。
3 讨 论
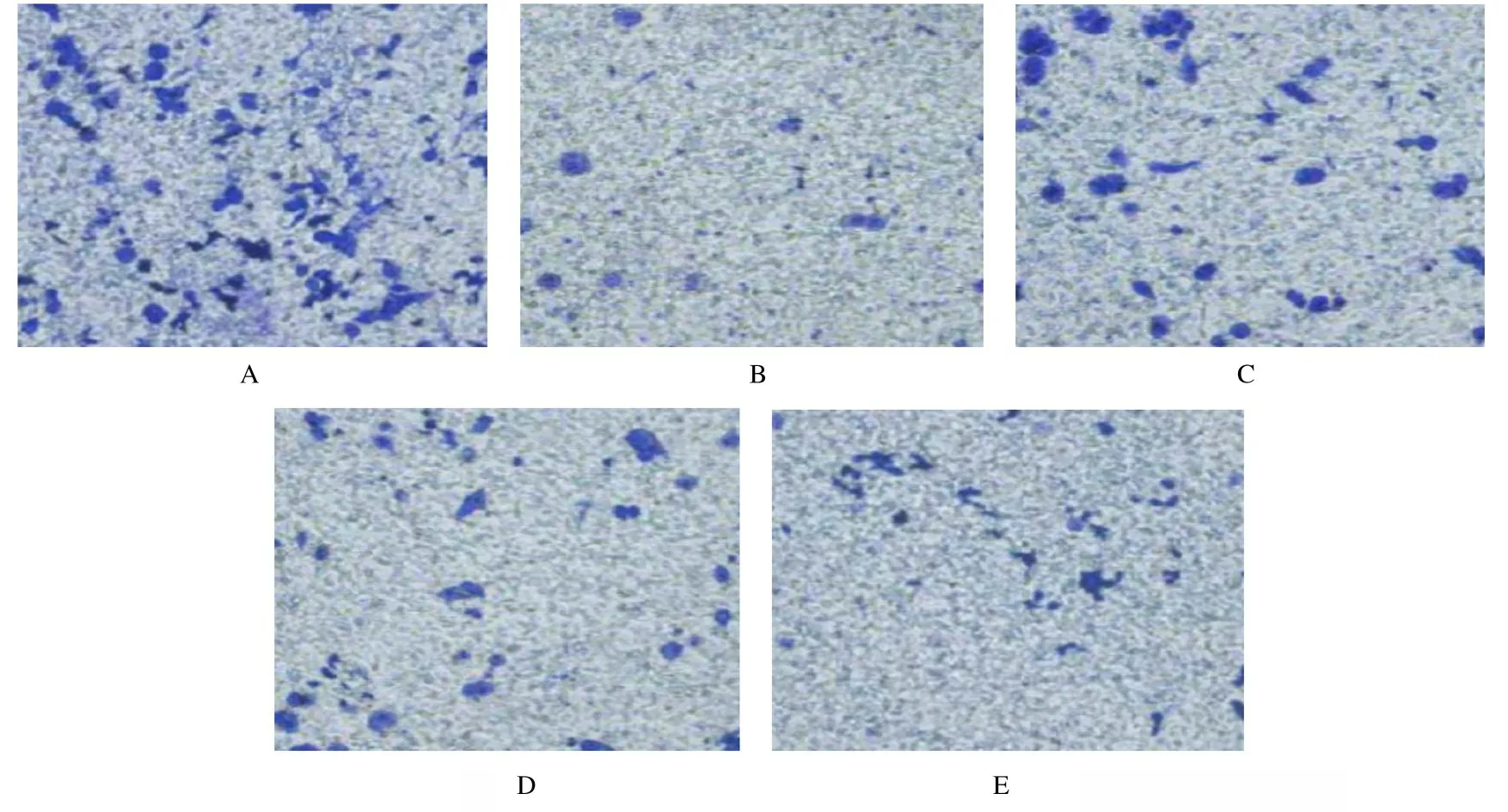
图2 各组HEC-1B 细胞侵袭能力(结晶紫,×400)Fig.2 Invasion abilities of HEC-1B cells in various groups(Crystal violet,×400)
表2 各组细胞划痕愈合率和穿膜细胞数Tab. 2 Scatch healing rates and number of transmembrane cells in various groups (n=3,±s)

表2 各组细胞划痕愈合率和穿膜细胞数Tab. 2 Scatch healing rates and number of transmembrane cells in various groups (n=3,±s)
*P<0.05 compared with control group;△P<0.05 compared with low dose of oridonin group;#P<0.05 compared with medium dose of oridonin group.
Group Control Positive control Oridonin(μmol·L-1)Low dose Medium dose High dose Scatch healing rate(η/%)84.3±7.7 34.8±5.3*Number of transmembrane cells(n)196±25 58±16*121±10*99±15*△74±11*△#66.4±7.1*51.6±6.1*△37.3±5.2*△#
lncRNA 是一种非编码RNA转录因子,由200多个核苷酸组成,是一种重要的肿瘤调节因子[10]。lncRNA 的功能十分广泛,对激活或抑制转录、修饰与沉默染色体等多个过程都具有调控作用。研究[11-12]表明: lncRNA 可作为竞争性内源RNA 调控miRNAs 的转录表达,如PVT1 和XIST 等,具有调控细胞增殖和凋亡的作用。lncRNA CCAT1在正常细胞损伤时表达上调,其异常表达可通过调节miRNAs 的下游作用靶点MYC 蛋白的激活促进胃癌和肝癌等癌细胞增殖和迁移[13-16]。冬凌草甲素是香茶菜属植物冬凌草的一种活性物质,具有抗氧化、抗炎和抗菌等广泛的药理作用[17-19]。冬凌草甲素能够通过诱导表观遗传学改变,调控肿瘤关键分子和相关信号通路,有效调节、抑制肿瘤细胞的增殖,诱导细胞凋亡,具有抗肿瘤作用[20-21]。
表3 各组HEC-1B 细胞中lncRNA CCAT1 表达水平Tab. 3 Expression levels of lncRNA CCAT1 in HEC-1B cells in various groups (n=3,±s)
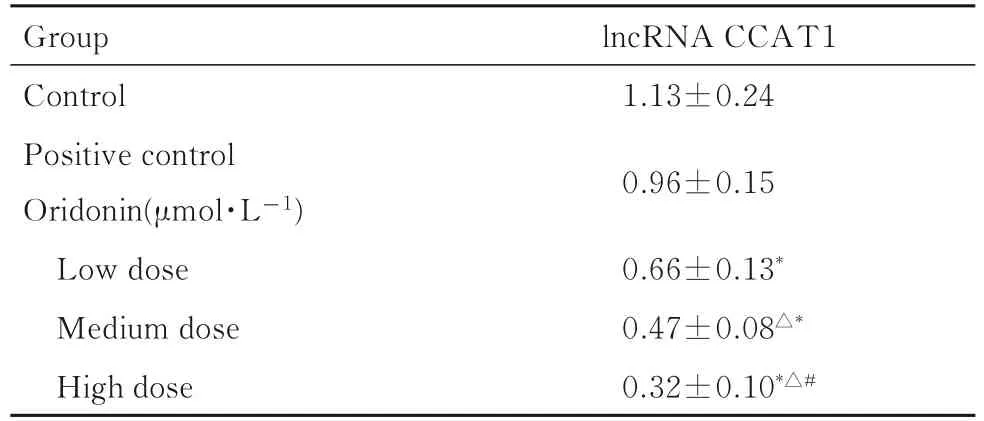
表3 各组HEC-1B 细胞中lncRNA CCAT1 表达水平Tab. 3 Expression levels of lncRNA CCAT1 in HEC-1B cells in various groups (n=3,±s)
*P<0.05 compared with control group;△P<0.05 compared with low dose of oridonin group;#P<0.05 compared with medium dose of oridonin group.
Group Control Positive control Oridonin(μmol·L-1)Low dose Medium dose High dose lncRNA CCAT1 1.13±0.24 0.96±0.15 0.66±0.13*0.47±0.08△*0.32±0.10*△#
本研究结果显示:低、中和高剂量冬凌草甲素组细胞增殖抑制率明显提高,细胞凋亡率明显升高,划痕愈合率明显降低,侵袭细胞数明显减少,说明不同剂量冬凌草甲素可抑制HEC-1B 细胞增殖,促进细胞凋亡,抑制其迁移和侵袭能力,具有剂量依赖性。采用不同剂量冬凌草甲素干预子宫内膜癌HEC-1B 细胞后,癌细胞中lncRNA CCAT1 表达水平明显降低,说明冬凌草甲素能够下调lncRNA CCAT1 表 达 水 平。lncRNA CCAT1 位 于染色体8q24.21 cMyc 基因增强子区域,cMyc 能够通过与lncRNA CCAT1 启动子区域的特定区域结合,增强lncRNA CCAT1 转录,促进增殖能力,同时还可抑制细胞凋亡[22],因此本文作者推测,冬凌草甲素抑制HEC-1B 细胞增殖、促进细胞凋亡可能与介导lncRNA CCAT1 表达有关。
综上所述,冬凌草甲素可通过抑制子宫内膜癌细胞中CCAT1 表达,抑制细胞增殖、迁移和侵袭,促进细胞凋亡,本研究为冬凌草甲素抑制子宫内膜癌细胞生长的研究提供了理论依据。

