多维生物网络探讨鸦胆子治疗溃疡性结肠炎的潜在药效成分和分子机制*
陈文璐,王乐琪,万力生,张怡萍,李莎莎,4**,肖 雪
(1. 广州中医药大学深圳市儿童医院 深圳 518038;2. 广州中医药大学第二附属医院 广州 510006;3. 广东药科大学中医药研究院 广州 510006;4. 广东省中医药防治难治性慢病重点实验室 广州 510006)
溃疡性结肠炎(Ulcerative colitis,UC)是由环境、遗传、感染、免疫等多因素相互作用引起的结肠和直肠慢性非特异性炎症性疾病,属于炎症性肠病(Inflammatory bowel disease,IBD)[1]。临床上以反复发作的腹泻、腹痛、黏液脓血便、里急后重为主要表现,可伴有便秘、腹胀、食欲不振、恶心等消化系统症状以及发热、营养不良等全身反应,部分UC 患者可出现中毒性巨结肠、直肠结肠癌变等并发症[2]。西医治疗上主要以5-氨基水杨酸、糖皮质激素、免疫抑制剂等药物控制炎症反应以及对症治疗为主,但长期疗效欠佳,大部分患者存在复发情况。与之对应,传统医学在缓解UC 症状、预防UC 复发方面具有一定的优势[3]。在我国,UC 近年患病率明显增加,因此开展中医药治疗UC的临床应用和作用机制研究,具有较好的前景。
从中医药角度出发,筛选对UC 具有潜在治疗作用的中药及复方,探讨其治疗UC 的潜在药效成分和作用机制,可以为UC 的治疗提供更多的途径,同时能为中药及其复方治疗UC 提供良好的示范研究。根据临床报道和文献研究,选择传统中药鸦胆子作为研究对象。鸦胆子为苦木科植物鸦胆子Brucea javanica(L.)Merr.的干燥成熟果实,其味苦、性寒、有小毒,归大肠、肝经,具有清热解毒、止痢截疟之功效[4]。《医学衷中参西录》中记载鸦胆子“善治热痢赤痢,二便因热下血,最能清血中之热及肠中之热”[5]。现代药理研究表明鸦胆子具有抗疟[6]、抗癌[7]、抗炎[8]、抗阿米巴原虫[9]、抗胃溃疡[10]以及调控免疫系统[11]的作用,临床多用于治疗癌症、疟疾、阿米巴痢疾等[12]。动物实验表明鸦胆子药渣可以降低肠炎小鼠的疾病活动指数和组织损伤评分,结肠组织中的TNF-α、IL-1β、IFN-γ等促炎因子的水平下降,小鼠体重下降有所改善[13],提示鸦胆子可用于治疗部分肠道疾病。
网络药理学是生物信息学、系统生物学、多向药理学等多学科交叉的理论,是促进中医药现代化的重要手段,在中医药研究中已经得到广泛应用[14-15]。它的多维性与中医药的整体观念类似,利用网络药理学方法构建“中药-成分-靶点-疾病-通路”相关网络,并对该生物网络进行分析,筛选出其中可能发挥主要作用的药效成分、关键靶点、通路,阐明中药及复方在治疗疾病中的具体作用机制,同时也能节约药物研发成本,提高研发效率。基于此,本文拟采用网络药理学技术研究鸦胆子治疗UC 的作用机制,为其临床应用提供理论参考和支持。
1 材料与方法
1.1 鸦胆子化学成分库构建及靶点预测
将“鸦胆子”输入TCMGeneDIT 数据库(http://tcm.lifescience.ntu.edu.tw/index.html)进行查询;同时在中国知网(http://www.cnki.net/)中以“(篇名=鸦胆子)AND(篇名=成分)”为检索条件、以“资源范围:总库;中英文扩展;更新时间:不限”为检索范围,开展文献检索。将二者结果相结合,整理出鸦胆子的化学成分。
通 过 ChemicaBook 数 据 库(https://www.chemicalbook. com/)和 PubChem 数 据 库(https://pubchem.ncbi.nlm.nih.gov/)查询化学成分的CAS 号和SMILES 字符串(Simplified molecular input line entry specification,SMILES)。将得到的SMILES字符串输入SwissTargetPrediction(http://www. swisstargetprediction.ch/,http://old.swisstargetprediction.ch/)进行化合物的靶点预测,得到鸦胆子化学成分的作用靶点。
1.2 疾病靶点预测
以“ulcerative colitis”为关键词在GeneCards 数据库(https://www.genecards.org/)进行搜索,收集与UC 相关的靶点,即疾病靶点。
将得到的疾病靶点输入String11.0(https://stringdb.org/)中,分组选中“Multiple Proteins”,设定物种为“Homo sapiens”,其余保持默认值,得到疾病靶点互相作用关系。
1.3 “成分-疾病-潜在靶点”网络构建
将整理好的鸦胆子“成分-靶点”信息导入Cytoscape3.7.2软件,构建鸦胆子的“成分-靶点”图,同时利用该软件构建“(疾病)靶点-靶点”图,使用软件的Merge 功能找到以上2 个网络中的共同靶点,即为鸦胆子治疗UC 的潜在靶点。将潜在靶点输入String11.0 中,分组选中“Multiple Proteins”,设定物种为“Homo sapiens”,其余保持默认值,得到潜在靶点互相作用网络图。同时利用Cytoscape3.7.2软件构建“成分-疾病-潜在靶点”图。
1.4 潜在靶点富集分析及网络构建
利用Cytoscape3.7.2 软件的ClueGo 插件对潜在靶点进行富集分析,设定P<0.01,其余参数默认,开展GO 功能分析中的生物过程(Biological process)、分子功能(Molecular function)分析;同样条件下对潜在靶点进行KEGG通路分析,确定潜在靶点的通路。
使用Cytoscape3.7.2 软件构建“通路-靶点”网络,利用Merge 功能将其与“成分-疾病-潜在靶点网络互作图”合并,构建“成分-疾病-潜在靶点-通路网络”网络图。
2 结果
2.1 鸦胆子化学成分库构建及靶点预测
通过文献检索得到相关文章72篇,将其整理后与TCMGeneDIT 数据库结果汇总并去重,共得出鸦胆子的74 个化学成分,其中能够查询到SMILES 字符串的成分有47个(表1)。
在SwissTargetPrediction 网站预测得到3932 个成分靶点,删除Probability为0值(假阳性)的靶点及其对应的化学成分(Bruceine C,Bruceine E)并将靶点去重后,剩余503 个成分靶点,与45 个有效成分相对应。将“成分-靶点”信息导入Cytoscape3.7.2 软件构建“成分-靶点”网络图。
2.2 疾病靶点预测及网络构建
通过Genecards 数据库查询,共得到与UC 相关的靶点3870 个,说明UC 是一种由多基因调控的疾病。以“relevance score ≥10”为筛选条件,筛选出疾病靶点234个。

表1 鸦胆子化学成分表
2.3 “成分-疾病-潜在靶点”网络图构建
将2.2 中的234 个疾病靶点导入String11.0 数据库,得到疾病的靶点互相作用关系图,下载tsv 格式文本并导入Cytoscape3.7.2 软件,构建“(疾病)靶点-靶点”互作网络图。使用软件的Merge功能,将“成分-靶点”网络与“(疾病)靶点-靶点”取交集,得到疾病与成分的重合靶点41 个,即为潜在靶点,说明鸦胆子可能通过作用于这41 个靶点而对UC 产生影响。将41 个潜在靶点导入Cytoscape3.7.2软件,构建潜在靶点互作网络图(图1)。
使用Cytoscape3.7.2 软件的Merge 功能,将“成分-靶点”网络图与“潜在靶点”互作图取并集,剔除其中无潜在靶点的8个成分节点,得到“成分-疾病-潜在靶点”互作网络图(图2)。鸦胆子通过多成分-多靶点作用于UC,该网络共有边467 条,节点78 个,其中成分节点37 个,潜在靶点节点41 个,平均邻居节点数为11.974。计算得到该网络中成分的平均节点度为4.027,潜在靶点的平均节点度为19.146。节点度大于4.027的成分如木犀草素、亚油酸、棕榈酸、鸦胆亭等可能为鸦胆子发挥药效的主要成分,节点度大于19.146的 潜 在 靶 点 如PTGS2、IL6、AKT1、EGFR、STAT3、HIF1A等可能为鸦胆子治疗UC的关键靶点。
2.4 潜在靶点的富集分析及成分-疾病-潜在靶点-通路网络构建
2.4.1 富集分析
使用Cytoscape3.7.2 软件中的GlueGo 插件,对筛选出的41个潜在靶点进行GO 功能分析以及KEGG 通路分析。

图1 潜在靶点互作图

图2 成分-疾病-潜在靶点网络互作图
输入41 个潜在靶点,设置P<0.01,选择GO 功能分析中的生物过程(Biological process)、分子功能(Molecular function)分析(图3)。潜在靶点主要富集在骨骼肌卫星细胞增值的正调控(Positive regulation of skeletal muscle satellite cell proliferation)、白三烯参与的炎症反应(Leukotriene production involved in inflammatory response)、氰钴胺素反应(Response to cobalamin)、多巴胺能的负性调节突触传递(Negative regulation of synaptic transmission, dopaminergic)、缺氧时RNA 聚合酶II 启动子转录的正调控(Positive regulation of transcription from RNA polymerase II promoter in response to hypoxia)、细胞对肽聚糖的反应(Cellular response to peptidoglycan)、过氧化氢代谢过程的负调控(Negative regulation of hydrogen peroxide metabolic process)等生物过程及分子功能上。
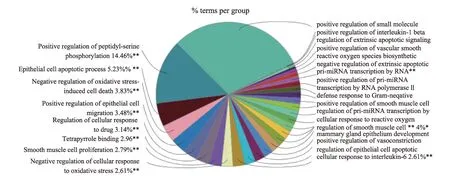
图3 GO功能分析结果图
输入41 个潜在靶点,设置P<0.01 进行KEGG 通路分析,选取前10 条通路进行展示(图4、表2)。由图4 可知,鸦胆子治疗UC 可能是通过癌症相关通路(Pathway in cancer)、HIF-1 信号通路(HIF-1 signaling pathway)、AGE-RAGE 信 号 通 路(AGE-RAGE signaling pathway in diabetic complications)、趋化因子信号通路(Chemokine signaling pathway)、病毒感染及疾病通路等多条通路发挥作用。表2展示了富集在各条通路上的具体靶点,表明鸦胆子可能是通过调控通路上的多个靶点而影响整条通路。

图4 KEGG通路富集分析图
2.4.2 成分-疾病-潜在靶点-通路网络构建
为了验证通路与靶点之间的互作关系,选取部分通路导入Cytoscape3.7.2软件,构建“通路-靶点”网络,使用Merge 功能将其与“成分-疾病-潜在靶点网络互作图”合并,构建“成分-疾病-潜在靶点-通路”网络图(图5)。该图中边526 条,节点106 个,其中10 个内圈节点代表通路,37 个中圈节点代表成分,59 个外圈节点代表合并后的靶点。表示鸦胆子可能是通过这37个关键成分,调节41 个潜在靶点的表达,并由此影响关键通路,从而发挥治疗UC的作用。
3 讨论
3.1 鸦胆子“清热利湿”适用于UC主要证型
UC 缠绵难愈,病势呈复发、缓解、复发的波浪式进程,该特点决定了患者需要长期、反复地对病情进行治疗或监控炎症进展防止恶化[16-17]。UC 给患者的经济、生理和心理都会带来不良影响,如何缓解症状与预防其复发的问题亟待解决。张天涵等[16]研究认为UC 轻度活动期患者以脾虚湿蕴证为主,其次是大肠湿热证,再次为脾虚肝郁证;中度及重度活动期患者均以大肠湿热证为主。而鸦胆子擅长清热利湿凉血解毒,适用于UC 的主要证型。盛英丽[18]对150 例UC活动期患者进行随机对照实验,验证了鸦胆子油口服乳液保留灌肠对于UC 有明显的治疗作用。临床研究证实鸦胆子对UC 有治疗作用,但其作用机制鲜有报道。而现代对于鸦胆子的研究多集中于其抗肿瘤作用上,较少关注鸦胆子治疗痢疾这一传统应用[19]。因此,利用网络药理学方法分析并探索鸦胆子治疗UC的作用机制,可为其进一步的研究及临床应用提供一定的理论指导。

表2 “通路-靶点”表

图5 成分-疾病-潜在靶点-通路网络图
3.2 鸦胆子主要药效成分分析
本研究发现木犀草素、亚油酸、棕榈酸等可能为主要的药效成分。木犀草素是一种天然四羟基黄酮化合物,具有多种药理活性,如消炎、抗过敏、抗肿瘤、抗菌、抗病毒等[20]。亚油酸具有防癌抗癌、抗粥状动脉硬化、参与脂肪分解与新陈代谢、增强机体免疫能力等作用,属于人体必需脂肪酸[21]。棕榈酸属于饱和脂肪酸,可通过损伤线粒体氧化呼吸链的正常功能,导致细胞发生氧化应激反应[22]。研究结果示鸦胆子在治疗UC 的过程中,木犀草素主要通过作用于PTGS2、AKT1、MMP9、TERT 等关键靶点发挥作用,亚油酸主要影响PTGS2、IL6、MMP2、TERT、NOS2等关键靶点发挥作用,棕榈酸主要影响TERT、ABCB1 等靶点发挥作用。以上靶点参与炎症反应、氧化作用、癌症等,与主要药效成分抗炎、抗氧化及抗癌作用相关联。李越等[23]研究表明木犀草素可能是通过激活Nrf2 信号通路,增强小鼠结肠抗氧化活性、抑制促炎因子TNF-α、IL-6 表达,缓解由葡聚糖硫酸钠诱导的小鼠UC。Chen 等[24]研究显示木犀草素能够抑制小鼠巨噬细胞分泌TNF-α等促炎因子,从而减轻UC 的炎症反应。且有研究证实木犀草素对结肠癌HT-29 细胞增殖、迁移及上皮间质转化具有抑制作用[25],说明木犀草素能够控制UC 进一步发展为癌症,还可以有效抑制结肠癌的发展和转移。覃一枫等[26]通过代谢组学研究发现调节亚油酸可以减轻伊立替康所致肠炎的小鼠的炎性症状。马清林等[27]发现棕榈酸可能是乌梅丸治疗UC 的主要药效物质基础。通过网络药理学技术预测得出的潜在药效成分与现有实验研究结果相符,可为鸦胆子有效成分的深入研究和应用提供参考。
3.3 潜在靶点及KEGG通路分析
鸦胆子治疗UC 可能是通过IL6、STAT3、AKT1、EGFR、HIF1A 等多个靶点以及HIF-1 信号通路(HIF-1 signaling pathway)、AGE-RAGE 信号通路(AGERAGE signaling pathway in diabetic complications)、癌症通路(Pathway in cancer)等多个通路发挥作用。
3.3.1 潜在靶点分析
白细胞介素6(Interleukin-6,IL-6)是细胞因子核心成员,是UC发展过程中的关键因子[28]。IL-6主要通过“反式传导信号”诱导STAT3 磷酸化,激活转录因子NF-κB(Nuclear factorκB)信号通路,NF-κB 从细胞质进入细胞核内,调控炎性细胞因子的表达[29]。目前已有研究发现针对IL-6 或NF-κB 的靶向治疗能够抑制甚至阻断炎症的发生[30]。
信号传导与转录激活因子3(Signal transducer and activator of transcription 3,STAT3)存在于细胞核内,由Sinapaldehyde 调控参与到抗炎过程中[31],已被研究证实与UC 发病密切相关[32]。一方面,临床实验[33]发现STAT3 被细胞因子激活后发生磷酸化形成磷酸化STAT3(P-STAT3),定位于UC 患者肠道炎症活动性的区域,此时发现UC 患者体内的STAT3 及P-STAT3 的表达均比健康人升高,且表达水平随内镜下及临床病变活动度的加重逐渐增加。该结果说明了STAT3 不仅是判断UC 是否存在的依据,更能作为一个动态指标反映UC 的发展阶段。另一方面,研究发现[34]STAT3作为一种可介导多种信号通路的转录因子,通过调控基因表达会对肠膜上皮Claudin-1 和Occludin 的表达水平产生影响,而Claudin-1和Occludin的表达减少是UC发病及进展的重要分子学基础,STAT3通过破坏肠黏膜机械屏障的完整性参与了UC 的发病。以上研究证实了STAT3 通过参与炎症反应及破坏肠道屏障导致UC 的发生,进一步研究对STAT3 的靶向阻断有助于UC的诊治。
AKT1 属于AKT 激酶的3 种紧密相关的丝氨酸/苏氨酸蛋白激酶之一,另外2 种为AKT2、AKT3,能够参与调节代谢、增殖、细胞存活、生长和血管生成等过程,该靶点涉及的AKT 信号通路与炎症反应相关[35]。马西等[36]通过体外培养结肠癌细胞株HCT-8,测定AKT1 以及其他相关炎症因子的表达,发现炎症因子可以通过调控PI3K/Akt 信号通路促进结肠癌侵袭转移。说明AKT1 在肠道炎症性疾病以及癌症转移等方面都会产生影响,该靶点受到木犀草素等成分的调控,与木犀草素抗炎、抗肿瘤的药理活性相适应。
3.3.2 KEGG通路分析
晚期糖基化终末产物(Advanced Glycation End Products,AGEs)是在非酶促条件下一些蛋白质、氨基酸、脂质与葡萄糖或其他还原糖经过一系列化学反应形成的;晚期糖基化终末产物受体(Receptor for Advanced Glycation End,RAGE)属于免疫球蛋白超家族受体[37]。AGE-RAGE 可激活核转录因子NF-κB,启动异常的炎症反应;亦可诱导氧化应激反应,损害细胞[38]。UC 是以炎症反应为主的疾病,激活AGERAGE 信号通路则可以通过激活炎症反应和氧化应激反应,促进UC发生发展。
HIF-1 信号通路主要依靠HIF-1 发挥作用。缺氧诱导因子-1(HIF-1)异质二聚体由2 个亚基:HIF-α(HIF-1α或HIF-2α)和HIF-1β构成[39],是细胞适应低氧胁迫的关键转录因子。UC 发生时会使肠道处于低氧甚至缺氧状态,细胞出现氧化应激,导致氧自由基及相关代谢产物堆积,对细胞产生毒性损害;且氧化应激使氧化剂与抗氧化剂失衡,损伤肠黏膜[30]。Sun M等[40]证明了HIF-1α能够调节肠道炎症和维持粘膜内稳态;Higashiyama M 等[41]阐明了缺氧是通过HIF-1α依赖调节细胞因子平衡来控制肠道炎症。这些研究说明了通过诱导HIF1A(HIF-1α)靶点,激活HIF-1 信号通路,有助于控制炎症。
3.4 小结
综上所述,网络药理学研究表明中药鸦胆子治疗溃疡性结肠炎是具有多成分-多靶点-多通路协同作用的特点,且预测得出的结果与现有研究报道中相一致,可从一定程度上为临床实际应用提供参考。研究发现鸦胆子通过其有效成分,干预溃疡性结肠炎发展的关键靶点及通路,减缓疾病的发展,提示我们可对鸦胆子进行更加全面的综合开发和深入研究。然而本研究仅是基于数据库和文献预测得出的结果,尚需要进行系统的实验验证。

