贵州不同品种猪精液品质检测结果分析
陈大芳,李 平,唐明宗,申金容,张云淞,曾 金
(贵州省种畜禽种质测定中心,贵州 贵阳 550018)
在养猪生产过程中,公猪精液品质的优劣是人工授精技术的关键,影响到母猪的受胎率和产仔数,直接关系到猪场的经济效益[1]。进行精液品质的检测,可为精液稀释、保存和利用提供依据,准确判定精液的品质优劣,也是检验公猪生殖器官机能、公猪饲养管理、采精操作技术等效果的衡量,对养猪生产具有重要意义。本试验拟从影响受精力相关程度较大的指标如精子密度、稀释后精子活力、每剂量直线前进运动精子数、精子畸形率等进行不同品种的猪精液品质检测结果比较,拟为判定不同品种猪的精液质量提供一定数据参考。
1 材料与方法
1.1 样品来源
种公猪精液来源于贵州省境内的1个种公猪站及9个种猪生产企业,共采集10批次47头精液样品(原精液及常温精液)做为试验对象,各猪场的稀释液均为购买不同品牌长效稀释剂进行配制,品种为引进品种(大白、长白、杜洛克)及地方品种(柯乐猪)。分别采集大白猪15头、长白猪15头、杜洛克猪12头、柯乐猪5头等共4个品种精液进行检测。
1.2 试验时间及地点
2020年5—9月,贵州省种畜禽种质测定中心承接部检种畜禽质量安全监督检查工作任务,针对贵州境内省9个地州市部分种公猪站及种猪生产企业生产的种公猪精液进行抽检,共抽检了10批次,每次抽检1个猪场,每个猪场抽检3~5头种公猪原精液及常温精液样品,装入16~18 ℃恒温保存箱,严格按照运输要求,带回贵州省种畜禽种质测定中心精液检测室进行检测。
1.3 检测设备
精子质量分析系统(AndroVision Minitube/德国)、精子密度仪(SDM6-Minitube/德国)、正直显微镜(CX41-奥林巴斯/日本)、恒温保存箱、恒温预热板、血球计数板、载玻片、盖玻片、移液枪、比色杯等。
1.4 检测方法
按照国家标准GB/T 25172—2010《猪常温精液生产与保存技术规范》[2]和GB 23238—2009《种猪常温精液》[3]中的方法进行检测。
1.5 数据统计与分析
数据统计采用Excel表格处理,分析采用SPSS软件,检测数据以平均值±标准差表示。
2 检测指标
2.1 精子密度
采用精子密度仪(米尼图Minitube SDM6)直接检测。1)每周使用前进入实用程序中先进行“暗度较正”,再用一个容量为4 mL的比色皿加入4 mL 0.9%氯化钠溶液做“零度较正”,取出较正空白比色皿。2)另取空比色皿一个,用移液器加入3.5 mL 0.9%氯化钠溶液,再加入70 µL的原精精液样本,顺势冲吸枪头几次彻底排空枪头中的精液。3)在触摸屏上选择测量模式设置仪器参数,输入样品的ID号、精液量、精液活力进行自动分析,按确认“模式”输出结果并记录。
2.2 精子活力
取两个剂量的常温精液轻轻摇动均匀,分别用移液器吸取精液约25 µL置于载玻片上并加盖玻片,在37 ℃条件下,用显微镜(200~400倍)观察精子活力。每个样片观察3个视野,并观察不同液层内的精子运动状态,进行全面评定。
计算公式如下:

式中:M为活力;n1为第一视野活力;n2为第二视野活力;n3为第三视野活力。
2.3 每剂量直线前进运动精子数
用移液枪吸取50 µL样品,使用3.0%氯化钠(NaCl)溶液0.95 mL与其混匀。将备好的血球计数板用盖玻片将计数室盖好,用移液枪吸取稀释精液打入盖玻片边缘,使精液自行流入到计数室中,均匀充满,不允许有气泡或厚度过大,在400倍显微镜下观察计数。
(1)每剂量中精子数=5个中方格精子数×100万×剂量值。
(2)每剂量中直线前进运动的精子数计算:

式中:C为每剂量中前进运动精子数,单位为个;s为每剂量中精子数,单位为个;m为活力,单位%。
2.4 精子畸形率
采用伊红或姬姆萨染色法。1)抹片:用移液器吸取1滴解冻后精液滴于载玻片一端,用另一张载玻片的一边与样品呈35°夹角,将精液样品均匀地涂抹于载玻片上,然后自然风干约5 min,每个样品制备2~3个抹片;2)固定:在风干的抹片上滴1.0~2.0 mL中性福尔马林固定液,固定15 min后用清水缓缓冲去固定液,然后自然风干或吹干;3)染色:将固定好后的抹片反扣在带有平槽的有机玻璃槽面上,将染液滴于槽和抹片之间,让其充满平槽并使抹片接触染液,染色1.5 h后用清水缓缓冲去染液,晾干待检;4)镜检:将制备好的抹片在显微镜(400~600倍)下观察,每个抹片观察200个以上的精子(分左、右两个区),取两片的平均值,两片畸形率的差值不得大于6。
精子畸形率的计算:
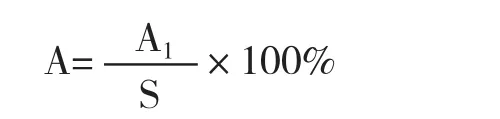
式中:A为精子畸形率,单位%;A1为畸形精子数,单位为个;S为精子总数,单位为个。
3 结果与分析
3.1 精子密度比较分析
按照GB/T 25172—2010《猪常温精液生产与保存技术规范》[1]要求,分别对大白、长白、杜洛克、柯乐猪种猪的原精液进行检测,检测头份及结果见表1。由表1可知,精子密度顺序为杜洛克>长白>大白>柯乐猪。杜洛克较高,长白、大白差异不大,柯乐猪略低于其他3个品种。

表1 精子密度检测结果
3.2 7 h精子活力、72 h精子活力比较分析
采样时记录好每头猪采精时间,按G B 23238—2009《种猪常温精液》[2]要求,将采集的大白、长白、杜洛克、柯乐猪原精液稀释成常温精液放置于16~18 ℃恒温保存箱保存,分别于保存后7 h、72 h后进行活力检测,各品种的猪精子活力有一定差异但差异不大。检测头份及结果见表2。由表2可知,1)7 h精子活力:顺序为柯乐猪>长白>大白>杜洛克;2)72 h精子活力:顺序为柯乐猪>长白>大白>杜洛克。结果表明保存72 h后的精子活力与7 h精子活力成正相关,降低幅度为长白降低18.3个百分点、大白降低18.8个百分点、柯乐猪降低18.9个百分点、杜洛克降低21.9个百分点,72 h精子平均活力≥60%,但此时各品种的标准差偏大,表明各品种精液品质因保存时间的增长活力差异明显。
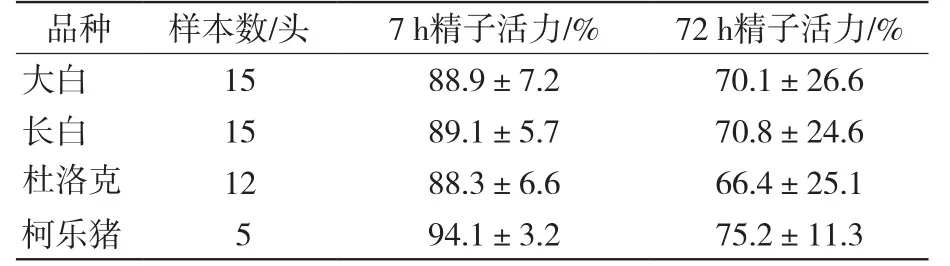
表2 7 h精子活力、72 h精子活力检测结果
3.3 每剂量直线前进运动精子数比较分析
按GB 23238—2009《种猪常温精液》[2]要求,分别对大白、长白、杜洛克、柯乐猪种猪的常温精液进行检测,检测头份及结果见表3。由表3可知,每剂量中直线前进运动精子数为杜洛克>大白>柯乐猪>长白,本项指标的检测结果没有可比性,因此项指标的检测与稀释比例及精子活力有密切关系,密度大则直线前进运动精子数高。

表3 每剂量直线前进运动精子数检测结果
3.4 精子畸形率比较分析
分别对大白、长白、杜洛克、柯乐猪种猪的常温精液进行检测,检测头份及结果见表4。由表4可知,精子畸形率为大白>杜洛克>长白>柯乐猪,引进品种猪大白、长白、杜洛克精子畸形率无明显差异,地方品种柯乐猪的畸形率明显低于引进品种大白、长白、杜洛克猪。
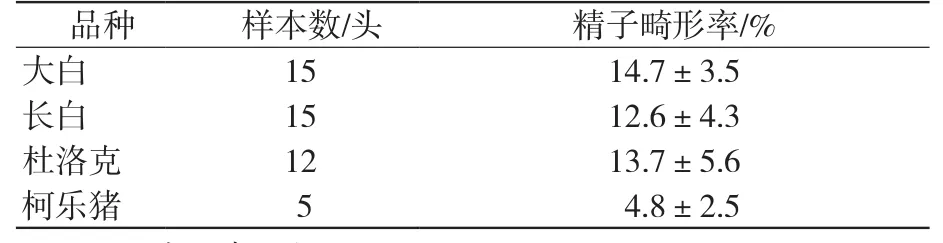
表4 精子畸形率检测结果
4 讨论
本试验采用在贵州省境内饲养的大白、长白、杜洛克、柯乐猪4个品种猪,分别对精子密度、精子活力、每剂量直线前进运动精子数、精子畸形率等指标进行检测结果对比。结果表明,1)精子密度:引进品种大白、长白、杜洛克猪差异不大,地方品种柯乐猪略低于大白、长白、杜洛克引进品种,这可能与引进品种来源于养殖业发达国家,与他们重视育种工作长期选育有关。2)精子活力:大白、长白、杜洛克、柯乐猪4个品种的差异不大,保存3 d后能达到输配要求活力≥60%。地方品种柯乐猪精子活力优于引进品种大白、长白、杜洛克。不同品种公猪的精子活力会因品种、年龄、季节、营养水平、饲养管理等因素有所差异,并且这种差异是客观存在的[4]。3)每剂量直线前进运动精子数:此项指标的检测结果与原精液的稀释比例及精子活力有密切关系,本项检测结果没有可比性,稀释比例越小则密度大,直线前进运动的精子数则高。4)精子畸形率:大白>杜洛克>长白>柯乐猪,引进品种猪大白、长白、杜洛克精子畸形率无明显差异,地方品种柯乐猪的畸形率明显低于大白、长白、杜洛克引进品种。本次研究中地方品种的畸形率明显低于引进品种,建议发挥地方品种柯乐猪畸形率低的优势,加强本地品种猪优势性状的选育工作,培育自有品牌。
影响精液品质的因素很多,如种公猪的营养状况、身体是否有疾病、是否注射疫苗等这些因素都会影响到原精液的品质;而采精技术、精液处理、稀释液、保存温度、实验室环境及技术人员操作水平等将会影响到所制作的常温精液的质量[5]。不论是在国内还是在国外,不同品种猪的精液品质在某些方面存在着客观上的差异是必然的,因为各地动物的营养、生理、环境等方面不可能完全相同,对动物的生精机能产生的影响就自然不会完全一致[6]。本试验以贵州省境内饲养的引进品种和地方品种进行研究,由于样本来源于不同的猪场,各猪场的饲养管理水平不同,同时因样本量不大,此研究为专业技术人员在检测精液品质质量时提供参考。

